
- •Федеральное агентство по образованию
- •Рецензенты:
- •Предисловие
- •Введение
- •Часть I. Основные классы химических соединений, входящие в состав живой материи глава 1. Белки
- •1.1. Функции белков
- •1.2. Аминокислотный состав белков
- •1.3.Структурная организация белков
- •1.4. Физико-химические свойства белков
- •1.5. Классификация белков
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 2. Нуклеиновые кислоты
- •2.1. Химический состав нуклеиновых кислот
- •2.2. Структура нуклеиновых кислот
- •2.2.1. Структура днк
- •2.2.2. Структура рнк
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 3. Ферменты
- •3.1. Классификация ферментов и номенклатура
- •3.2. Активный центр ферментов
- •3.3. Механизм действия ферментов
- •3.4. Кинетика ферментативных реакций
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 4. Витамины
- •4.1. Классификация витаминов
- •4.2. Витамины, растворимые в жирах
- •4.3. Витамины, растворимые в воде
- •4.4. Витаминоподобные вещества
- •4.5. Антивитамины
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 5. Углеводы
- •5.1. Классификация углеводов
- •5.2. Моносахариды
- •Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 6. Липиды
- •6.1. Классификация липидов
- •6.2. Жирные кислоты
- •6.3. Глицериды
- •6.4. Воска
- •6.5. Фосфолипиды
- •6.6. Гликолипиды (гликосфинголипиды)
- •6.7. Стероиды
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 7. Гормоны
- •7.1. Классификация гормонов
- •7.2. Гормоны гипоталамуса
- •7.3. Гормоны гипофиза
- •7.3.3. Гормоны передней доли гипофиза.
- •7.4. Гормоны паращитовидных желез (паратгормоны)
- •7.5. Гормоны щитовидной железы
- •7.6. Гормоны поджелудочной железы
- •7.7. Гормоны надпочечников
- •7.8. Половые гормоны
- •7.9. Гормоны вилочковой железы
- •7.10. Гормоны насекомых
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 8. Молекулярные механизмы гормонального сигнала
- •8.1. Механизм действия стероидных гормонов
- •8.2. Механизм действия гормонов пептидной природы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Часть II. Обмен веществ и энергии в организме
- •Глава 9. Обмен нуклеиновых кислот
- •9.1. Синтез пуриновых нуклеотидов.
- •9.2. Синтез пиримидиновых нуклеотидов
- •9.3. Биосинтез нуклеиновых кислот (биосинтез днк)
- •Распад нуклеиновых кислот
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен белков
- •10.1. Пути распада белков
- •10.2. Судьба всосавшихся аминокислот
- •10.3. Обезвреживание аммиака в организме
- •10.4. Биосинтез белка
- •Генетический кодовый «словарь»
- •10.4.1. Этапы синтеза белка
- •10.5. Регуляция синтеза белка
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 11. Обмен углеводов
- •11.1. Переваривание и всасывание углеводов
- •11.2. Синтез и распад гликогена
- •11.3. Окисление глюкозы
- •11.3.1. Гликолиз
- •Глюкоза Молочная кислота (2 мол)
- •11.3.2. Цикл Кребса
- •11.3.3. Цепь переноса электронов
- •11.4. Глюконеогенез
- •11.5. Пентозофосфатный путь окисления глюкозы
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 12. Обмен липидов
- •12.1. Переваривание и всасывание липидов
- •12.2. Окисление жирных кислот
- •12.3. Биосинтез жирных кислот
- •12.3.1. Биосинтез насыщенных жирных кислот
- •12.3.2. Биосинтез ненасыщенных жирных кислот
- •12.3.3. Синтез триглицеридов
- •12.3.4. Биосинтез холестерина
- •12.4. Нарушения липидного обмена
- •12.4.1. Ожирение
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 13. Биологическое окисление
- •13.1. Ферменты, катализирующие окислительно-восстановительные реакции
- •13.2. Классификация процессов биологического окисления
- •13.2.1. Свободное окисление
- •13.2.2. Окисление, сопряженное с фосфорилированием адф
- •Вопросы и задачи
- •Рекомендуемая литература
- •Глава 14. Взаимосвязь процессов обмена веществ
- •Вопросы и задачи
- •Рекомендуемая литература
- •Библиографический список
- •Глава12. Обмен липидов 127
- •Глава13 . Биологическое окисление 141
- •Глава14. Взаимосвязь обмена веществ 145
3.2. Активный центр ферментов
Ферменты, будучи по своей химической природе белками, являются высокомолекулярными соединениями. Молекулярная масcа ферментов колеблется от 10000 до сотен тысяч дальтон. Длинная цепь фермента сворачивается с образованием «кармана» – участка, называемого активным центром фермента. В этом участке молекула вещества (субстрат) взаимодействует с функциональными группами фермента и претерпевает химические превращения. Активный центр – это уникальная комбинация аминокислотных остатков в молекуле фермента, обеспечивающая непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа (рис. 6).

Рис. 12. Активный центр фермента
В активном центре условно различают каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, или контактную якорную площадку, которая обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом.
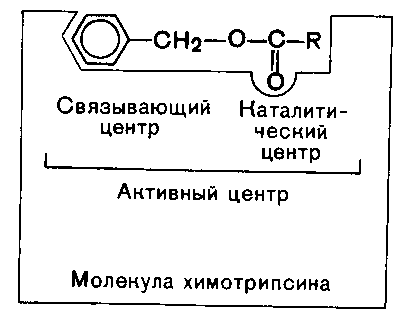
В свою очередь, молекула субстрата также содержит функционально различные участки, одни из которых избирательно взаимодействуют с ферментами, другие подвергаются атаке со стороны фермента.
Формирование активного центра начинается на ранних этапах синтеза белка, а полностью завершается на уровне третичной структуры. Любые воздействия, приводящие к денатурации, т.е. нарушению третичной структуры приводят к искажению или разрушению активного центра.
Помимо активного центра, в молекуле фермента может присутствовать аллостерический центр (центры) (от греч. allos другой, иной и steros пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов.
Присоединение эффектора к аллостерическому центру изменяет третичную и частично четвертичную структуру молекулы фермента и, соответственно, конфигурацию активного центра, вызывая снижение или повышение энзиматической активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов.
Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга.
3.3. Механизм действия ферментов
В основе взаимодействия субстрата и фермента лежат две модели. Первая модель «ключзамок» (или модель «жесткой матрицы»), предложенная Эмилем Фишером. Согласно этой модели жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая высокую специфичность фермента (субстрат подходит к ферменту, т.е. активному центру, как ключ к замку) (рис.13).
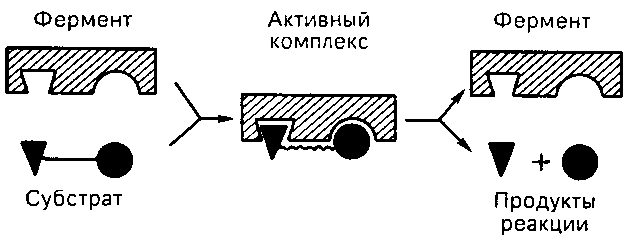
Рис. 13. Образование субстратферментного комплекса
Данная модель имеет значение для понимания некоторых свойств ферментов, например, их способности к строго определенному связыванию двух или более числа субстратов, или для объяснения кинетики насыщения субстратом. Однако недостатком модели Фишера является подразумеваемая в ней жесткость каталитического центра. В модели индуцированного соответствия, предложенной Кошландом, активный центр фермента достаточно гибок и может изменять свою конформацию при связывании субстрата.
Ферменты ускоряют химические реакции за счет снижения энергии активации. Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активизированное состояние при данной температуре (т.е. эта энергия необходима для запуска химической реакции, без которой реакция не начинается, несмотря на ее термодинамическую вероятность). Фермент снижает энергию активации путем увеличения числа активированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне (рис. 14).
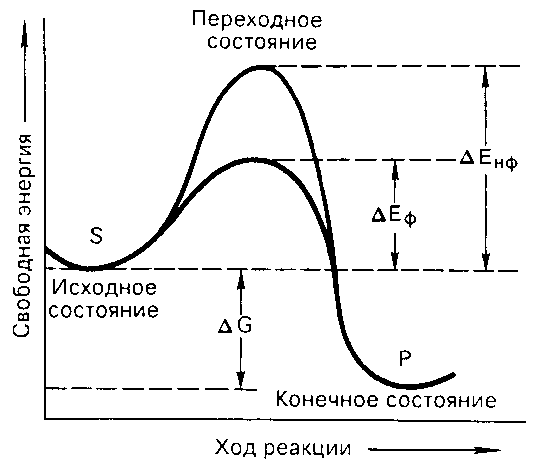
Рис. 14. Энергетический механизм ферментативной и неферментативной химических реакций
S исходный субстрат, Р – продукт, Енф – энергия активации неферментативной реакции, Еф – энергия активации ферментативной реакции, G – стандартное изменение свободной энергии
Действуя на скорость реакции, ферменты не изменяют равновесия между прямой и обратными реакциями, как и не влияют на величину свободной реакции, они лишь ускоряют наступление равновесия химической реакции.
