
- •Вопрос 3. Понятие о полярности и поляризуемости ковалентной связи. Взаимосвязь полярности связи с поляризуемостью атома (молекулы или иона). Мягкие и жесткие атомы, их способность к поляризации.
- •5.Сопряжение (π-π-сопряжение и ρ-π-сопряжение). Сопряженные системы с открытой цепью: 1,3-диены, α, β-ненасыщенные карбонильные соединения, карбоксильная группа как сопряженная система.
- •Реакции, доказывающие наличие двух таутомерных форм в растворе.
- •Кислотно-основные свойства пррола, имидазола, пиридина.
- •Вопрос 10. Хиральность, ахиральность. Плоскость и ось симметрии. Стереоизомерия с двумя и более центрами хиральности: энантиомерия и диастереомерия; привести формулы веществ. Мезоформы и рацематы.
- •Вопрос 14.Реакции элиминирования. Повышенная сн-кислотность как причина реакции элиминирования, конкурентных реакциям нуклеофильного замещения у sp3-гибридизованного атома углерода.
- •Вопрос 15.Особенности реакций электрофильного присоединения у алкадиенов, алкинов, малых циклов, α,β-ненасыщенных альдегидов и карбоновых кислот (гидратация, гидрогалогенирование).
- •Вопрос 22.Строение, химические и физические свойства винной кислоты-оптическая активность, мезоформы. Строение, свойства и значение двухосновных кислот: щавелевой, янтарной, глутаровой.
- •Вопрос 24.Стереоизомерия в ряду соединений с двойной связью: π-диастереомерия (цис- и транс- изомеры). Малеиновая и фумаровая кислоты, их медико-биологическое значение.
- •Вопрос 27.Желчные кислоты: холевая, гликохолевая, таурохолевая. Строение, биороль.
- •Вопрос 28.Угольная кислота и её производные (мочевина, уретаны, уреиды): строение, биороль и применение в медицине.
- •Вопрос 29. Лимонная кислота,-строение, свойства, значение, образование из щавелевоуксусной кислоты. Реакции разложения при нагревании.
- •Вопрос 32. Сложные жиры, производные фосфатидиловых: фосфолипиды. Строение, биороль. Гидролиз (полный и частичный).
- •Вопрос 33.Сфинголипиды: церамиды, сфингомиелины, их строение. Понятие о структурных компонентах. Значение.
- •Вопрос 34. Аминоспирты: коламин, холин, ацетилхолин. Аминофенолы: дофамин, адреналин, норадреналин. Строение, пути биосинтеза, биологическая роль.
- •Вопрос 35. Кефалины и лецитины-структурные компоненты клеточных мембран. Состав, строение, биороль. Бифильность сложных липидов
- •Вопрос 37. Многоатомные спирты. Строение и номенклатура. Химические свойства: кислотность, образование хелатных комплексов, образование простых и сложных эфиров, окисление.
- •Вопрос 39. Неомыляемые липиды. Стерины. Холестерин,-строение, роль в организме.
- •Вопрос 40. Гликолипиды: цереброзиды, ганглиозиды. Понятие о структурных компонентах. Бифильность сложных липидов. Значение.
- •Вопрос 41. Неомыляемые липиды. Классификация. Каротиноиды: β-каротин. Строение, значение.
- •Вопрос 42. Углеводы. Общая классификация. Моносахариды. Конформации пираноз. Образование и гидролиз о- и n-гликозидов.
- •Вопрос 45.Невосстанавливающие сахара: рафиноза. Строение, гидролиз, гликозидная связь.
- •Вопрос 46. Хондроитинсульфат и гиалуроновая кислота-гетерополисахариды. Строение, свойства, биороль.
- •Вопрос 49. Гомополисахариды: гликоген, целлюлоза. Строение, свойства, биороль. Гидролиз гликогена.
- •Вопрос 50. Явление таутомерии моносахаридов. Написать схему таутомерных превращений д-ксилозы в растворе. Мутаротация моносахоридов.
- •Вопрос 52. Гепарин, его состав, свойства, значение. Пектины: строение полигалактуроновой кислоты, биороль.
- •Вопрос 53. Пиразол, имидазол, тиазол, пиридин, пиримидин, пурин,-гетероциклы с несколькими гетероатомами: строение, значение. Кислотные и основные свойства этих гетероциклов.
- •Вопрос 55. Мочевина: строение, ферментативный и щелочной гидролиз, образование биурета (хелатного комплекса). Количественное определение мочевины. Гуанидин.
- •Вопрос 58. Гидрокси- и аминокислоты как гетерофункциональные соединения. Реакции α-аминокислот со щелочами, спиртами, формальдегидом, соляной кислотой, гидроксидом меди (ιι), дезаминирование.
- •61.Реакции α,- β-,γ-амино- и гидроксикислот, протекающие при нагревании. Формольное титрование, его значение. Качественные реакции на α-аминокислоты.
- •Вопрос 62. Образование α-аминокислот из α-кетокислот: восстановительное аминирование, транс-аминирование (переаминирование).
- •Вопрос 66. Биологическая роль пара-аминобензойной кислоты (пабк). Производные пабк: анестезин, новокаин,-строение, применение в медицине
- •Вопрос 68.Сульфаниловая кислота и её амид-стрептоцид (строение, получение из анилина). Применение в медицине и механизм действия сульфаниламидных препаратов.
- •Вопрос 72. Нуклеиновые кислоты: рнк и днк. Строение: нуклеотидный состав, сходство и различие в строении, функции. Минорные основания.
- •Вопрос 73. Комплементарность азотистых оснований. Образование водородных связей в комплементарных парах нуклеиновых оснований. Дезаминирование азотистых оснований.
- •Вопрос 74. Нуклеотиды (рибонуклеотиды и дезоксирибонуклеотиды): строение, номенклатура, частичный и полный гидролиз.
- •Вопрос 75. Нуклеозиды, их строение, значение, гидролиз.
- •Вопрос 76. Строение пиримидиновых оснований: урацила, тимина, цитозина и пуриновых оснований: аденина, гуанина. Лактим-лактамная и другие виды таутомерии. Значение.
- •Вопрос 77.Первичная структура нуклеиновых кислот. Рнк и днк, их нуклеотидный состав. Фосфодиэфирная и гликозидная связь. Гидролиз.
- •Вопрос 79. Первичная, вторичная, третичная и четвертичная структуры белков,-химические связи, обеспечивающие сохранение данной структуры. Денатурация и ренатурация белков.
- •Вопрос 80. Виды рнк и их функции. Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Роль нуклеиновых кислот в биоситезе белка.
- •Вопрос 82. Синтез пептидов с учетом защиты и активации.
- •Вопрос 83. Мутагенное действие азотистой кислоты на структуру нуклеиновых кислот. Нуклеозиды-антибиотики: кордицепин, арабинозид аденина, их строение, биороль.
- •Вопрос 84. Алкалоиды. Принципы классификации. Значение для медицины. Наркотики: морфин, кофеин, никотин: строение, действие на организм.
- •Вопрос 85. Алкалоиды, их характеристика и источники получения. Атропин, кокаин, героин: строение, использование в медицине.
Вопрос 27.Желчные кислоты: холевая, гликохолевая, таурохолевая. Строение, биороль.
Желчные кислоты играют важную роль в процессе обмена жиров. Алифатическая боковая цепь у С-17 в желчных кислотах — производных углеводорода холана — состоит из пяти атомов углерода и включает концевую карбоксильную группу Из желчи человека выделены четыре кислоты, которые получили название холевых кислот. Наиболее распространенная среди них — сама холевая кислота. Все гидроксильные группы в ней имеют альфа-расположение, а кольца А и В — цис-сочленение.

Другие кислоты этой группы отличаются отсутствием одной или двух гидроксильных трупа у С-17 и С-12. Желчные кислоты находятся в организме также в виде амидов по карбоксильной группе. Посредством амидной связи к ним могут быть присоединены остатки глицина Н2N-СН2-СООН, как в гликохолевой кислоте, или таурина Н2N-СН2-СН2-SО3H, как в таурохолевой кислоте. Натриевые и калиевые соли желчных кислот обладают поверхностно-активными свойствами. Эмульгируя жиры пищи, они улучшают их усвоение, а также активируют фермент липазу, катализирующий гидролиз жиров.
Вопрос 28.Угольная кислота и её производные (мочевина, уретаны, уреиды): строение, биороль и применение в медицине.
Угольная кислота НО-С(О)-ОH занимает особое место среди соединений углерода. Она не имеет гомологов, и любое замещение в ней ведет к получению функционального производного. Формально ее можно рассматривать одновременно как гидроксикислоту (гидроксимуравьиная) и двухосновную карбоновую кислоту. Угольная кислота и ее производные выполняют важные функции в организме, используются в синтетической практике, некоторые из них применяются в качестве лекарственных средств.
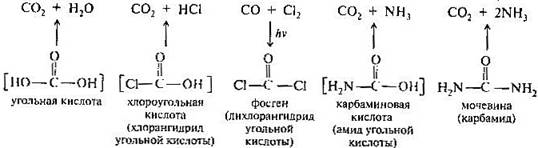
Угольная кислота как индивидуальное соединение существует только в водном растворе. Попытка выделить кислоту из раствора приводит к ее разложению на диоксид углерода и воду.
В водном растворе H2CO3 заметно диссоциирована. Угольная кислота и гидрокарбонат-ион НСО3- составляют буферную систему, играющую определяющую роль в поддержании постоянного значения концентрации ионов водорода в крови. Диоксид углерода (углекислый газ) СО2 — участник многих важных реакций‚ карбоксилирования и декарбоксилирования in vivo и in vitro. Карбоксилирование возможно в тех случаях, когда в реакцию с диоксидом углерода вступают соединения с частичным отрицательным зарядом на атоме углерода. Реакция диоксида углерода с ацилкоферментом А, приводящая in vivo к образованию малонилкофермента А. Подобно самой угольной кислоте, в свободном виде известны и некоторые ее производные: хлоругольная (хлоромуравьиная) кислота СlСООН и карбаминовая кислота (моноамид) Н2NСООН. Однако их сложные эфиры вполне стабильные соединения. Для синтеза производных угольной кислоты может быть использован ее дихлорангидрид — фосген СОСl2, легко образующийся при взаимодействии монооксида углерода с хлором на свету. Фосген — чрезвычайно ядовитый газ. В первую мировую войну он применялся в качестве боевого отравляющего вещества. Некоторые эфиры хлоругольной кислоты, в частности бензиловый (карбобензоксихлорид) С6Н5-СН2-О-С(О)Сl и трет-бутиловый (третбутоксикарбонилхлорид) (СН3)3-С-О-С(О)Сl, широко применяются в синтезе пептидов. Этиловый эфир хлоромуравьиной кислоты при реакции с аммиаком образует этиловый эфир карбаминовой кислоты Н2N-СОО-С2Н5. Эфиры карбаминовой кислоты имеют общее название — уретаны. Мочевина (карбамид) Н2N-С(О)-NН2 — диамид угольной кислоты — важнейший азотсодержащий конечный продукт обмена веществ у человека (с мочой выделяется около 20-30 г мочевины в сутки). В промышленности мочевину получают из аммиака и диоксида углерода при повышенном давлении и температуре (180— 230°С, 150—200 атм). Мочевина обладает основными свойствами и образует соли с одним эквивалентом кислоты (протонирование происходит по атому кислорода). Некоторые из солей, например оксалат и нитрат, плохо растворимы в воде. Кислоты и щелочи при нагревании вызывают гидролиз мочевины; ферментативно она гидролизуется под действием уреазы.

При медленном нагревании до температуры 150—160°С мочевина разлагается с выделением аммиака и образованием биурет.
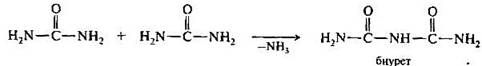
При взаимодействия биурета в щелочных растворах с ионами меди(II) наблюдается характерное фиолетовое окрашивание, обусловленное образованием хелатного комплекса (биуретовая реакция).

Остаток биурета в хелатном комплексе имеет имидную структуру. Важными производными карбоновых кислот, содержащими остаток мочевины в качестве заместителя, являются уреиды. По аналогии с амидами кислот и аминокислотами различают уреиды кислот и уреидокислоты.

Широкое распространение в качестве лекарственных средств, действующих на центральную нервную систему, получили циклические уреиды малоновой кислоты — барбитураты.
Иминомочевина (гуанидин) — азотистое производное мочевины — является сильным основанием, поскольку ее сопряженная кислота — катион гуанидиния — стабилизирован за счет сопряжения.

