
- •Вопрос 3. Понятие о полярности и поляризуемости ковалентной связи. Взаимосвязь полярности связи с поляризуемостью атома (молекулы или иона). Мягкие и жесткие атомы, их способность к поляризации.
- •5.Сопряжение (π-π-сопряжение и ρ-π-сопряжение). Сопряженные системы с открытой цепью: 1,3-диены, α, β-ненасыщенные карбонильные соединения, карбоксильная группа как сопряженная система.
- •Реакции, доказывающие наличие двух таутомерных форм в растворе.
- •Кислотно-основные свойства пррола, имидазола, пиридина.
- •Вопрос 10. Хиральность, ахиральность. Плоскость и ось симметрии. Стереоизомерия с двумя и более центрами хиральности: энантиомерия и диастереомерия; привести формулы веществ. Мезоформы и рацематы.
- •Вопрос 14.Реакции элиминирования. Повышенная сн-кислотность как причина реакции элиминирования, конкурентных реакциям нуклеофильного замещения у sp3-гибридизованного атома углерода.
- •Вопрос 15.Особенности реакций электрофильного присоединения у алкадиенов, алкинов, малых циклов, α,β-ненасыщенных альдегидов и карбоновых кислот (гидратация, гидрогалогенирование).
- •Вопрос 22.Строение, химические и физические свойства винной кислоты-оптическая активность, мезоформы. Строение, свойства и значение двухосновных кислот: щавелевой, янтарной, глутаровой.
- •Вопрос 24.Стереоизомерия в ряду соединений с двойной связью: π-диастереомерия (цис- и транс- изомеры). Малеиновая и фумаровая кислоты, их медико-биологическое значение.
- •Вопрос 27.Желчные кислоты: холевая, гликохолевая, таурохолевая. Строение, биороль.
- •Вопрос 28.Угольная кислота и её производные (мочевина, уретаны, уреиды): строение, биороль и применение в медицине.
- •Вопрос 29. Лимонная кислота,-строение, свойства, значение, образование из щавелевоуксусной кислоты. Реакции разложения при нагревании.
- •Вопрос 32. Сложные жиры, производные фосфатидиловых: фосфолипиды. Строение, биороль. Гидролиз (полный и частичный).
- •Вопрос 33.Сфинголипиды: церамиды, сфингомиелины, их строение. Понятие о структурных компонентах. Значение.
- •Вопрос 34. Аминоспирты: коламин, холин, ацетилхолин. Аминофенолы: дофамин, адреналин, норадреналин. Строение, пути биосинтеза, биологическая роль.
- •Вопрос 35. Кефалины и лецитины-структурные компоненты клеточных мембран. Состав, строение, биороль. Бифильность сложных липидов
- •Вопрос 37. Многоатомные спирты. Строение и номенклатура. Химические свойства: кислотность, образование хелатных комплексов, образование простых и сложных эфиров, окисление.
- •Вопрос 39. Неомыляемые липиды. Стерины. Холестерин,-строение, роль в организме.
- •Вопрос 40. Гликолипиды: цереброзиды, ганглиозиды. Понятие о структурных компонентах. Бифильность сложных липидов. Значение.
- •Вопрос 41. Неомыляемые липиды. Классификация. Каротиноиды: β-каротин. Строение, значение.
- •Вопрос 42. Углеводы. Общая классификация. Моносахариды. Конформации пираноз. Образование и гидролиз о- и n-гликозидов.
- •Вопрос 45.Невосстанавливающие сахара: рафиноза. Строение, гидролиз, гликозидная связь.
- •Вопрос 46. Хондроитинсульфат и гиалуроновая кислота-гетерополисахариды. Строение, свойства, биороль.
- •Вопрос 49. Гомополисахариды: гликоген, целлюлоза. Строение, свойства, биороль. Гидролиз гликогена.
- •Вопрос 50. Явление таутомерии моносахаридов. Написать схему таутомерных превращений д-ксилозы в растворе. Мутаротация моносахоридов.
- •Вопрос 52. Гепарин, его состав, свойства, значение. Пектины: строение полигалактуроновой кислоты, биороль.
- •Вопрос 53. Пиразол, имидазол, тиазол, пиридин, пиримидин, пурин,-гетероциклы с несколькими гетероатомами: строение, значение. Кислотные и основные свойства этих гетероциклов.
- •Вопрос 55. Мочевина: строение, ферментативный и щелочной гидролиз, образование биурета (хелатного комплекса). Количественное определение мочевины. Гуанидин.
- •Вопрос 58. Гидрокси- и аминокислоты как гетерофункциональные соединения. Реакции α-аминокислот со щелочами, спиртами, формальдегидом, соляной кислотой, гидроксидом меди (ιι), дезаминирование.
- •61.Реакции α,- β-,γ-амино- и гидроксикислот, протекающие при нагревании. Формольное титрование, его значение. Качественные реакции на α-аминокислоты.
- •Вопрос 62. Образование α-аминокислот из α-кетокислот: восстановительное аминирование, транс-аминирование (переаминирование).
- •Вопрос 66. Биологическая роль пара-аминобензойной кислоты (пабк). Производные пабк: анестезин, новокаин,-строение, применение в медицине
- •Вопрос 68.Сульфаниловая кислота и её амид-стрептоцид (строение, получение из анилина). Применение в медицине и механизм действия сульфаниламидных препаратов.
- •Вопрос 72. Нуклеиновые кислоты: рнк и днк. Строение: нуклеотидный состав, сходство и различие в строении, функции. Минорные основания.
- •Вопрос 73. Комплементарность азотистых оснований. Образование водородных связей в комплементарных парах нуклеиновых оснований. Дезаминирование азотистых оснований.
- •Вопрос 74. Нуклеотиды (рибонуклеотиды и дезоксирибонуклеотиды): строение, номенклатура, частичный и полный гидролиз.
- •Вопрос 75. Нуклеозиды, их строение, значение, гидролиз.
- •Вопрос 76. Строение пиримидиновых оснований: урацила, тимина, цитозина и пуриновых оснований: аденина, гуанина. Лактим-лактамная и другие виды таутомерии. Значение.
- •Вопрос 77.Первичная структура нуклеиновых кислот. Рнк и днк, их нуклеотидный состав. Фосфодиэфирная и гликозидная связь. Гидролиз.
- •Вопрос 79. Первичная, вторичная, третичная и четвертичная структуры белков,-химические связи, обеспечивающие сохранение данной структуры. Денатурация и ренатурация белков.
- •Вопрос 80. Виды рнк и их функции. Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Роль нуклеиновых кислот в биоситезе белка.
- •Вопрос 82. Синтез пептидов с учетом защиты и активации.
- •Вопрос 83. Мутагенное действие азотистой кислоты на структуру нуклеиновых кислот. Нуклеозиды-антибиотики: кордицепин, арабинозид аденина, их строение, биороль.
- •Вопрос 84. Алкалоиды. Принципы классификации. Значение для медицины. Наркотики: морфин, кофеин, никотин: строение, действие на организм.
- •Вопрос 85. Алкалоиды, их характеристика и источники получения. Атропин, кокаин, героин: строение, использование в медицине.
Вопрос 58. Гидрокси- и аминокислоты как гетерофункциональные соединения. Реакции α-аминокислот со щелочами, спиртами, формальдегидом, соляной кислотой, гидроксидом меди (ιι), дезаминирование.






61.Реакции α,- β-,γ-амино- и гидроксикислот, протекающие при нагревании. Формольное титрование, его значение. Качественные реакции на α-аминокислоты.




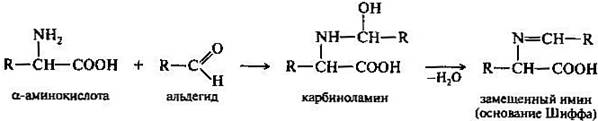
При взаимодействии альфа-аминокислот с альдегидами образуются замещенные имины (основания Шиффа) через стадию образования карбиноламинов. Реакция с формальдегидом лежит в основе количественного определения альфа-аминокислот методом формольного титрования (метод Сёренсена).
Качественные реакции. Особенность химии аминокислот и белков заключается в использовании многочисленных качественных (как правило, цветных) реакций, составлявших ранее основу химического анализа. В настоящее время, когда исследование проводится с помощью физико-химических методов, многие качественные реакции продолжают применяться для обнаружения альфа-аминокислот в хроматографическом анализе. Общая качественная реакция альфа-аминокислот реакция с нингидрином. Продукт нингидринной реакции имеет сине-фиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое), а также спектрофотометрического определения с помощью аминокислотных анализаторов (продукт поглощает свет в области 550—570 нм).


Для обнаружения пептидных связей в пептидах и белках служит биуретовая реакция, в которую вступают все пептиды и белки, содержащие по крайней мере две такие связи. Существует также ряд частных реакций, позволяющих обнаруживать отдельные аминокислоты или группы родственных аминокислот. Триптофан обнаруживают при помощи реакции с пара-диметиламинобензальдегидом в среде серной кислоты по появляющемуся красно-фиолетовому окрашиванию (реакция Эрлиха). Эта реакция используется для количественного анализа триптофана в продуктах расщепления белков. Цистеин обнаруживается с помощью нескольких качественных реакций основанных на реакционной способности содержащейся в нем меркаптогруппы. Например, при нагревании раствора белка с ацетатом свинца (СН3СОО)2Рb в щелочной среде образуется черный осадок сульфида свинца РbS, что указывает на присутствие в белках цистеина. Для обнаружения ароматических и гетероциклических аминокислот используется ксантопротеиновая реакция (реакция на фенилаланин тирозин, гистидин, триптофан). Например, при действии концентрированной азотной кислотой на тирозин образуется нитросоединение окрашенное в желтый цвет. При добавлении к нему щелочи окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.

62.Аминокислоты: строение, классификация, номенклатура. Стереоизомерия α-аминокислот. Кислотно-основные свойства: биполярный ион, изоэлектрическая точка, взаимосвязь рН и pJ; расчет изоэлектрической точки; рКа1, рКа2, рКа3
Незаменимые альфа-аминокислоты – валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.
![]()
![]()
![]()
![]()
![]()
![]()
![]()

Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой. Значение рI в общем случае вычисляется по формуле pI = ½(pKa(n) + pKa(n+1)) где n — максимальное число положительных зарядов в полностью протонированной аминокислоте. В изоэлектрической точке суммарный заряд молекулы аминокислоты равен 0. Диполярные ионы не перемещаются в электрическом поле. При значениях рН среды ниже значения рI катион альфа-аминокислоты (аммониевая форма) движется к катоду; при рН выше, чем рI, ацилат-ион альфа-аминокислоты перемещается к аноду. На этом основано разделение аминокислот методом электрофореза.
Большинство аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные альфа-аминокислоты принадлежат к L-ряду.

Аминокислоты — изолейцин, треонин, 4-гидроксипролин — содержат в молекуле по два центра хиральности. Эти аминокислоты могут существовать в виде четырех диастереомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Из этих четырех стереоизомеров для построения белков человеческого организма используется только один.
Вопрос 61.Химические свойства α-аминокислот: образование внутрикомплексных соединений, этерификация, ацилирование, алкилирование, образование иминов, отношение к нагреванию ( специфическая реакция циклизации). Формольное титрование, его значение
Образование эфиров. При этерификации аминокислот спиртами в присутствии кислотного катализатора (газообразной НСl) с хорошим выходом получаются сложные эфиры в виде гидрохлоридов. Для выделения свободных эфиров реакционную смесь обрабатывают газообразным аммиаком (все реактивы должны быть безводными во избежание гидролиза эфиров).

Образование N-ацильных производных. При ацилировании аминокислот галогенангидридами или ангидридами получаются соединения, которые можно рассматривать либо как N-ацильные производные, либо как N-замещенные амиды.

N-Ацилпроизводные гидролизуются с образованием исходной аминокислоты. Поэтому реакция ацилирования широко используется для защиты аминогруппы.
Образование оснований Шиффа. При взаимодействии аминокислот с альдегидами образуются замещенные имины (основания Шиффа) через стадию образования карбиноламинов.

Реакция с формальдегидом лежит в основе количественного определения аминокислот методом формольного титрования (метод Сёренсена).
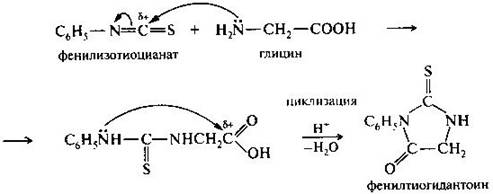
Образование ФТГ-производных (реакция Эдмана). Эта реакции широко используется при установлении строения пептидов. Взаимодействие аминокислот с фенилизотиоцианатом протекает по механизму нуклеофильного присоединения. В образовавшемся продукте далее осуществляется внутримолекулярная реакция нуклеофильного замещения, приводящая к образованию циклического замещенного амида.
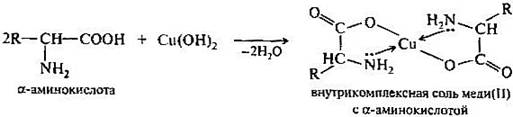
С катионами тяжелых металлов аминокислоты как бифункциональные соединения, образуют внутрикомплексные соли, например, со гидроксидом меди(II) в мягких условиях получаются хорошо кристаллизующиеся хелатные соли меди(II) синего цвета (один из неспецифических способов обнаружения аминокислот).
Образование ДНФ-производных. Аминокислоты образуют с 2,4-динитрофторбензолом (ДНФБ) окрашенные в желтый цвет динитрофенильные производные (ДНФ-производные растворимые в органических растворителях). Они экстрагируются из реакционной смеси органическими растворителями и используются для идентификации методом тонкослойной хроматографии. Взаимодействие аминокислот с ДНФБ представляет собой реакцию нуклеофильного замещения в бензольном кольце. Такое замещение становится возможным за счет влияния двух сильных нитрогрупп.

