
- •Вопрос 3. Понятие о полярности и поляризуемости ковалентной связи. Взаимосвязь полярности связи с поляризуемостью атома (молекулы или иона). Мягкие и жесткие атомы, их способность к поляризации.
- •5.Сопряжение (π-π-сопряжение и ρ-π-сопряжение). Сопряженные системы с открытой цепью: 1,3-диены, α, β-ненасыщенные карбонильные соединения, карбоксильная группа как сопряженная система.
- •Реакции, доказывающие наличие двух таутомерных форм в растворе.
- •Кислотно-основные свойства пррола, имидазола, пиридина.
- •Вопрос 10. Хиральность, ахиральность. Плоскость и ось симметрии. Стереоизомерия с двумя и более центрами хиральности: энантиомерия и диастереомерия; привести формулы веществ. Мезоформы и рацематы.
- •Вопрос 14.Реакции элиминирования. Повышенная сн-кислотность как причина реакции элиминирования, конкурентных реакциям нуклеофильного замещения у sp3-гибридизованного атома углерода.
- •Вопрос 15.Особенности реакций электрофильного присоединения у алкадиенов, алкинов, малых циклов, α,β-ненасыщенных альдегидов и карбоновых кислот (гидратация, гидрогалогенирование).
- •Вопрос 22.Строение, химические и физические свойства винной кислоты-оптическая активность, мезоформы. Строение, свойства и значение двухосновных кислот: щавелевой, янтарной, глутаровой.
- •Вопрос 24.Стереоизомерия в ряду соединений с двойной связью: π-диастереомерия (цис- и транс- изомеры). Малеиновая и фумаровая кислоты, их медико-биологическое значение.
- •Вопрос 27.Желчные кислоты: холевая, гликохолевая, таурохолевая. Строение, биороль.
- •Вопрос 28.Угольная кислота и её производные (мочевина, уретаны, уреиды): строение, биороль и применение в медицине.
- •Вопрос 29. Лимонная кислота,-строение, свойства, значение, образование из щавелевоуксусной кислоты. Реакции разложения при нагревании.
- •Вопрос 32. Сложные жиры, производные фосфатидиловых: фосфолипиды. Строение, биороль. Гидролиз (полный и частичный).
- •Вопрос 33.Сфинголипиды: церамиды, сфингомиелины, их строение. Понятие о структурных компонентах. Значение.
- •Вопрос 34. Аминоспирты: коламин, холин, ацетилхолин. Аминофенолы: дофамин, адреналин, норадреналин. Строение, пути биосинтеза, биологическая роль.
- •Вопрос 35. Кефалины и лецитины-структурные компоненты клеточных мембран. Состав, строение, биороль. Бифильность сложных липидов
- •Вопрос 37. Многоатомные спирты. Строение и номенклатура. Химические свойства: кислотность, образование хелатных комплексов, образование простых и сложных эфиров, окисление.
- •Вопрос 39. Неомыляемые липиды. Стерины. Холестерин,-строение, роль в организме.
- •Вопрос 40. Гликолипиды: цереброзиды, ганглиозиды. Понятие о структурных компонентах. Бифильность сложных липидов. Значение.
- •Вопрос 41. Неомыляемые липиды. Классификация. Каротиноиды: β-каротин. Строение, значение.
- •Вопрос 42. Углеводы. Общая классификация. Моносахариды. Конформации пираноз. Образование и гидролиз о- и n-гликозидов.
- •Вопрос 45.Невосстанавливающие сахара: рафиноза. Строение, гидролиз, гликозидная связь.
- •Вопрос 46. Хондроитинсульфат и гиалуроновая кислота-гетерополисахариды. Строение, свойства, биороль.
- •Вопрос 49. Гомополисахариды: гликоген, целлюлоза. Строение, свойства, биороль. Гидролиз гликогена.
- •Вопрос 50. Явление таутомерии моносахаридов. Написать схему таутомерных превращений д-ксилозы в растворе. Мутаротация моносахоридов.
- •Вопрос 52. Гепарин, его состав, свойства, значение. Пектины: строение полигалактуроновой кислоты, биороль.
- •Вопрос 53. Пиразол, имидазол, тиазол, пиридин, пиримидин, пурин,-гетероциклы с несколькими гетероатомами: строение, значение. Кислотные и основные свойства этих гетероциклов.
- •Вопрос 55. Мочевина: строение, ферментативный и щелочной гидролиз, образование биурета (хелатного комплекса). Количественное определение мочевины. Гуанидин.
- •Вопрос 58. Гидрокси- и аминокислоты как гетерофункциональные соединения. Реакции α-аминокислот со щелочами, спиртами, формальдегидом, соляной кислотой, гидроксидом меди (ιι), дезаминирование.
- •61.Реакции α,- β-,γ-амино- и гидроксикислот, протекающие при нагревании. Формольное титрование, его значение. Качественные реакции на α-аминокислоты.
- •Вопрос 62. Образование α-аминокислот из α-кетокислот: восстановительное аминирование, транс-аминирование (переаминирование).
- •Вопрос 66. Биологическая роль пара-аминобензойной кислоты (пабк). Производные пабк: анестезин, новокаин,-строение, применение в медицине
- •Вопрос 68.Сульфаниловая кислота и её амид-стрептоцид (строение, получение из анилина). Применение в медицине и механизм действия сульфаниламидных препаратов.
- •Вопрос 72. Нуклеиновые кислоты: рнк и днк. Строение: нуклеотидный состав, сходство и различие в строении, функции. Минорные основания.
- •Вопрос 73. Комплементарность азотистых оснований. Образование водородных связей в комплементарных парах нуклеиновых оснований. Дезаминирование азотистых оснований.
- •Вопрос 74. Нуклеотиды (рибонуклеотиды и дезоксирибонуклеотиды): строение, номенклатура, частичный и полный гидролиз.
- •Вопрос 75. Нуклеозиды, их строение, значение, гидролиз.
- •Вопрос 76. Строение пиримидиновых оснований: урацила, тимина, цитозина и пуриновых оснований: аденина, гуанина. Лактим-лактамная и другие виды таутомерии. Значение.
- •Вопрос 77.Первичная структура нуклеиновых кислот. Рнк и днк, их нуклеотидный состав. Фосфодиэфирная и гликозидная связь. Гидролиз.
- •Вопрос 79. Первичная, вторичная, третичная и четвертичная структуры белков,-химические связи, обеспечивающие сохранение данной структуры. Денатурация и ренатурация белков.
- •Вопрос 80. Виды рнк и их функции. Вторичная структура днк. Роль водородных связей в формировании вторичной структуры. Роль нуклеиновых кислот в биоситезе белка.
- •Вопрос 82. Синтез пептидов с учетом защиты и активации.
- •Вопрос 83. Мутагенное действие азотистой кислоты на структуру нуклеиновых кислот. Нуклеозиды-антибиотики: кордицепин, арабинозид аденина, их строение, биороль.
- •Вопрос 84. Алкалоиды. Принципы классификации. Значение для медицины. Наркотики: морфин, кофеин, никотин: строение, действие на организм.
- •Вопрос 85. Алкалоиды, их характеристика и источники получения. Атропин, кокаин, героин: строение, использование в медицине.
Вопрос 1. Теория строения органических соединений А. М. Бутлерова. Номенклатура органических соединений. Изомерия, её виды; привести примеры. Конформации открытых цепей (формулы Ньюмена) и циклических соединений.
1. А. М. Бутлеров ввел понятие о химическом строении,т.е. о последовательности межатомных связей в молекуле. В основе его теории лежит положение: от их химического строения соединений, зависят свойства соединений. В этой теории также заложена идея о взаимном влиянии как соседних, так и не связанных атомов в молекуле, которая еще при жизни А. М. Бутлерова нашла развитие в трудах его учеников, в первую очередь В. В. Марковникова, и продолжает развиваться в настоящее время. Опираясь на положения теории строения, А. М. Бутлеров дал объяснение явлению изомерии, предсказал существование изомеров и впервые получил некоторые из них. Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию.
2. Номенклатура - система правил, позволяющих дать однозначное название каждому индивидуальному соединению. В настоящее время общепринятой является систематическая номенклатура ИЮПАК. Употребление некоторых укоренившихся тривиальных названий (уксусная кислота, толуол, бензойная кислота и др.) разрешается правилами ИЮПАК. Для использования систематической номенклатуры ИЮПАК необходимо знать следующие номенклатурные термины:
• органический радикал – это остаток органической молекулы,из которой удалили один или несколько атомов водорода, оставив свободными одну или несколько валентностей.
• родоначальная структура - это химическая структура,лежащая в основе молекулы.(главная углеродная цепь в ациклических соединениях или цикл- в карбоциклических и гетероциклических соединениях).
• характеристическая группа - функциональная группа,связанная с родоначальной структурой или частично входящая в её состав
• заместитель - это любая функциональная группа или углеводородный радикал,присоединенные к родоначальной структуре
Составление названия органического соединения по заместительной номенклатуре производят в описанной ниже последовательности:
1. Определяют старшую характеристическую группу (если она присутствует) и родоначальную структуру соединения. Главную цепь атомов углерода в ациклических соединениях выбирают по приведенным ниже критериям:
• максимальное число характеристических групп, обозначаемых как префиксами, так и суффиксами;
• максимальное число кратных связей;
• максимальная длина цепи атомов углерода;
• максимальное число характеристических групп, обозначаемых только префиксами.
Каждый последующий критерий используют в том случае, если предыдущий не приводит к однозначному выводу.
2. Нумеруют атомы родоначальной структуры с условием, чтобы старшая характеристическая группа получила наименьший номер. Если это правило не позволяет выбрать однозначно направление нумерации, то цепь (или цикл) нумеруют так, чтобы заместители получили наименьшие номера. В гетероцикле начало нумерации определяет гетероатом(не углерод).
3. Называют родоначальную структуру, обозначая старшую характеристическую группу суффиксом. Степень насыщенности родоначальной структуры отражают в ее названии суффиксами: -ан в случае насыщенного углеродного скелета, -ен — при наличии двойной и -ин — тройной связей.
4. Называют заместители, обозначаемые префиксами, в едином алфавитном порядке. Положение каждого заместителя и каждой кратной связи указывают цифрами, соответствующими номеру атома углерода, с которым связан заместитель (для кратной связи указывают наименьший номер). Цифры ставят перед префиксами и после суффиксов (цифра, указывающая положение старшей характеристической группы или кратной связи, может стоять и перед названием родоначальной структуры).
CH3-CH2-CH2-CH3 –бутан, CH3-CH2-CH=CH2 – бутен, CH2=CH-CH2-CH3 бутен-1,CH3-CH=CH-CH3 – бутен-2
Радикально-функциональная номенклатура.Она применяется для некоторых классов органических соединений — спиртов, кетонов, простых эфиров и др. Для соединений с одной характеристической группой название составляют из названий углеводородных радикалов, а наличие характеристической группы в отличие от заместительной номенклатуры отражают не суффиксом, а названием соответствующего класса соединений. Для соединений с разными характеристическими группами в качестве названия класса используют название более старшего класса, а все остальные группы обозначают префиксами. Например, CH3-CH2-C=0
|
H (пропаналь)
В симметрично построенных соединениях перед названием соответствующего ради кала ставят префикс ди-.
CH2=CH-CH=CH2 – бутадиен
3. Изомеры - соединения с одинаковым составом, но отличаются последовательностью связывания атомов и (или) расположением их в пространстве.
Изомеры делят на две основные группы: Структурные и пространственные (стереоизомеры).
1. Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением. C5H12 CH3-CH2-CH2-CH2-CH3 n-пентан и CH3-CH-CH2-CH3 2-метилбутан
| CH3
Структурные изомеры делятся на ряд групп:
• изомеры цепи ();
• изомеры положения кратных связей(двойных) (бутен-1 и бутен-2)
• изомеры функциональных групп групп (бутанол-1 и бутанол-2); (OH первая или вторая справа)
Стереоизомеры-соединения, в молекулах которых имеется одинаковая последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве. Стереоизомеры могут отличаться конфигурацией и конформацией. Конфигурация — это порядок расположения атомов в пространстве.Результатом различного пространственного расположения атомов в молекуле является существование конфигурационных изомеров с одинаковым химическим строением.

Конформация – молекулы представляют собой различные геометрические формы, возникающие в результате вращения вокруг одинарных связей. Переход различных конформаций молекулы друг в друга происходит без разрыва химических связей. Для изображения конформаций используют проекционные формулы Ньюмена

Плоские конформации молекул пентана C5H12: а — зигзагообразная; б — клешневидная; в — нерегулярная.
Заторможенные конформации - в которых заместители расположены наиболее далеко друг от друга в пространстве, обладают относительно меньшей внутренней энергией. 180 град-в.
С углом 60 градусов между двумя СН3-группами - скошенные, или гош-конформациями.
Заслоненные Конформации - если заместители находятся в наиболее близком положении друг к другу.
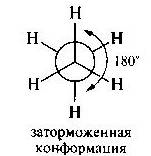
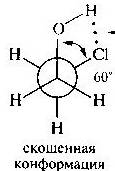

(скажи:строить круг и 6 осей в каждой 1 картинка-везде Н, 2карт.-О и Сl 3карт.-CH3(2штуки))
Конформации циклических соединений:У циклогексана возникают менее напряженные неплоские конформации за счет частичного поворота вокруг сигма-связей, среди которых более устойчивыми являются конформации кресла и ванны. Конформации кресла обозначаются буквой С, а конформации ванны — В. Углы в них равны 109,5 градусов. перпендикулярно к кольцу (аксиальные связи - а), или направлены по его периферии (экваториальные связи - е).
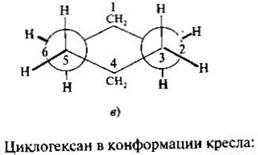

(скажи: 1рисунок -2 кружочка,6 осей на каждом,соеденены CH2, 2рисунок – 2 кружочка,на каждом 6 осей,расположены,почти, др. на др.)
Вопрос 2. Полярность и поляризация связей. Электронные эффекты (индуктивный и мезомерный). Электродонорные и электроноакцепторные заместители, их влияние на распределение электронной плотности; привести примеры.
1. Полярность связи обусловлена неравномерным распределением электронной плотности–поляризацией. Полярность молекулы количественно оценивают величиной ее дипольного момента. Из дипольных моментов молекулы могут быть вычислены дипольные моменты отдельных связей. Чем больше дипольный момент, тем связь полярнее. Причиной полярности связи служит различие в электроотрицательности связанных атомов.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего эл. поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер. По поляризуемости пи-связь значительно превосходит сигма-связь, так как максимум электронной плотности пи-связи располагается дальше от связываемых ядер.
(I-эффект)Индуктивный эффект — это передача электронного влияния заместителей за счет смещения электронов сигма-связей. Индуктивный эффект из-за слабой поляризуемости сигма-связи затухает через три-четыре связи в цепи. Его действие наиболее сильно проявляется по отношению к атому углерода, соседнему с тем, у которого находятся заместители. Направление индуктивного эффекта заместителя принято качественно оценивать путем сравнения с атомом водорода, индуктивный эффект которого принят за нуль. Графически действие I-эффекта изображают стрелкой, направленной острием в сторону более электроотрицательного атома. Заместитель, притягивающий электронную плотность сигма-связи сильнее, чем атом водорода, проявляет отрицательный индуктивный эффект (-I). Такие заместители в целом снижают электронную плотность системы, и их называют электроноакцепторными. К ним относятся большинство функциональных групп (галогены, ОН, NО2, СООН и др.) и катионы. Заместитель, смещающий по сравнению с атомом водорода электронную плотность сигма-связи в сторону атома углерода цепи, проявляет положительный индуктивный эффект (+I). Такие заместители ведут к повышению электронной плотности в цепи и называются электронодонорными. К их числу относятся алкильные (метильные, этильные и т. д.) группы, металлы и анионы.
![]()
Мезомерный эффект — передача электронного влияния заместителей по сопряженной системе. При этом заместитель сам является участником сопряженной системы. Он может вносить в систему сопряжения пи-связь (карбонильная, карбоксильная и другие группы), неподеленную пару электронов гетероатома (галогены, амино- и гидроксигруппы), вакантную или заполненную одним или двумя электронами р-АО. Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М).Эти заместители способны к передаче пары электронов в общую сопряженную систему, т. е. являются электронодонорными. Заместители, понижающие (-М). -М-эффектом обладают ненасыщенные группировки и положительно заряженные атомы, т. е. электроноакцепторные заместители.
Графически смещение электронной плотности обозначается изогнутыми стрелками, показывают, какие п- или пи-электроны смещаются и куда. (+М) передается по системе сопряженных связей на значительно большее расстояние.

(скажешь:1- вправо,начинается с +, 2 – шестиугольник,по верху,минусы, 3-шестиугольник,по низу,минусы)
3.

(скажешь:таблица,Например: О плюс J , плюс М, электронодонорный,от алкильных групп до алкоксигрупп)
Вопрос 3. Понятие о полярности и поляризуемости ковалентной связи. Взаимосвязь полярности связи с поляризуемостью атома (молекулы или иона). Мягкие и жесткие атомы, их способность к поляризации.
1.Поляризуемость, или динамическая поляризация, – это способность электронной оболочки атома или молекулы деформироваться под воздействием внешнего поля, в качестве которого могут выступать ионы или полярные молекулы.
Поляризуемость связи возрастает с уменьшением электроотрицательности атома. От атома с небольшой ЭО легче оторвать электрон и легче деформировать его электронную оболочку. Поляризуемость увеличивается с ростом радиуса атома, так как при этом возрастает число электронных уровней в атоме. Внешняя электронная оболочка становится более подверженной воздействию внешнего поля. Таким образом, существует обратная зависимость между полярностью и поляризуемостью ковалентной связи: чем больше электроны в статической (нереагирующей) молекуле сдвинуты под действием электроотрицательного атома (статическая поляризация), тем меньше остается возможности для их дальнейшего смещения под внешним воздействием (динамическая поляризация). Подобная взаимосвязь четко прослеживается на примере молекул галогеноводородов.
Связь |
Поляризуемость связи, см3/моль |
Н – F |
0,05 |
H – Cl |
0,93 |
H – Br |
0,80 |
H – I |
0,76 |
Полярность связи обусловлена неравномерным распределением (поляризацией) электронной плотности. Полярность молекулы количественно оценивают величиной ее дипольного момента, измеряемого в кулон-метрах или дебаях (1D = 1,4*10^-30 Кл*м). Из дипольных моментов молекулы могут быть вычислены дипольные моменты отдельных связей. Чем больше дипольный момент, тем связь полярнее. Причиной полярности связи служит различие в электроотрицательности связанных атомов.
![]()
2.Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.Электроны тем подвижнее, чем дальше они находятся от ядер.
3.Атомы делятся на жесткие(малополяризуемые) и мягкие(легкополяризуемые).Это зависит от их способности поляризоваться.
Чем больше радиус ядра(R) и больше електронов,тем легче поляризуются атомы(т.е.мягкие).
Чем меньше радиус ядра(R) и меньше електронов,тем хуже поляризуются атомы(т.е.жесткие).
Литий,водород,натрий,калий,кальций,магний-жесткие
Фтор,хлор - жесткие
Франций,цезий,медь,золото,серебро-мягкие
Йод,СN-мягкие
Наиболее эффективно взаиодействуют др. с др:
Жесткий с жестким
Мягкий с мягким.
Вопрос 4. Химическая связь, её образование. Понятие о σ- и π-связях. Длина и энергия связи на примерах алканов, алкенов, алкинов. Гибридизация и её виды. Особенности кратной ковалентной связи: сопряжение, его виды.
1.Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
2.Существуют два типа ковалентной связи: сигма- и пи-связи.
Сигма-Связь - одинарная ковалентная связь, образованная при перекрывании АО по прямой (оси), соединяющей ядра двух связываемых атомов с максимумом перекрывания на этой прямой. сигма-Связь может возникать при перекрывании любых (s-, р-гибридных) АО. У органогенов (углерод, азот, кислород, сера) в образовании сигма-связей могут принимать участие гибридные орбитали, обеспечивающие более эффективное перекрывание.
Кроме осевого возможен еще один вид перекрывания — боковое перекрывание. пи-Связь -связь, образованная при боковом перекрывании негибридизованных р-АО с максимумом перекрывания по обе стороны от прямой, соединяющей ядра атомов.
2.Энергия связи — это энергия, выделяющаяся при образовании связи или необходимая для разъединения двух связанных атомов. Она служит мерой прочности связи: чем больше энергия, тем связь прочнее.
Длина связи — это расстояние между центрами связанных атомов.
Двойная связь короче одинарной, а тройная — короче двойной. Для связей между атомами углерода, находящихся в разном состоянии гибридизации, характерна общая закономерность: с увеличением доли s-орбитали в гибридной орбитали уменьшается длина связи. Например, в ряду соединений пропан СН3-СН2-СН3, пропен СН3-СН=СН2, пропин СН3-С-=СН длина связи СН3—С соответственно равна 0,154, 0,150 и 0,146 нм.
3. Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
sp-Гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов. В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180° Примеры:CHYPERLINK "http://hybridation.ru/acetilen.htm"2HYPERLINK "http://hybridation.ru/acetilen.htm"HHYPERLINK "http://hybridation.ru/acetilen.htm"2HYPERLINK "http://hybridation.ru/acetilen.htm" (ацетилен), C4H6,

(скажешь:три шарика в линию)
sp2-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов.
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу
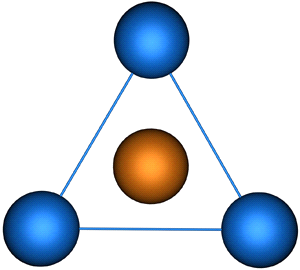
(скажешь:треугольник.внутри круг)
характерна для всех этиленовых углеводородов (алкенов) (общая формула CnH2n), карбоновых кислот и ароматических углеводородов (аренов) и других органических соединений: CHYPERLINK "http://hybridation.ru/etilen.htm"2HYPERLINK "http://hybridation.ru/etilen.htm"HHYPERLINK "http://hybridation.ru/etilen.htm"4HYPERLINK "http://hybridation.ru/etilen.htm" (этилен), C4H8
sp3-Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов.
Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'

Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями
3. Сопряжение (мезомерия, от греч. mesos — средний) — это выравнивание связей и зарядов в реальной молекуле (частице) по сравнению с идеальной, но несуществующей (резонансной) структурой.
кратные связи – сочетанием сигма- и пи-связей; двойная — одной сигма- и одной пи-, тройная — одной сигма- и двух пи-связей.
Пи-пи-сопряжение. Простейшим представителем пи-пи-сопряженных систем с углеродной цепью служит бутадиен- 1,3. Атомы углерода и водорода и все сигма-связи в его молекуле лежат в одной плоскости, образуя плоский сигма-скелет. Атомы углерода находятся в состоянии sp2-гибридизации. Негибридизованные р-АО каждого атома углерода расположены перпендикулярно плоскости сигма-скелета и параллельно друг другу, что является необходимым условием для их перекрывания. Перекрывание происходит не только между р-АО С-1 и С-2, С-З и С-4, а также между р-АО С-2 и С-З. В результате образуется охватывающая четыре атома угле рода единая пи-система, т. е. возникает делокализованная ковалентная связь.
H H (бутадиен-1,3) H2C=CH-CH=CH2 ( бутадиен-1,3) , Скажи: шестиугольник(бензол)
| |
C=C H
| | |
H C=C
| |
H H
Атомы С находятся в Sp2 гибридизации
P,пи сопряжение:
Сопряжение может осуществляться при наличии рядом с Пи связью атома С с негибридной Р-орбиталью
(карбокатионы,свободные радикалы) . В аллил-анионе СН2=СН—СН2 sp2-гибридизованный атом углерода С-З поставляет в общую сопряженную систему два электрона, в аллильном радикале СН2=СН—СН2 — один, а в аллильном карбокатионе СН2=СН—СН2 не поставляет ни одного. . В действительности в таких сопряженных системах имеет место делокализация (рассредоточение) электронной плотности, что приводит к выравниванию связей и зарядов. Атомы углерода С-1 и С-З в этих системах равноценны. Например, в аллил-катионе каждый из них несет положительный заряд + 1/2 и связан полуторной связью с атомом углерода С-2
(Аллил-анион) CH2=CH-CH2 , (анилин) скажи: бензольное кольцо и от него NH2
(Зелёным выделено сопряжение)
