
- •2.1. Теории наркоза
- •2.2. Стадии наркоза
- •III. Хирургическая стадия
- •3.1. Предоперационный осмотр
- •3.1.1. Сбор анамнеза
- •3.1.4. Интерпретация результатов анализов и исследований
- •3.1.5. Оценка жидкостного баланса организма
- •3.2. Оценка операционного риска
- •3.2.1. Оценка состояния сердечно-сосудистой системы
- •3.2.2, Оценка состояния дыхательной системы
- •3.2.3. Оценка функции почек
- •3.2.4. Оценка функции печени
- •3.3. Предоперационная подготовка
- •4. Премедикация
- •4.1. Исторические данные
- •4.2. Клиническая фармакология
- •4.2.2. Бензодиазепины
- •4.2.3. Нейролептики
- •4.2.4. Опиоидные аналгетики
- •4.3. Критерии эффективности профилактической премедикации
- •5.1. Исторические данные
- •5.2. Требования к "идеальному" внутривенному анестетику
- •5.3. Клиническая фармакология лекарственных средств
- •5.3.1. Барбитураты
- •5.3.1.1. Тиопентал-натрий
- •5.3.2. Бензодиазепины
- •5.3.2.1. Диазепам
- •5.3.3.3. Натрия оксибутират
- •5.3.3.4. Кетамин
- •5.3.4. Нейролептики
- •5.3.4.1. Дроперидол
- •5.3.5. Опиоидные аналгетики
- •6.3. Механизм действия и классификация мышечных релаксантов
- •6.6. Декураризация
- •6.6.1. Антихолинэстеразные препараты
- •6.6.2. Мониторинг нервно-мышечной блокады
- •7.1. Требования к "идеальному" ингаляционному анестетику
- •7.6. Ингаляционные анестетики-жидкости
- •7.6.1. Галотан (фторотан)
- •7.7. Ингаляционные анестетики-газы
- •7.7.1. Закись азота
- •8.1. Вводный наркоз
- •8.1.1. Профилактика гемодинамических реакций перед интубацией трахеи
- •8.3. Интубация трахеи
- •8.3.2. Методика интубации трахеи под общей анестезией
- •8.3.4. Трудная интубация
- •8.3.4.3. Альтернативные методы интубации трахеи
- •8.3.5. Профилактика и лечение осложнений интубации трахеи
- •8.3.5.1. Осложнения во время интубации 8.3.5.1.1. Повреждение зубов
- •8.3.5.1.2. Регургитация и аспирация желудочного содержимого
- •8.3.5.1.3. Кровотечение из задней стенки глотки
- •8.3.5.1.4. Перегиб интубационной трубки
- •8.3.5.1.5. Введение интубационной трубки в пищевод
- •8.3.5.1.6. Чрезмерно глубокое введение интубационной трубки в трахею
- •8.3.5.1.7. Повреждения трахеи и пищевода
- •8.3.5.2. Осложнения интубации
- •8.3.5.3. Осложнения после экстубации трахеи
- •9. Обеспечение общей анестезии во время операции
- •9.1. Положение на операционном столе
- •9.2. Периоперационный мониторинг
- •9.2.1. Мониторинг оксигенации
- •9.2.2. Мониторинг вентиляции легких
- •9.2.3. Мониторинг кровообращения
- •9.2.4. Температурный мониторинг
- •9.2.5. Мониторинг диуреза
- •9.2.6. Мониторинг состояния нервной системы
- •9.3. Инфузионно-трансфузионная терапия во время операции
- •9.3.1. Оценка адекватности периоперационной инфузионной терапии
- •9.3.2. Оценка объема кровопотери
- •9.3.3. Гемотрансфузии
- •9.3.4. Методы ограничения интраоперационной кровопотери [22]
- •9.4. Осложнения во время операции
- •9.4.1. Остановка сердца и интраоперационная смерть
- •9.4.2. Нарушения вентиляции
- •9.4.3. Нарушения оксигенации
- •9.4.4. Нарушения гемодинамики 9.4.4.1. Артериальная гипотензия
- •9.4.4.2. Артериальная гипергензия
- •9.4.5. Анафилактические реакции
- •1. Обеспечение общей анестезии во время операции
- •9.4.6. Нарушения терморегуляции
- •9.4.6.1. Злокачественная гипертермия
- •9.4.6.2. Гипертермия
- •9.4.6.3. Гипотермия
- •9.4.7. Восстановление сознания во время общей анестезии
- •10.1. Перевод пациента в палату, экстубация
- •10.2. Осложнения раннего послеоперационного периода
- •11.4. Лечение послеоперационной боли
- •11.4.1. Лекарственные средства
- •17.4.1.1. Опиоидные аналгетики
- •11.4.1.2. Нестероидные противовоспалительные средства
- •12.1. Химическая структура местных анестетиков
- •12.2. Механизм действия местных анестетиков
- •12.3. Метаболизм местных анестетиков
- •12.6. Комбинирование местных анестетиков
- •12.7. Адъювантные препараты
- •12.8. Токсическое действие местных анестетиков
- •12.8.1. Аллергические реакции
- •12.8.2. Системное токсическое действие
- •12.8.3. Токсическое действие на цнс
- •12.8.4. Токсическое действие на сердечно-сосудистую систему
- •13.1. Определение уровня сегментарного блока для проведения оперативного вмешательства
- •13.2. Спинальная анестезия
- •13. Регионарная анестезия
- •13.2.1. Прикладная анатомия
- •13.2.2. Эффекты спинальной анестезии
- •13.2.3. Методика проведения спинальной анестезии 13.2.3.1. Спинальные иглы
- •13.2.3.2. Положение пациента
- •13.2.3.3. Доступы к пункции субарахноидального пространства
- •13.2.3.4. Постановка иглы
- •13.2.3.5. Введение раствора местного анестетика в субарахноидальное пространство
- •13.2.3.6. Факторы, влияющие на уровень спинальной блокады
- •13.2.3.7. Факторы, влияющие на длительность спинальнои анестезии
- •13.2.4. Осложнения спинальнои анестезии
- •13.2.4.1. Осложнения во время проведения спинальнои анестезии
- •13.2.4.2. Послеоперационные осложнения спинальной анестезии
- •13.3. Эпидуралышя анестезия
- •14. Лекарственная интеракция и полипрагмазия в анестезиологии
- •14. Лекарственная интеракция и полипрагмазия в анестезиологии
11.4.1.2. Нестероидные противовоспалительные средства
В течение длительного времени эта группа препаратов находи лась вне поля зрения анестезиологов, за исключением аналгина (метамизола). Фар макологическое лечение болей малой и средней интенсивности начинают с НПВС при отсутствии противопоказаний к ним (табл. 11.5) НПВС уменьшают уровень продуцируемых воспалительных медиаторов в месте операционной травмы, бло-кируют синтез простагландинов, предотвращая компенсаторный ответ на опера-ционную травму, подавляют агрегацию тромбоцитов (отрицательный эффект -увеличивают потенциальный риск кровотечений). При использовании НПВС не развиваются гемодинамические эффекты и депрессия дыхания, не нарушаете, опорожнение желудка и время пассажа пищи по тонкому кишечнику. Профилак-тическое использование НПВС в значительной степени устраняет эффекты свя-занные с активацией NMDA-рецепторов.
В литературе много работ, в том числе за последние годы [30 311 посвяшен ных послеоперационному обезболиванию специфическими ингибиторами ЦОГ-2 (циклооксигеназы 2 типа) - целекоксибом, парекоксибом, валдекоксибом это-рикоксибом и др. Парентеральные формы селективных и специфических ин гибиторов ЦОГ-2 (парекоксиб натрия, мелоксикам) расширяют возможности послеоперационного обезболивания.
Таблица 11.5. Аналгетическая эффективность обезболивающих средств (данные Оксфордской лиги, сокращенно) [48]
Аналгетик |
Количество пациентов |
Не менее 50 % обезболивания, % |
NNT |
Доверительные интервалы NNT |
Валдекоксиб-40 |
473 |
73 |
1,6 |
1,4-1,8 |
Валдекоксиб-20 |
204 |
68 |
1,7 |
1,4-2,0 |
Диклофенак-100 |
411 |
67 |
1,9 |
1,6-2,2 |
Парацетамол 1000 + кодеин 60 |
197 |
57 |
2,2 |
1,7-2,9 |
Парекоксиб-40 (в/в) |
349 |
- 63 |
2,2 |
1,8-2,7 |
Диклофенак-50 |
738 |
63 |
2,3 |
2,0-2,7 |
Ибупрофен-600 |
203 |
79 |
2,4 |
2,0-4,2 |
Ибупрофен-400 |
4703 |
56 |
2,4 |
2,3-2,6 |
Кеторолак-10 |
790 |
50 |
2,6 |
2,3-3,1 |
Ибупрофен-200 |
1414 |
54 |
2,7 |
2,5-3,1 |
Диклофенак-25 |
204 |
54 |
2,8 |
2,1-4,3 |
Морфин-10 (в/м) |
946 |
50 |
2,9 |
2,6-3,6 |
Кеторолак-30 (в/м) |
359 |
53 |
3,4 |
2,5-4,9 |
Парацетамол-500 |
561 |
61 |
3,5 |
2,2-13,3 |
Парацетамол-1000 |
2759 |
46 |
3,8 |
3,4-4,4 |
Аналгетик |
Количество ПНЦИСЛТОВ |
Но мопсе GO % обезболинапия, % |
NNT |
Доворитольныо интервалы NNT |
Парад етамол-600/650 + кодеин 60 |
1123 |
42 |
4,2 |
3,4-5,3 |
Аспирин-600/650 |
5061 |
38 |
4,4 |
4,0-4,9 |
Парад етямол-600/650 |
1886 |
38 |
4,4 |
4,0-4,9 |
Трамадол-100 |
882 |
30 |
4,8 |
3,8-6,1 |
Трамадол-75 |
563 |
, 32 |
5,3 |
3,9-8,2 |
Аспирин-650 + кодеин-60 |
598 |
25 |
5,3 |
4,1-7,4 |
Парацетамол 300 + кодеин 30 |
379 |
26 |
5,3 |
4,0-9,8 |
Трамадол-50 |
770 |
19 |
8,3 |
6,0-13,0 |
Кодеин-60 |
1305 |
15 |
11,0 |
11,0-48,0 |
Особое место среди НПВС занимает парацетамол (ацетаминофен). Многие авторы не относят его к группе НПВС из-за отсутствия периферического противовоспалительного эффекта. Новый всплеск интереса к этому препарату был обусловлен двумя обстоятельствами: во-первых, появлением его парентеральной формы — пропацетамола, во-вторых, объяснением механизма действия за счет блокады циклооксигеназы-3. Специалисты клиники анестезиологии и интенсивной терапии Днепропетровской государственной медицинской академии были среди первых, кто обратил внимание на широкие терапевтические возможности парацетамола и комбинированных препаратов на его основе при послеоперационной аналгезии [13]. По мнению Breivik H. [22], парацетамол является удачным дополнением практически к любому методу послеоперационного обезболивания, в том числе в комбинации с другими НПВС при КПА.
Среди традиционных негативных эффектов НПВС следует отметить нарушение функции ЖКТ, повышенную кровоточивость, а также нарушения функций почек, особенно у больных с высоким риском или сниженным ОЦК.
Доказательные принципы при применении НПВС для лечения острой боли (уровень)
Парацетамол — эффективный аналгетик при острой боли (I).
НПВС и ингибиторы ЦОГ-2 равно эффективны при острой боли (I).
Применение НПВС и парацетамола в комбинациях с другими препаратами повышает эффективность обезболивания (I).
Тщательный отбор пациентов и регулярный мониторинг при применении НПВС делает вероятность развития побочных эффектов со стороны почек низкой (!)•
Аспирин и некоторые НПВС повышают риск повторной операции вслед ствие кровотечения после тонзилэктомии (I).
231
Ингибиторы ЦОГ-2 и НПВС имеют сходный профиль побочных эффектов в отношении функции почек (I).
Ингибиторы ЦОГ-2 не вызывают бронхоспазма у пациентов с известной аспиринзависимой астмой (I).
Парацетамол, НПВС и ингибиторы ЦОГ-2 — важный компонент сбаланси рованной аналгезии (II).
Ингибиторы ЦОГ-2 не нарушают функцию тромбоцитов (II).
Риск развития гастроинтестинальных язв при кратковременном использова нии ингибиторов ЦОГ-2 не отличается от плацебо (II).
Побочные эффекты НПВС являются клинически важными и ограничивают их использование (V).
Риск побочных эффектов НПВС и ингибиторов ЦОГ-2 повышается при диагностированных ранее почечных нарушениях, гипокалиемии, гипотензии, ис пользовании нефротоксических препаратов и ингибиторов АПФ (V).
Отмечены серьезные сердечно-сосудистые осложнения при использовании ингибиторов ЦОГ-2 в некоторых исследованиях. В настоящее время невозможно дать четкие рекомендации по их применению; необходимы дополнительные ис следования (V).П.4.2.3. Контролируемая пациентом аналгезия
Метод контролируемой пациентом аналгезии (КПА, patient-controlled analgesia) имеет существенные преимущества по сравнению с традиционными подходами: позволяет обеспечить адекватное обезболивание, поддерживать стабильную концентрацию аналгетика в плазме крови, экономить время ме-дицинского персонала, снижать частоту развития побочных эффектов. Метод КПА в настоящее время широко применяют во многих странах мира и рассматривают в качестве альтернативы традиционному назначению аналгетиков "при болях" или их плановому введению. По мнению некоторых авторов, КПА становится стандартом для послеоперационного обезболивания. За прошедшие 30 лет многочис-ленными исследованиями продемонстрированы безопасность и эффективность метода КПА. При использовании метода КПА, больной получает препараты "по требованию", что позволяет наиболее гибко варьировать дозировкой препаратов в зависимости от реальных индивидуальных потребностей больного.
Большое значение в эффективности метода играет психологический фактор, поскольку пациент уверен, что в любой момент самостоятельно может справиться с болью. Неотъемлемым требованием для проведения данной методики является ясное сознание больного. Также необходимо психологическое тестирование при решении вопроса о способности пациента эффективно пользоваться КПА.
Для метода КПА используют специальные устройства — перфузоры с модулем для КПА. При выполнении процедуры назначают нагрузочную дозу, болюс препарата, локаут-интервал (lockout) — минимальное время между последовательными дозами, лимит — максимальное количество аналгетика за определенное время независимо от требований больного, скорость введения болюса. Наиболее часто используют внутривенное, эпидуральное и подкожное введение аналгетика. Наиболее часто в послеоперационный период для проведения КПА применяют внутривенное введение опиоидных аналгетиков. Обезболивания достигают [11], когда в крови создают определенную и для каждого больного индивидуальную концентрацию опиоида (максимальная концентрация, ассоциирующаяся с сильной болью — МКСБ) (рис. 11.4). Полная ликвидация болевых ощущений происходит при так называемой минимальной эффективной аналгезирующей концентрации (МЭАК). При увеличении содержания опиоидов в крови выше МЭАК обезболивающий эффект не усиливается. Небольшое снижение уровня препарата в
МЭАК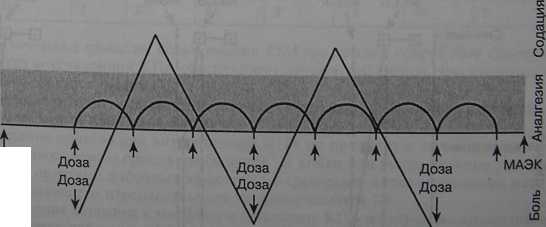
1 400
400
16м
Время Рис. 11.4. Парадигма КПА [11)
2200
017
крови ниже МЭАК приводит к быстрому появлению сильных болей. Величины МЭАК значительно варьируют у отдельных пациентов, что объясняет столь большие колебания потребностей во введении опиоидов у разных больных. Минимальное повышение уровня опиоида в крови над максимальной его концентрацией, соответствующей сильной боли (МКСБ), приводит к быстрому снижению болевых ощущений.
Участок между МКСБ и МЭАК (заштрихован, см. рис. 11.4) называют терапевтическим окном. Наклон кривой между МКСБ и МЭАК достаточно крутой. Всего лишь 0,05 мкг/мл меперидина может определить развитие либо сильной боли, либо аналгезии. Таким образом, опиоиды имеют узкое терапевтическое окно. Терапевтическую эффективность каждого метода обезболивания опиоидами определяют соотношением создающейся в крови концентрации препарата, степенью аналгезии и интервалами между отдельными инъекциями (рис. 11.5). Предсказать, какова будет концентрация опиоида в крови после внутримышечного введения, достаточно трудно. Пик концентрации препарата (С>га>) при повторных внутримышечных инъекциях может индивидуально разниться у больных (даже в 2 раза). Время наступления пика концентрации (Туах) может разниться в 3 раза. У некоторых больных отмечают 5-кратные колебания Сч]ах и 7-кратные Т Колебания уровня опиоидов в крови происходят и в промежутках между повторными инъекциями. Подсчитано, что только на протяжении 35 % интервала 4-часового промежутка времени между повторными инъекциями опиоида его уровень в крови превышает МЭАК. При повторных введениях препаратов "по требованию" эти колебания сглаживаются, поскольку пациент сразу ощущает падение уровня препарата ниже МЭАК.
Объем распределения, константы скоростей распределения и выведения меперидина, кетобемидона и морфина исследованы у больных, подвергшихся лапа-ротомии. Работы Tamsen показывают, что предоперационное содержание эндо-
Пациент
В МКСБ
МЭАК
Пациент
Б МКСБ
МЭАК \![]()
 ациент
А
МКСБ
МЭАК
Сильные-|
^ ^
/
ациент
А
МКСБ
МЭАК
Сильные-|
^ ^
/
Выраженные -I
Отсутствуют J
0,5
0,8
0,2
Меперидин, мкг/мл Рис. 11.5. Соотношение между концентрацией опиоида в плазме и качеством анмгезии I
238
генных опиоидов в головном и спинном мозге существенно влияют на величину МЭАК и степень потребности в аналгезии. Результаты исследований свидетельствуют о выраженном взаимодействии эндогенных и экзогенных опиоидов и об их совместном влиянии на потребность в аналгезии и величину МЭАК. Исследования указывают на зависимость потребности в аналгезии у отдельных больных от содержания эндогенных опиоидов в ЦСЖ.
Доказательные принципы использования КПА при лечении острой боли (уровень)
Метод внутривенной КПА обеспечивает лучшую аналгезию, чем традицион ные режимы обезболивания (I).
Больные отдают предпочтение методу внутривенной КПА по сравнению с другими техниками обезболивания (I).
Введение опиатов при внутривенной КПА не приводит к снижению их по требления, сокращению сроков пребывания на койке или более низкому уровню связанных с опиатами побочных эффектов по сравнению с трааиционными мето дами перемежающего парентерального введения опиатов (I).
Добавление кетамина к морфину в программе КПА не улучшает аналгезию и не снижает риск побочных эффектов опиатов (I).
Эпидуральная КПА в родах приводит к использованию более низких кон центраций доз местных анестетиков, меньшему моторному блоку и меньшему количеству анестетика по сравнению с продленной эпидуральной инфузией (I).
• Существует мало доказательств относительно преимуществ одного опиата над другим при КПА в отношении эффективности и безопасности обезболивания
в целом. Отдельный больной по-разному воспринимает эффект различных опиатов (ІІ)
• Не существует доказательств пользы добавления налоксона к КПА морфи ном, но частота возникновения тошноты и зуда уменьшается (II).
Добавление базовой инфузии при внутривенной КПА не повышает качества обезболивания и сна, а также не снижает потребности в КПА (II).
Метод подкожного введения при КПА так же эффективен, как и при внут ривенном способе введения (II).
Интраназальная КПА так же эффективна, как и внутривенная (II).
Эпидуральная КПА приводит к меньшей суммарной дозе препаратов по сравнению с длительной эпидуральной инфузией без различий в аналгезии и ко личестве побочных эффектов (II).
Риск респираторной депрессии при КПА повышается при использовании базовой инфузии (IV).
Необходимо добиться адекватной аналгезии до начала КПА. При расчете начального болюса необходимо принять во внимание индивидуальные показатели больного: предыдущее использование опиатов и возраст. Возможно, потребуются индивидуальные расчеты режимов КПА (V).
Рутинное использование протиьорвотных не показано, так как не имеет преимуществ над их селективным применением (V).
Системы для КПА должны включать антисифонные и антирефлюксные кла паны (V).
Концентрация препарата должна быть стандартизирована лечебным учреж дением для снижения вероятности программных ошибок (V).
Местные анестетики (МА) — это лекарственные средства, которые в определенных концентрациях, контактируя с нервным стволом, вызывают обратимый моторный и сенсорный паралич в иннервируемых областях.
Факторы, влияющие на выбор местного анестетика: длительность оперативного вмешательства, метод анестезии, хирургические требования, особенности метаболизма препарата, степень местной и системной токсичности препарата и др.
