
- •Методическая разработка
- •Методическая разработка
- •2. Материальное оснащение
- •3. Контрольные вопросы из смежных дисциплин.
- •4. Контрольные вопросы по теме занятия.
- •Методическая разработка
- •2. Материальное оснащение
- •3. Контрольные вопросы из смежных дисциплин.
- •4. Контрольные вопросы по теме занятия.
Министерство здравоохранения республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра___________биохимии______________________________________
Обсуждено на заседании кафедры _____биохимии_______________
Протокол № __________
Методическая разработка
для проведения занятия преподавателем со студентами
__2-го________ курса ____лечебного _________________факультета по
________________биохимии__________________________________
(наименование дисциплины)
Тема:______Витамины_____________________________________
Время____3 часа_________________
УЧЕБНАЯ И ВОСПИТАТЕЛЬНАЯ ЦЕЛИ:
Закрепить представления о структуре, метаболизме и молекулярных механизмах действия водо и жирорастворимых витаминов, при регуляции метаболизма в норме.
ТРЕБОВАНИЯ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ
1.1. Химическое строение и свойства витаминов.
1.2. Роль витаминов в катализе в качестве коферментов (пируват-Д
комплекс, полиферментная система синтеза жирных кислот,
дегидрогеназы ЦТК, ДЦ и др. - NADH+H+, FADH2, КоQ).
1.3. Роль витаминов в качестве соединений контролирующих активность
ферментов и их продукцию (гормоны).
1.4.. Роль витамина C в окислении фен, три, про, лиз и т. д.
2. МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ
Методические разработки для студентов, таблицы, схема по строению, классификации витаминов, регуляции и интеграции метаболизма в норме и при патологии. Растворы, витаминов, и реактивы, неоходимые для проведения качественных реакций, посуда.
3. КОНТРОЛЬНЫЕ ВОПРОСЫ ИЗ СМЕЖНЫХ ДИСЦИПЛИН.
3.1. Химическое строение водо и жирорастворимых витаминов ( биоорганич.
химия)
3.2.Титрометрический метод определения определения концентрации
веществ ( общая химия)
3.3. Витамины ( Обмен веществ и энергии, физиология человека)
4. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ.
4.1.Общая характеристика и классификация витаминов. История учения о витаминах (работы Лунина Л.И., Сосина К.А., Эйкмана Х., К. Функа, Ф.Г, Гопкинса). Групповая характеристика витаминов.
4.2 .Гипоавитаминозы и авитаминозы, их причины (алиментарные, повышенная потребность,
парентеральное питание, заболевание ЖКТ, глистные инвазии, применение лекарственных препаратов и
антивитаминов, врожденные нарушения обмена витаминов).
4.1.Каждый витамин рассматривается по схеме:
4.2. Химическая природа и основные свойства (устойчивость к действию света, pH среды, высокой
температуре и др.).
4.3..Превращения в организме и механизмы активации.
4.4.. Механизм действия (участие в обмене веществ, физиологические эффекты).
4.5.. Картина гипо-, авитаминоза и гипервитаминоза и их клинико-лабораторная диагностика.
4.6 .Источники витаминов и содержание в продуктах питания.
4.7. Показания к применению, профилактические и лечебные дозы.
Водорастворимые витамины.
Знание химического строения обязательно для витаминов: B1 (тиамин), B2
(рибофлавин), PP
(никотинамид, ниацин), B6 (пиридоксин), C (аскорбиновая кислота), H (биотин).
Знание химического строения необязательно: пантотеновая кислота, пангамовая
кислота, фолиевая
кислота, витамин B12 (кобаламин), витамин U.
Жирорастворимые витамины.
Знание химического строения обязательно для витаминов: А (антиинфекционный,
витамин роста,(антирахитический) их провитамины и метаболиты, E
(антистерильный), K (антигеморрагический).
5. РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ.
№ п/п |
Содержание |
Расчет рабочего времени |
1. |
Введение |
5 мин |
2. |
Теоретическая часть занятия |
45 мин |
3. |
Практическая часть занятия |
|
|
Работа (задание) 1, 2, и т.д. |
45 мин
|
4. |
Контроль усвоения темы |
30 мин |
5. |
Заключительная часть занятия. Подведение итогов, проверка протоколов, дневников курации больных и т.д. |
10 мин |
|
|
|
6. ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
В теоретической части занятия проводится устный опрос студентов и разбор теоретического материала. Необходимо остановится на групповой характеристике витаминов- так дать краткую физиологическую характеристику группам: повышающим общую реактивность организма; антигеморрагическим, антианемическим, антиинфекционным, и группе , регулирующей зрение.
В процессе опроса студентов необходимо дать четкое определение гиповитаминоза, как умеренного и наиболее чаще встречаемого проявления витаминной недостаточности, а также перечислить все причины его вызывающие.
При разборе теоретического материала следует обратить внимание на степень усвоения лекционного материала, а теоретические вопросы подкреплять примерами из ситуационных задач, и разделов биохимии( энзимологии, биоэнергетика, метаболизм белков , углеводов и жиров).
В разделе « Лабораторная часть» необходимо остановиться на принципах и клинико- лабораторном значении выполняемых работ. Работа завершается сравнением полученных у студентов результатов и оформлением лабораторных протоколов.
Контроль усвоения темы проводится путем фронтального устного или письменного опроса студентов, а также решением ситуационных задач.
Излагается порядок действий в ходе занятия преподавателя, студентов, лаборантов, метод контроля готовности студентов к занятию и проверки прочности знаний, обеспечения техники безопасности и т.д.
Если тема рассчитана на несколько занятий, то приводятся методические особенности проведения каждого занятия.
7. ХОД ЗАНЯТИЯ
Лабораторная работа № 1. Качественные реакции на витамин B1.
Витамин B1 состоит из пиримидинового и тиазольного колец. Он получил название тиамина, поскольку содержит серу и азот:

Тиаминпирофосфат (в некоторых тканях тиаминтрифосфат) - (соответственно ТПФ или ТТФ) является коферментной формой тиамина и синтезируется в печени путем прямого переноса фосфата от АТФ.

ТПФ в составе ферментов углеводного обмена участвует в окислительном декарбоксилировании - -кетокислот и в транскетолазной реакции. Его недостаток вызывает поражение периферической нервной системы, сердечно-сосудистой системы и желудочно-кишечного тракта. При этом в крови накапливаются пировиноградная кислота и другие -кетокислоты.
Реакция окисления.
ПРИНЦИП МЕТОДА: в щелочной среде тиамин окисляется феррицианидом калия в тиохром, обладающий при ультрафиолетовом облучении синей флюоресценцией. Реакция протекает по следующей схеме:
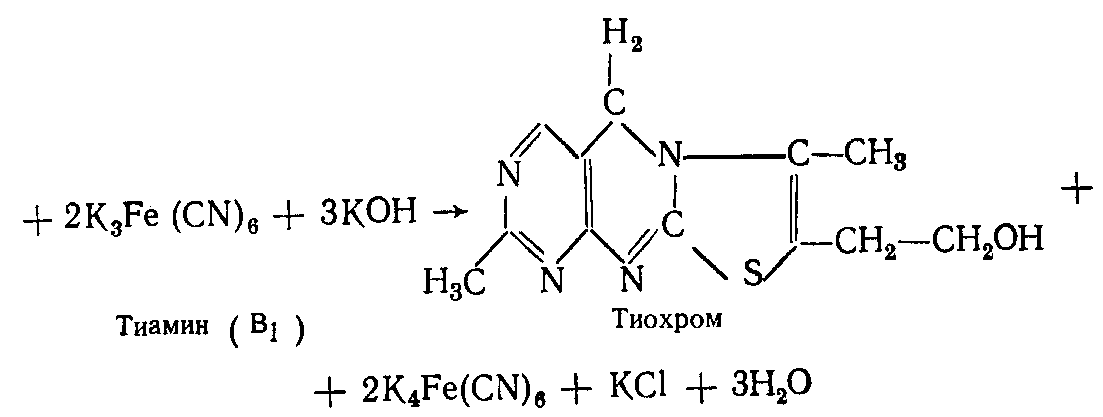
ХОД РАБОТЫ. К 1 капле 5% раствора тиамина прибавляют 5-10 капель 10% раствора едкого натра, 1-2 капли 5% раствора феррицианида калия и взбалтывают. Прогрев флюороскоп в течение 10 минут, наблюдают синюю флюоресценцию при облучении раствора ультрафиолетовыми лучами.
Диазореакция.
ПРИНЦИП МЕТОДА: в щелочной среде тиамин с диазореактивом образует сложное комплексное соединение оранжевого цвета.
ХОД РАБОТЫ. К диазореактиву, состоящему из 5 капель 1% раствора сульфаниловой кислоты и 5 капель 5% раствора нитрата натрия добавляют 1-2 капли 5% раствора тиамина и затем по стенке, наклонив пробирку, осторожно добавляют 5-7 капель 10% раствора бикарбоната натрия. На границе двух жидкостей появляется кольцо оранжевого цвета.
ВЫВОД:
Лабораторная работа N 2. Качественная реакция на витамин B2.
Рибофлавин состоит из изоаллоксазинового ядра и спирта рибитола:
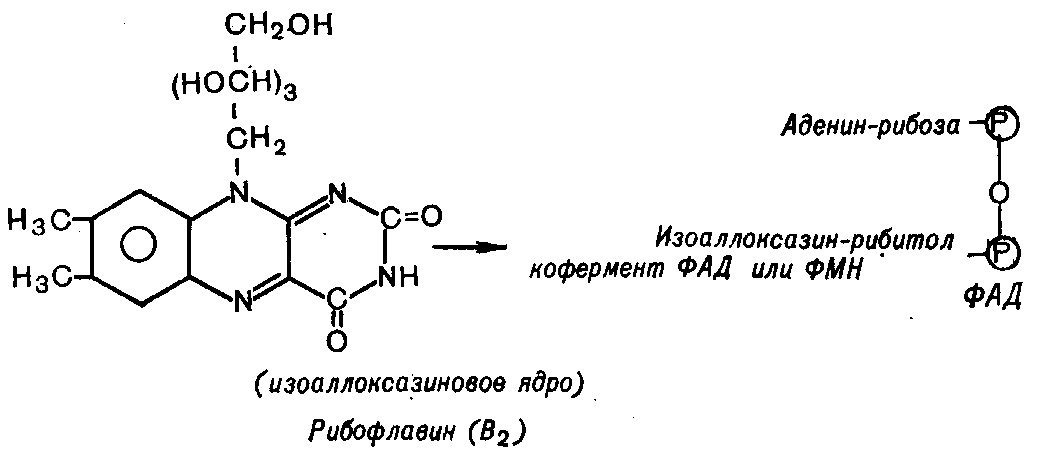
Рибофлавин входит в состав простетической группы флавиновых ферментов (флавопротеидов - FP) в виде коферментов флавинадениндинуклеотида (FAD) и флавинаденинмонодинуклеоитда (FMN). Флавопротеиды катализируют окислительно-восстановительные реакции. Они участвуют в окислении D-аминокислот, -окислении жирных кислот, в работе дыхательных цепей митохондрий и микросом и др. Биологическое действие флавиновых ферментов связано с наличием окислительно-восстановительных свойств изоаллоксазинового кольца.
При недостатке в организме В2 возникают поражения слизистых в виде хейлита, глоссита и др.
ПРИНЦИП МЕТОДА: окисленная форма витамина В2 представляет собой желтое флюоресцирующее в ультрафиолетовых лучах вещество. Реакция на витамин В2 основана на способности его легко восстанавливаться, при этом раствор витамина В2, обладающий желтой окраской, приобретает сначала розовый цвет за счет образования промежуточных соединений, а затем обесцвечивается так как восстановленная форма витамина В2 бесцветна.
ХОД РАБОТЫ. В пробирку наливают 10 кап. раствора витамина В2, добавляют 5 кап. конц. HCl опускают зернышко металлического цинка. Начинается выделение пузырьков водорода, восстанавливающего рибофлавин, жидкость, при этом, постепенно розовеет и обесцвечивается. Сравнивают обе формы витамина В2 по флюоресценции, поместив каждую пробирку под освещение флюороскопа.
ВЫВОД:
Лабораторная работа № 3. Качественная реакция на витамин В6.
Группа витамина В6: пиридоксол, пиридоксаль, пиридоксамин, являются производными 3-оксипиридина, носят общее название пиридоксина и обладают активностью витамина В6.
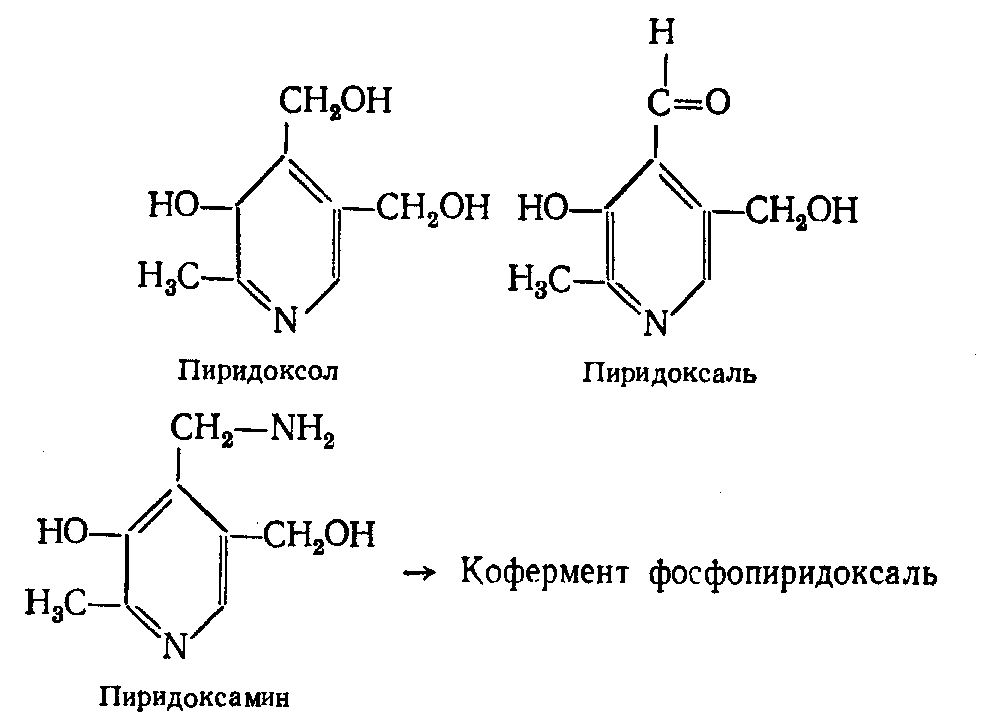
В организме эти соединения подвергаются фосфорилированию при участии АТФ с образованием коферментов фосфопиридоксаля, фосфопиридоксамина, которые входят в состав ферментов, участвующих в белковом обмене, в реакциях трансаминирования, декарбоксилирования аминокислот, десульфинирования, дегидратирования аминокислот, в образовании витамина PP из триптофана и в некоторых других реакциях.
При недостатке витамина В6 у животных прежде всего нарушается обмен белков, у человека недостаточность этого витамина встречается редко.
ПРИНЦИП МЕТОДА: витамин В6 при взаимодействии с раствором хлорного железа образует комплексную соль типа фенолята железа красного цвета.
ХОД РАБОТЫ. К 5 каплям 1% раствора витамина В6 приливают равное количество 1% раствора хлорного железа и перемешивают. Развивается красное окрашивание.
ВЫВОД:
Лабораторная работа № 4. Качественная реакция на витамин E.
Витамин E существует в виде нескольких изомеров: , и -токоферолов, которые отличаются друг от друга порядком расположения метильных групп в бензольном кольце. Токоферолы - маслянистые жидкости, растворимые в растительных маслах и жировых растворителях.
Витамин E является мощным антиоксидантом. Некоторые производные витамина E участвуют в окислительно-восстановительных реакциях, связанных с окислительным фосфорилированием.
Витамин E может депонироваться в мышцах и поджелудочной железе.
ПРИНЦИП МЕТОДА: спиртовой раствор -токоферола окисляется хлоридом железа (Fe3+) в токоферилхинон красного цвета:
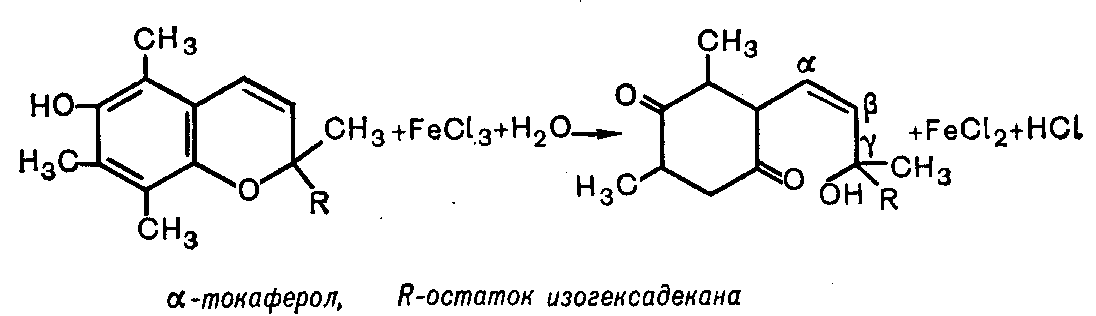
ХОД РАБОТЫ. В сухую пробирку берут 4-5 капель 0,1% спиртового раствора -токоферола, прибавляют 0,5 мл 1% раствора хлорида железа, тщательно перемешивают. Содержимое пробирки приобретает красное окрашивание.
ВЫВОД:
Лабораторная работа № 5. Количественное определение витамина C.
Биологическая роль аскорбиновой кислоты в организме исключительно важна и многообразна. Она участвует в окислительно-восстановительных процессах и связана с системой глутатиона.
Аскорбиновая кислота участвует в синтезе стероидных гормонов в коре надпочечников и катехоламинов в мозговом слое надпочечников и необходима для процесса гидроксилирования как кофактор ферментов гидроксилаз, например дофамингидроксилазы и др. Она участвует в образовании тетрагидрофолиевой кислоты из фолиевой кислоты, процессинге коллагена (гидроксилировании лизина в оксилизин, пролина в оксипролин), ускоряет всасывание железа, а также активирует фермент желудочного сока пепсиноген, что особенно важно при недостатке соляной кислоты в желудочном соке.
ПРИНЦИП МЕТОДА: метод основан на способности витамина C восстанавливать 2,6-дихлорфенолиндофенол (2,6 ДХФИФ - краска Тильманса), который в кислой среде имеет красную окраску, при восстановлении - обесцвечивается, а в щелочной среде окраска синяя. Для предохранения витамина C от разрушения исследуемый раствор титруют в кислой среде щелочным раствором 2,6 ДХФИФ до появления розового окрашивания.
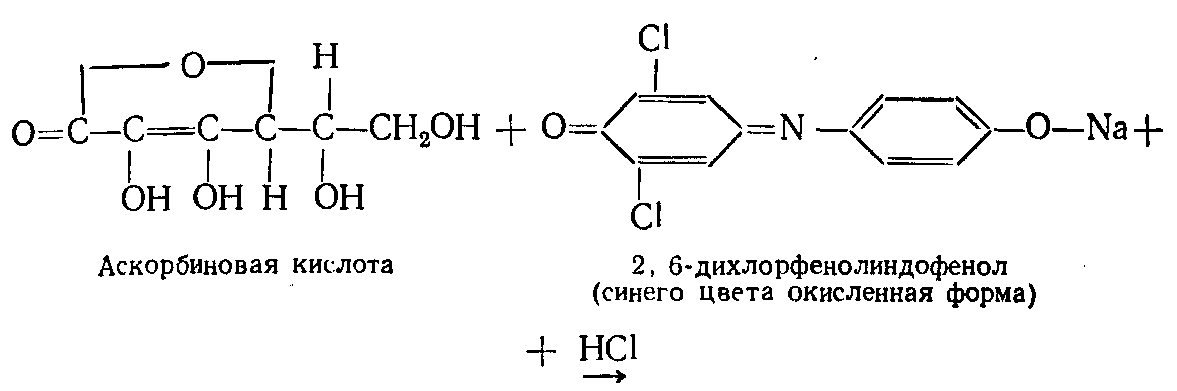
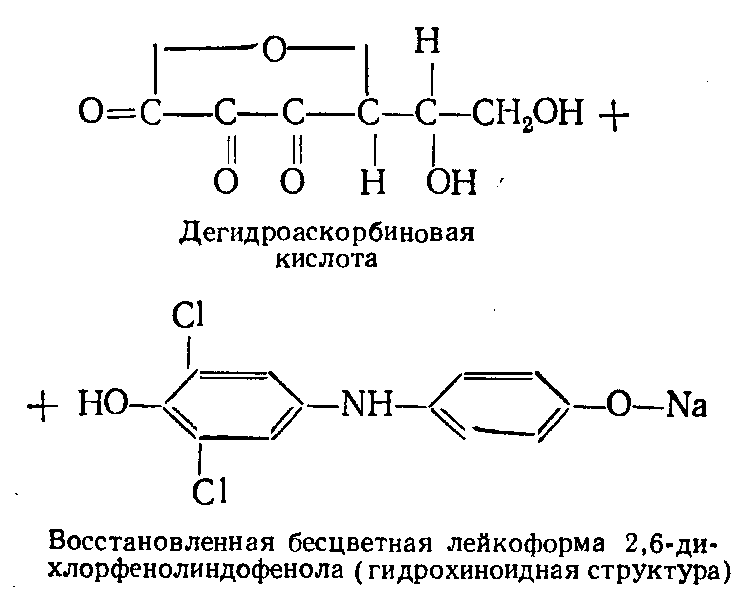
Для расчета содержания аскорбиновой кислоты в продуктах (капуста, картофель, хвоя, шиповник и др.), используют формулу:
0,088АГ100
X =
БВ
где: X - содержание аскорбата в мг на 100 г продукта
0,088 - коэффициент пересчета
А - результат титрования 0,001 н раствором 2,6 ДХФИФ (мл)
Б - объем экстракта, взятый для титрования (мл)
В - количество продукта, взятое для анализа (мг)
Г - общее кол-во экстракта, (мл)
100 - пересчет на 100 г продукта
ХОД РАБОТЫ.
1. Определение содержания витамина C в капусте.
Навеску капусты - 1 г тщательно растирают в ступке с 2 мл 10% раствора соляной кислоты, объем доводят до 10 мл и фильтруют. Отмеривают для титрования 2 мл фильтрата, добавляют 10 капель 10% раствора соляной кислоты и титруют 2,6 ДХФИФ до розовой окраски, сохраняющейся в течение 30 сек.
По формуле, указанной выше, рассчитывают содержание аскорбиновой кислоты в 100 г продукта.
Содержание аскорбата (мг/100 г продукта) :
капуста |
25 - 60 |
хвое |
200 - 400 |
шиповник |
500 -1500 |
2. Определение содержания витамина C в картофеле.
Взвешивают 5 г картофеля, тщательно растирают в ступке с 20 каплями 10% раствора соляной кислоты (для того, чтобы картофель не темнел). Постепенно приливают дистиллированную воду - 15 мл. Полученную массу сливают в стаканчик, ополаскивают ступку водой, сливают ее по стеклянной палочке в стаканчик и титруют 0,001 н раствором 2,6 ДХФИФ до розового окрашивания. В 100 г картофеля содержится 1-5 мг витамина C.
3. Определение содержания витамина C в моче.
Определение содержания витамина C в моче дает представление о запасах этого витамина в организме, так как наблюдается соответствие между концентрацией витамина C в крови и количеством этого витамина, выделяемым с мочой. Однако при гиповитаминозе С содержание аскорбиновой кислоты в моче не всегда понижено. Часто оно бывает нормальным, несмотря на большой недостаток этого витамина в тканях и органах.
У здоровых людей введение per os 100 мг витамина C быстро приводит к повышению его концентрации в крови и моче. При гиповитаминозе C ткани, испытывающие недостаток в витамине, задерживают принятый витамин C и его концентрация в моче не повышается. C мочой у здорового человека экскретируется 20-30 мг/сутки или 113-170 мкМ/сутки витамина C. У детей уровень экскреции этого витамина понижается при многих острых и хронических инфекционных и соматических заболеваниях.
ХОД РАБОТЫ.
В стаканчик или колбочку отмеривают 10 мл мочи и 10 мл дистиллированной воды, перемешивают, подкисляют 20 каплями 10% раствора соляной кислоты и титруют 0,001 н раствором 2,6 ДХФИФ до розового окрашивания.
Расчет содержания аскорбиновой к-ты в моче проводят по формуле:
0,088АВ
X =
Б
где: X - содержание аскорбиновой кислоты, в суточной моче (мг/сут)
0,088 - коэффициент пересчета
А - результат титрования 0,001 н раствором 2,6-ДХФИФ (мл)
Б - объем мочи, взятый для титрования (мл)
В - среднее суточное количество мочи (для мужчин - 1500 мл, для женщин - 1200 мл).
ВЫВОД:
8. ЛИТЕРАТУРА
8.1. Материал лекций.
8.2.2. Березов Т. Т., Коровкин Б.Ф. Биологическая химия, М., Медицина, 1990, стр. 133-169.
8.3.. Николаев А. Я. Биологическая химия, М., Высшая школа, 1989 стр. 167-172.
8.4. Экспериментальная витаминология, под ред. Ю.М. Островского, Минск, Наука и техника, 1979.
8.5. Витамины. под ред. М.И. Смирнова М., Медицина, 1974.
8.6. Бышевский А.Ш., Терсенов О.А. Биохимия для врача, Екатеринбург, 1994, стр. 134-
144
8.7. Методы оценки и контроля витаминной обеспеченности населения под ред
В.Б.Спиричева, М. Наука, 1984
Доц. каф. Свергун В.Т. (Подпись)
Дата
Министерство здравоохранения республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра______биохимии___________________________________________
Обсуждено на заседании кафедры _______биохимии_____________
Протокол № __________
