
- •1.Введение
- •Вторично-ионная масс-спектрометрия
- •2.Обратное резерфордовское рассеяние
- •3.Метод ядерных реакций
- •4.Электронный микрозонд
- •1. Электронный микрозонд
- •2. Спектроскопия с дисперсией по длине волны (wds, Wavelength Dispersive Spectroscopy)
- •6.Рентгенофотоэлектронная спектроскопия
- •7.Дальняя тонкая структура спектра рентгеновского поглощения
- •8.Сканирующая туннельная микроскопия
- •9.Атомно-силовая микроскопия
- •10.Масс-спектрометрия
- •12.Спектроскопия комбинационного рассеяния (кр) Raman Spectroscopy
- •13.Спектроскопия ядерного магнитного резонанса nmr Spectroscopy
- •14.Электронный парамагнитный резонанс (эпр) Electron Spin Resonance, Electron Paramagnetic Resonance
- •1. Решение аналитических задач
- •2. Структурные исследования
- •3. Исследование механизмов реакций
- •15.Сравнительная таблица методов исследования поверхности
10.Масс-спектрометрия
Метод основан на изучении распределения по массам ионов, образующихся при ионизации исследуемого вещества. Процесс получения масс-спектра включает несколько этапов, каждому из которых соответствует свой функциональный узел.
Ввод пробы (на схеме – vapor)
Ионизация (electron beam)
Ускорение ионов (potential difference)
Масс-анализ
Регистрация (photographic plate)
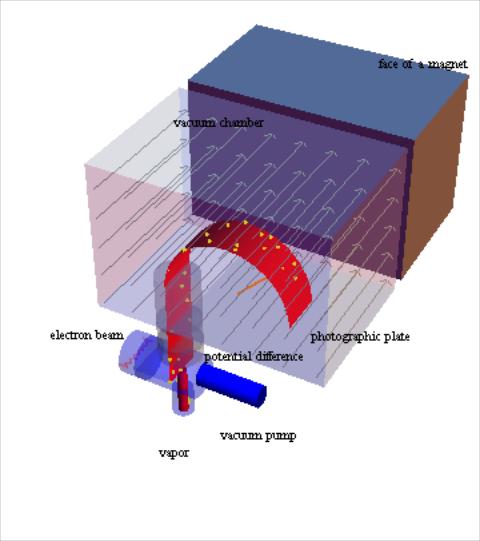
Система напуска обеспечивает испарение вещества и вводит его в масс-спектрометр. Как правило, для измерений достаточно 1-100 мкг вещества, но в принципе, масс-спектрометрический анализ позволяет определять до 10-9 г вещества, что делает масс-спектрометрию одним из наиболее чувствительных методов анализа.
В
случае органических соединений ионизация
осуществляется методом электронного
удара, т.е. пары вещества пересекают
электронный пучок с энергией электронов
порядка 70 эВ, в результате чего образуются
исключительно катионы. Ионизированные
частицы разгоняются между решетками,
к которым приложено напряжение 2-3 кэВ.
При этом они получают дополнительную
энергию в форме кинетической энергии
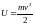 .
.
Далее
частицы попадают в масс-анализатор, где
начинают двигаться по искривленной
траектории под действием внешнего
магнитного поля
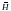 (направление указано стрелками на
схеме). При этом на частицы действуют
две силы (F1
– отклонения и F2
– центробежная):
(направление указано стрелками на
схеме). При этом на частицы действуют
две силы (F1
– отклонения и F2
– центробежная):
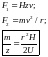
В зависимости от напряжения на детектор приходят частицы с различным отношением массы к заряду. Получаем линейчатый спектр, известный под именем «масс-спектр».
Масс-спектрометры характеризуются по крайней мере двумя параметрами: 1) массовой областью (как правило, она меньше 1000 атомных единиц); 2) точностью (как правило, четыре знака после запятой для массовых чисел меньше 100).
Измерения проводятся в вакууме (10-7 мм рт. ст.). Сложный спектр формируется в результате образования разнообразных заряженных осколков.
Наряду с рассматриваемой схемой масс-спектрометра с отклонением в магнитном поле на практике используются и другие, в частности, квадрупольные масс-спектрометры. Разделение ионов здесь осуществляется в электрическом поле сложной формы. Также используются времяпролетные масс-спектрометры, в случае которых напряжение на сетки подается короткими импульсами, ионы приобретают одинаковую энергию и, пройдя расстояние около 2 м, приходят к детектору в разные моменты времени. Оба эти масс-спектрометра имеют меньшее разрешение, но удобны для некоторых практических измерений.
Принципы формирования масс-спектра
Результатом электронного удара является формирование молекулярных ионов. Возможен отрыв одного электрона, отрыв нескольких электронов и захват электрона с образованием аниона. Вероятность каждого из этих процессов определяется энергией электронов. Последний процесс возможен только для низкоэнергетических электронов (около 0,1 В). Отрыв нескольких электронов возможен только в случае использования высокоэнергетических электронов. При использовании электронов с энергией 70 эВ единственным процессом в системе будет являться генерация однозарядных катионов. Если энергия электронов сопоставима или превышает энергию разрыва связи (7-15 эВ), то мы будем наблюдать следующую зависимость выхода молекулярных ионов от энергии электронов.

В итоге получаем ион с заведомо избыточной энергией, которая преобразуется в колебательную, результатом чего является фрагментация молекулярных ионов с выделением незаряженных фрагментов и стабильных молекул. Характер фрагментации индивидуален для каждой молекулы и определяется особенностями её строения. При этом наличие ароматических групп и двойных связей стабилизирует молекулярный ион, а наличие разветвления приводит к увеличению эффективности фрагментации в силу высокой стабильности образующегося третичного карбониевого иона. В целом, можно лишь на основании имеющегося опыта установить ряд относительной стабильности молекулярных ионов для различных органических соединений.
ароматические > неразветвленные УВ > кетоны > амины > эфиры
Некоторые фрагменты не являются собственно частями молекулы, а являются продуктом перегруппировки, протекающей как внутримолекулярная реакция. Примером является перегруппировка МакЛафферти.
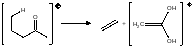
В целом, тенденция к выделению молекул, способных унести с собой избыточную энергию, является чрезвычайно ярко выраженной. Такие группы, как С2Н4, СО, Н2О, HCN, CS2, НГал отщепляются довольно часто. Порой такое отщепление провоцирует скелетные перегруппировки.
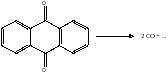
Таким образом, если речь идёт о фрагментации, её не надо понимать как массовый разрыв химических связей и их рекомбинация с образованием новых соединений. Во всех случаях это вполне определенные реакции, аналогичные химическим. Механизм этих реакций был установлен для целого ряда химических соединений в рамках специфического раздела химии высоких энергий, в данном случае, процессов, индуцированных электронным ударом.
В большинстве случаев просто рассматривают масс-спектр как индивидуальный отпечаток пальца, поскольку эти масс-спектры индивидуальны даже для изомеров и совпадают только в случае стереоизомеров.
Таким образом, структура масс-спектра определяется прежде всего ходом процессов фрагментации. Ещё одним фактором, ответственным за формирование тонкой структуры масс-спектра является изотопный состав исследуемого вещества. Так, если принять во внимание, что, например, бром представлен двумя изотопами: бром-79 (сод. 50,54%) и бром-81 (сод. 49,46%), то реально некий фрагмент RBr+ распадется на дублет. Ежели фрагмент дважды бромирован, то получится триплет со средним пиком удвоенной интенсивностью, поскольку с удвоенной вероятностью будет формироваться смешанный по изотопу фрагмент. Отметим, что такая правильно симметричная картинка масс-спектра является результатом эквивалентности распространения легкого и тяжелого изотопов в природе. В случае других элементов с различным распространением в природе, интенсивность пиков изменится сообразно этой распространенности.
Углерод в составе органических соединений также представлен в виде двух изотопов, причем содержание тяжелого углерода-13 составляет 1,1%.
Пример: неопентан
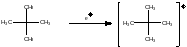
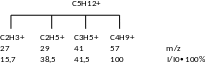
В продуктах фрагментации будет полностью отсутствовать пик исходного молекулярного иона, поскольку он распадается на 100%.
Пример: п-хлоранилин
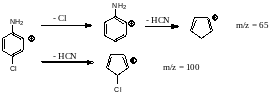
Фрагментация протекает по двум основным механизмам.
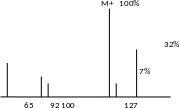
В масс-спектре будут иметься яркие проявления изотопного состава, т.к. хлор в природе представлен двумя изотопами. Пик в 7% указывает на наличие тяжелого изотопа углерода-13.
Задачи, решаемые при помощи масс-спектрометрии:
определение молекулярной массы
Молекулярные ионы очень ярко проявляются прежде всего в соединениях, в которых есть ароматические фрагменты. Если в исследуемом соединении эффективность фрагментации велика и выход молекулярного иона небольшой, то можно понизить энергию электронного пучка для того, чтобы подавить фрагментацию. Строго молекулярные пики давало бы использование электронов очень низкой энергии, в котором идет процесс образования анионов вместо образования катионов.
идентификация химического соединения
Масс-спектрометрия используется в комбинации с другими методами, особенно если природа исследуемого соединения неизвестна. Масс-спектры являются очень индивидуальными и различаются даже для изомеров. Одинаковые масс-спектры наблюдаются для стереоизомеров. Иногда масс-спектры используются как «отпечатки пальцев» (англ. fingerprint).
установление механизмов химических реакций
Основной подход – отслеживание включения изотопных меток во фрагменты исследуемых молекул
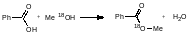
Использование масс-спектрометрии позволило также установить механизм реакций фрагментации в условиях электронного удара.
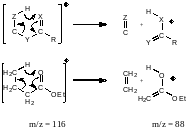
Дейтерируем исходное соединение в α-положение: масс-спектр продукта сдвинется.
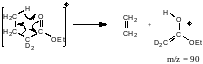
При дейтерировании в β-положение спектр продукта никак не изменится:
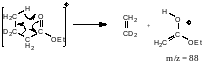
Дейтерирование в γ-положение также сдвинет спектра продукта:

4) Масс-спектрометрия является эффективным средством исследования кинетики химических реакций, особенно в тех случаях, где образуется малое количество веществ.
5) Масс-спектрометрия в силу чувствительности позволяет получить информацию о состоянии газообразных продуктов над твердой фазой.
6) Масс-спектрометрия позволяет определить потенциалы ионизации, исходя из потенциалов появления ионов.
7) Так как вклад процессов фрагментации молекул различных веществ в смеси в итоговый масс-спектр аддитивен, то масс-спектрометрия может быть использована для определения состава паров органических веществ.
До недавнего времени именно масс-спектрометрия обслуживала многие химические производства (крекинг и проч.)
Хромато-масс-спектрометрия
Комбинация газового хроматографа и масс-спектрометра, выполняющего роль высокоэффективного детектора продуктов разделения газовой смеси.
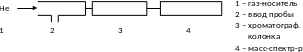
Информация о природе исследуемых веществ получается из двух источников:
времена удерживания для данных компонентов смеси на данной хроматографической колонке
из масс-спектров, полученных для химических веществ, разделенных на хроматографической колонке
В случае хромато-масс-спектрометров реализуются идеальные условия для функционирования масс-спектрометра, т.к. компоненты смеси разделяются на индивидуальные вещества, которые последовательно поступают на детектор. О выходе нового вещества можно судить по ионному току, причем интегрирование ионного тока по времени дает относительное количество вещества, а масс-спектр указывает на его природу.
Существует обширная база данных, поставляемая с масс-спектрометрами, причем она может быть расширена с учетом потребностей исследователя. Высокая чувствительность масс-спектрометра обеспечивает и высокую чувствительность хромато-масс-спектрометрических исследований: 100 пг по стеарату натрия.
Лазерная масс-спектрометрия (LMS)
Поверхность облучается импульсами лазерного излучения. Если сообщенная энергия превышает возможности образца по теплоотводности, то происходит поверхностная сублимация с образованием кратеров глубиной несколько мкм с размерами пятен в 10-100 мкм. Особенностью данной модификации является факт образования большого количества многозарядных ионов и отсутствие кластеров. Чувствительность метода высокая: 10-3 – 10-7 ат. %. Количественные измерения требуют использования стандартов, иногде роль стандарта может выполнять один из элементов образца.
Искровой метод масс-спектрометрии
К поверхности образца подводят зонд и пропускают разряд напряжением 100 кВ, испаряя вещество на площадке 100 мкм. Если образец не является проводящим, то его запрессовывают в фольгу и выполняют измерения. Метод традиционно используется для оценки качества образцов стали, а также в геологических исследованиях. Вместе со вторично-ионной масс-спектрометрией LMS и искровой метод приспособлены для исследования твердотельных образцов.
11.ИК-спектроскопия (IR, Infrared Spectroscopy)
В основе метода лежит длинноволновое поглощение, связанное с возбуждением колебаний атомов, входящих в состав молекул. Указанные колебания возникают по причине наличия упругих связей в молекуле.
Двухатомные молекулы: частоту колебаний можно описать формулой
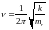 ,
,
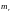 –
приведенная масса:
–
приведенная масса:
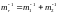 ,
,
k – силовая постоянная (возвращающая сила на единицу смещения).
В зависимости от смещения потенциальная энергия колебаний будет меняться следующим образом:

В то же время молекулярная система не может иметь непрерывного спектра энергетических состояний. Квантовая теория показывает, что энергия колебательного движения для молекулярных систем принимает дискретные значения, которые удовлетворяют соотношению:
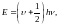
 – колебательное
квантовое число,
– колебательное
квантовое число,
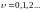
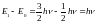
Т.е. разность энергий между колебательными уровнями прямо связана с частотой колебания молекулярной системы как механического осциллятора.

Наличие такой связи позволяет, выяснив, при какой частоте происходит поглощение, составить представление о природе атомов, участвующих в колебательных процессах в составе молекулы.
Энергия колебаний быстро рассредоточивается между всеми связями в молекуле, а также передается другим молекулам в межмолекулярных взаимодействиях, поэтому двухквантовые процессы существенной роли не играют.
Кроме того, для молекулярных систем существуют жесткие правила отбора, ограниченные изменением колебательного квантового числа.
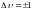
Такое ограничение сохраняется для идеальных молекулярных осцилляторов. В то же время в случае реальных молекул колебания являются ангармоническими, т.к. при больших смещениях возвращающая сила начинает падать.

Ангармоничность колебаний приводит к снятию запрета на изменение колебательного квантового числа более, чем на единицу, т.е. уменьшает жесткость правил отбора для колебательных переходов. Это позволяет наблюдать поглощение не только с нулевого уровня на первый, но и переходы с основного уровня на второй. Переходы такого рода называются обертонами. Они находятся приблизительно при удвоенной частоте по сравнению с переходом с нулевого на первый уровень и имеют на порядок меньшую интенсивность.
Ангармоничный характер колебаний в реальных молекулярных системах приводит обычно к тому, что уровни колебательных состояний перестают быть равномерно отстоящими по энергии.
Рассмотрим молекулу, состоящую из п атомов. Каждый атом имеет 3 степени свободы для поступательного движения (вдоль соответствующих осей координат), значит, молекула в целом характеризуется 3п степенями свободы. Из них три соответствуют поступательному движению молекулы как целого, а ещё три – вращательному движению относительно соответствующих осей. В случае линейной молекулы число вращательных степеней свободы уменьшается на единицу, поскольку вращение вокруг из одной осей не приводит к изменению координат атомов. Таким образом, на колебательные степени свободы, соответствующие изменению межатомных расстояний, приходится
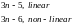
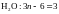
Три типа колебательных движений:
сжатие связей;
растяжение связей;
изменение валентного угла
Первый
и второй типы представляют собой
валентные колебания, характеризующимся
большим изменением энергии и обозначаются
 .
.

Колебания, связанные с изменением угла между связями, называются деформационными (δ). Они приводят к меньшим изменениям энергии (т.е. наблюдаются при меньших частотах).
В ИК-спектроскопии вместо частоты ν используют так называемые волновые числа.
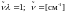
В
этом смысле волновое число отличается
от линейной частоты (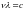 ).
).
Введение волнового числа позволило оперировать меньшими числами и отказаться от показателей. Знак тильды обычно в литературе опускается, поскольку все частоты в инфракрасной спектроскопии выражаются в волновых числах.
Измерения частот колебаний в молекуле воды дали следующие результаты:
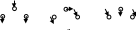
Измерение, выполненное для различных соединений, в состав которых входит гидроксильная группа, показало, что указанные частоты лишь незначительно зависят от массы соседних атомов.
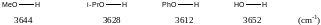
Это обстоятельство послужило основой для концепции групповых колебаний, лежащих в основе интерпретации спектров органических соединений. В основе данной концепции лежит представление о том, что связанные между собой осциллирующие элементы, колеблющиеся при разных частотах, можно считать независимыми. Если же атомы имеют близкие массы и связаны между собой связями сопоставимой длины, то такие осцилляторы начинают взаимодействовать.
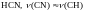
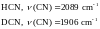
Молекула
циановодорода колеблется как единая
система, а частота в дейтерированной
молекуле понижается на
 .
Дейтерирование, приводящее к существенному
изменению массы, применяют иногда для
проверки правильности отождествления
полос в ИК-спектре.
.
Дейтерирование, приводящее к существенному
изменению массы, применяют иногда для
проверки правильности отождествления
полос в ИК-спектре.
ИК-спектр представляет собой зависимость между величиной пропускания Т и частотой излучения.


Максимум поглощения направлен вниз.
При изучении ИК-спектров органических соединений рассматривают область от 4000 до 400 см-1. В ней выделяют несколько диапазонов:
4000 – 3700 см-1 – область обертонов (проявляются обертоны для интенсивно поглощающих функциональных групп, переходы для которых лежат при меньших значениях волнового числа);
3700 – 1500 см-1 – область функциональных групп (лежат колебания основных функциональных групп, и именно колебания в этой области в первую очередь используют для идентификации соединения);
1500 см-1 и меньше – область отпечатков пальцев (лежат трудно идентифицируемые полосы, которые очень чувствительны к любым изменениям в молекуле (изомеры).
Особенность валентных колебаний С-Н состоит в большой чувствительности к характеру гибридизации углерода, с которым связан протон. Наличие кратной связи приводит к смещению пика в область выше 3000 см-1, что может быть использовано для определения ненасыщенности при исследовании химических соединений.
Значения частот колебаний для различных функциональных группировок табулированы. Эти таблицы систематизированы по функциональным группам и содержат комментарии, касающиеся особенностей, проявляемых функциональными группами в различных химических соединениях.
Значения экстинкции (поглощения) определяются для узкого круга функциональных групп. В большинстве случаев линии можно классифицировать по интенсивности полуколичественным способом: очень сильное, сильное, среднее, слабое.
Для того, чтобы молекула либо функциональная группа интенсивно поглощала в ИК-диапазоне, необходимо, чтобы она имела дипольный момент, который мог бы изменяться в ходе молекулярных колебаний. Иначе говоря, в симметричных молекулах, например, двойные связи вообще не проявляются в спектре.
Пример: октен-1

Ограничения концепции групповых орбиталей:
1) взаимодействие осцилляторов: если атомы в колеблющихся группировках имеют близкие массы и связи внутри группировок и между группировкой и остальной молекулой имеют сопоставимую длину, то осцилляторы начинают взаимодействовать и частота колебаний молекулы перестает быть характеристической величиной.
2) эффекты сопряжения: карбонильные группы в кетонах проявляются в области 1700 – 1750 см-1, сопряжение (например, в амидах) приводит к сдвигу частоты колебания до 1650 см-1.
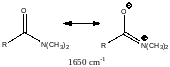
3) ещё более ярко проявляются эффекты внутри- и межмолекулярного взаимодействия, включая эффекты ассоциации. Наибольшее значение в этом случае играют наиболее высокоэнергетичные взаимодействия, к которым относится водородная связь.

В зависимости от степени «полимеризации» соотношение между пиками будет меняться.
Классическим примером внутримолекулярного взаимодействия является салициловый альдегид, в котором возможна реализация внутримолекулярной водородной связи, обеспечивающая сдвиг частоты валентных колебаний гидроксильной группы в область более низких частот.
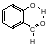
Сюда же относятся эффекты взаимодействия с растворителем. Примером может служить образование димеров карбоновых кислот. Колебания карбоксильной группы проявляются при 1780 см-1, но в случае димеризации частота сдвигается в область 1730 см-1. Для конденсированной пленки частота сдвигается ещё сильнее: 1710 см-1.
Эффект растворителя: колебания в эфирном растворе проявляются при 1735 см-1, в спиртовом – при 1720 см-1, в щелочном растворе – при 1610 см-1 (увеличивается длина цепи сопряжения).
Подготовка проб для ИК-спектроскопии
Как правило, в ИК исследуются образцы в твердом состоянии. Измерения в жидком состоянии выполняются в редких случаях. Для получения спектра необходимо, чтобы размеры частиц были меньше длины волны используемого излучения. Учитывая, что это длинноволновое излучение, то фактически, меньше 2 мкм. В противном случае светорассеяние затрудняет получение ИК-спектров. Поэтому образец перед измерением измельчается.
Существует два основных метода препарирования порошкообразных образцов.
1. Порошкообразный образец замешивается в виде суспензии в вазелиновом масле (С25). Как уже отмечалось, вазелиновое масло как матрица непрозрачно в области валентных и деформационных колебаний связи С-Н, т.е. в области 3000-2800 см-1 и в области 1480-1460 см-1, так что в этих областях проводить измерения не представляется возможным. В то же время суспензионный метод очень удобен для подбора величины оптического поглощения образца.
Суспензия в масле зажимается между двумя кристаллами хлорида натрия или бромида калия. Путем изменения расстояния между кристаллами можно легко подобрать оптимальные условия для получения спектров.
Возможность выполнения измерений в области 3000-2800 см-1 и в области 1480-1460 см-1 появляется, если заменить вазелиновое масло на полностью фторированное, которое поглощает в области более низких частот. Совмещением этих двух спектров можно получить обзорный спектр для исследуемого вещества.
2. Второй способ заключается в том, что мы смешиваем порошкообразный образец с бромидом калия в соотношении 1 мг : 300 мг и прессуем таблетку. Но и в данном случае некоторые участки спектра недоступны. Несмотря на то, что прессование осуществляется при одновременном вакуумировании, однако в силу гигроскопичности бромида в таблетке присутствует много остаточной воды, что делает невозможным выполнение измерений в области валентных и деформационных колебаний группы ОН.
Если суспензионный метод не позволяет проводить количественные измерения, то измерения при помощи таблетки позволяют получать количественные данные.
Существует также некоторое количество экзотических методов препарирования. В случае пластиков, резины, каучуков часто используется т.н. пиролитический метод. В это методе продукты термического распада осаждаются на поверхность кристалла KBr. В большинстве случае спектр аналогичен спектру исследуемого вещества. Такой подход носит прежде всего технологический характер (контроль качества, например).
При исследовании тонких пленок результаты измерений могут искажаться вследствие интерференционных эффектов, которые проявляются в виде периодических колебаний поглощения образца. Иногда с ними можно бороться, если полимерную пленку зажать между кристаллами хлорида натрия и смазать вазелиновым маслом.
Измерения в растворах проводятся в ячейках из галогенидов серебра (сегодня должны быть получше). Галогениды серебра подвергаются фотолизу и ячейки быстро выходят из строя. В качестве растворителей может применяться вода (диапазон 1550-950 см-1), широко используется тетрахлорметан (4000-1600 см-1). Иногда используется ТГФ, который имеет низкое фоновое поглощение в области 2600-1500 см-1. Количественные измерения в растворах позволяют определить экстинкцию для различных веществ, но иногда на этой основе реализован и качественный анализ. Так многие стероиды имеют аналогичные спектры поглощения, но резко отличаются по экстинкции, что позволяет выполнять их идентификацию.
ИК находит применение также и в области неорганических соединений.

Кроме того, можно исследовать образцы на предмет наличия различных форм воды, поверхностных гидроксильных групп и проч.
Поливольфраматы:

Основные применения ИК-спектроскопии в химии:
Идентификация химических соединений, в т.ч. и с использованием области отпечатка пальцев
Определение примесей
Количественный анализ (как правило, с использованием растворов)
Структурный анализ, в т.ч. и основанный на регистрации возможности взаимодействия между различными функциональными группами при данной геометрии.
Устройство ИК-спектрометра

1 – источник ИК-излучения. Сам спектрометр построен по двулучевой схеме с оптическим нулём. Двулучевая схема предполагает, что зондирующий световой поток делится на два, причём в один из световых потоков помещается образец, а во второй – образец сравнения, например, кювета с растворителем. Это позволяет вычесть из спектра вклад со стороны растворителя или какого-либо другого вещества. Деление светового потока осуществляется при помощи вращающихся зеркал 2, которые попеременно пропускают свет либо отражают (типа пропеллера). На пути световых потоков расположены кюветы 3 для образца и для сравнения. Свет, прошедший через первую и через вторую кюветы попадает в монохроматор 4 и детектируется детектором 5. Оптический клин 6, поглощающий во всем интервале ИК вдвигается в один из оптических путей с той целью, чтобы разность детектируемых сигналов была нулевой. Перемещение клина соответствует пропусканию, которое меняется в зависимости от той частоты, на которую настроен монохроматор. Меняя частоту, мы, таким образом, строим спектр пропускания.
Источником служит нагревательный элемент, причем если иметь в виду, что максимум спектра излучения сдвигается с ростом температуры в область коротких длин волн (закон Вина), то для того, чтобы обеспечить высокую интенсивность в ИК-диапазоне, необходимо нагревать световой источник до высоких температур (1500-1800°С).
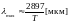
Оптика монохроматора в старых приборах была сделана из галогенидов щелочных металлов, что требовало осушения корпуса прибора. Более поздние приборы имеют дифракционную решетку со сравнительно небольшим числом линий.
Детектор – либо термопара, либо устройство, известное как болометр, т.е. элемент, сопротивление которого меняется в зависимости от температуры.
В последнее время появились так называемые ИК-фурье-спектрометры.

1 – источник света, 2 – полупрозрачное зеркало, 3 – образец, 4 – детектор, 5 – подвижное зеркало, совершающее качения.
В результате перемещения зеркала 5 со скоростью v, оптическая разность хода в спектрометре, схема которого аналогична схеме интерферометра Майкельсона, будет меняться во времени следующим образом:
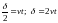
Интенсивность излучения, попадающего в фотоприемник, будет меняться в зависимости от изменения разности хода. Можно показать, что интенсивность во всем спектральном диапазоне подчиняется зависимости:
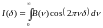
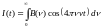
Преобразование Фурье позволит перейти к частоте и получить спектр поглощения.

Таким образом, с помощью Фурье-преобразования мы реконструируем спектр поглощения. Такие спектрометры более просты, чувствительны и обладают большим быстродействием по сравнению с двулучевыми. На английском спектроскопия, проводимая с помощью данного прибора, называется FTIR (Fourier transform Infrared Spectroscopy).
Можно получать один спектр в 400 мкс. Это позволяет комбинировать Фурье-спектрометры с газовыми хроматографами либо исследовать кинетику быстро протекающих реакций.
Метод нарушенного полного внутреннего отражения (НПВО)
П ри
падении на границу раздела светового
луча под углом, большим чем критический
угол
ри
падении на границу раздела светового
луча под углом, большим чем критический
угол
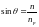
происходит проникновение световой волны во вторую, оптически менее плотную среду, т.е. образец. Если эта среда прозрачна, то отражение на внутренней границе, так называемое внутреннее отражение, составляет 100%.
Если вторая среда поглощает на данной длине волны, то выполняется соотношение:
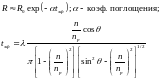
Таким образом, если вторая среда поглощает, то отражение нарушается, что и стало поводом к названию метода. НПВО – метод получения спектра поглощения образца, находящегося в контакте с призмой из материала с большим коэффициентом преломления. В качестве материала для призм используются Si, Ge, AgCl и TlBr(I), известный также как KRS-5.
Следует
отметить, что глубина проникновения
светового пучка, как правило, невелика
и поэтому наряду с простыми оптическими
схемами в большинстве случаев используют
оптические схемы, обеспечивающие
многократное внутреннее отражение (до
100 раз), что позволяет пропорциональным
образом увеличить
 .
.
Получаемые спектры в целом повторяют классические ИК-спектры, однако пики в них находятся при других длинах волн и имеют интенсивность, зависящую от длины волны (см. выражение для глубины проникновения). Чем длиннее волна, тем интенсивнее пики.
Преимущества метода НПВО:
Отсутствие интерференционных полос, что позволяет использовать метод для исследования тонких пленок.
Простота подготовки образца. Образец может наноситься на призму в виде суспензии в вазелиновом масле либо в виде порошка. Можно исследовать образцы, которые невозможно препарировать для снятия обычного ИК-спектра (например, биологические образцы)
Ограничения:
Относительно небольшая чувствительность.
Ограничение по коэффициенту преломления.
Примеры использования:
Исследование тонкослойных хроматограмм;
Определение коэффициента диффузии и эффективности впитывания волокнами;
Определение эффективности всасывания лекарственных препаратов и других химических веществ кожей человека;
Определение состава аэрозолей, образующихся при курении за счет электростатического притягивания частиц сигаретного дыма к поверхности призмы.
Спектрометр НПВО представляет собой обыкновенный ИК-спектрометр с измененным кюветным отделением. Все принципы ИК-спектроскопии могут быть распространены и на данный метод, но данные о частотах и интенсивностях пиков отличаются.
