
- •3.4Химическое равновесие
- •4.1. Способы выражения концентрации растворов.
- •4.2 Закономерности растворения
- •4.3 Растворы электролитов
- •4.4 Равновесие и обменные реакции в растворах электролитов
- •4.5 Гидролиз солей
- •5.1 Окислительно-восстановительные и электродные потенциалы
- •5.2 Химические источники энергии
- •5.3 Электролиз
- •5.4 Коррозия металлов
- •6.3 Способы очистки веществ
- •6.4 Качественный анализ
- •6.5 Химия воды
- •6.6 Общие свойства металлов
- •6.7 Взаимодействие металлов с водой, кислотами, щелочами и растворами солей.
- •6.8 Химия и экология
3.4Химическое равновесие
501 С точки зрения химической термодинамики, химическое равновесие характеризуется постоянством концентраций веществ во времени. Согласно химической кинетике, равновесие определяется равенством скоростей прямой и обратной реакций.
А)
N2
(г) + 3H2
(г) = 2NH3
(г),

Б)
Fe3O4
+ 4CO
(г) = 3Fe
(к) + 4CO2
(г),
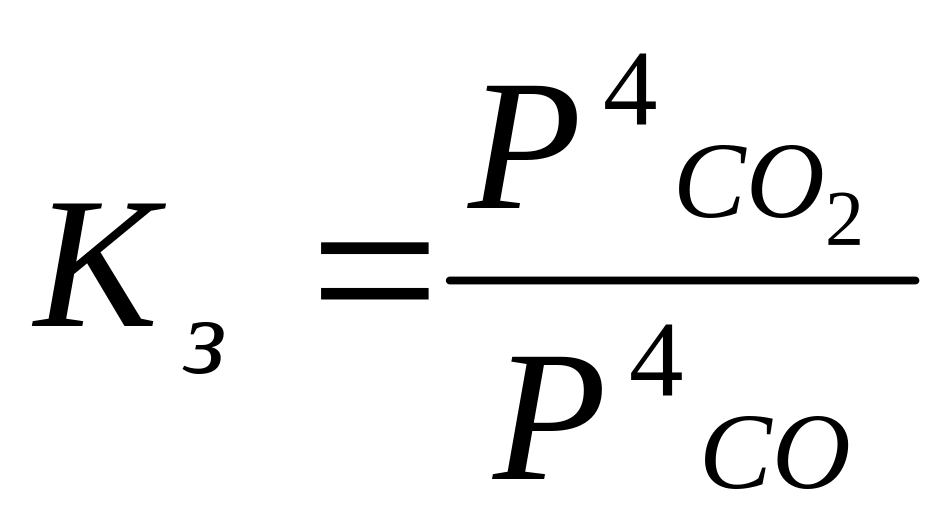
502. Константа химического равновесия - это отношение произведения концентраций продуктов химической реакции к произведению концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
А)
4HCl
+ O2
(г)= 2Cl2(г)
+ 2H2O
(г),

Б)
CaO
(k)
+ H2O
(г) = Сa(OH)2
(к),
![]()
503. Состояние реакции, при котором концентрации веществ не изменяются во времени, называется равновесным. Основные признаки: если на реакцию, находящуюся в состоянии химического равновесия оказать воздействие, то система перейдет в новое равновесное состояние, уменьшающее это воздействие. Если воздействие снять, то реакция вернется к исходному состоянию.
А)
CO(г)
+ H2O(г)
= CO2(г)
+ H2(г)
![]()
Б)
2CuO(к)
= 2Cu(к)
+ O2(г)
![]()
504. При истинном равновесии химическая реакция характеризуется постоянством концентраций всех веществ в течение сколь угодно долгого промежутка времени. При этом реакция подчиняется принципу Ле Шателье. При ложном химическом равновесии с течением времени концентрации веществ могут меняться, и реакция не подчиняется принципу Ле Шателье.
А)
3O2(г)
= 2О3
(г),

Б)
Na2CO3
(к) + CO2(г)
+ H2O(г)
= 2NaHCO3(к),
![]()
505.
Закон действующих масс: константа
равновесия химической реакции равна
отношению произведения концентраций
продуктов реакции к произведению
концентраций исходных веществ, взятых
в степенях, равных их стехиометрическим
коэффициентам: аА + bB
= cC
+ dD,
![]() .
.
А)
N2
(г) + О2
(г) = 2NО(г),
 ,
,
Б)
3Fe(к)
+ 4H2O(г)
= Fe3O4(к)
+ 4H2(г),
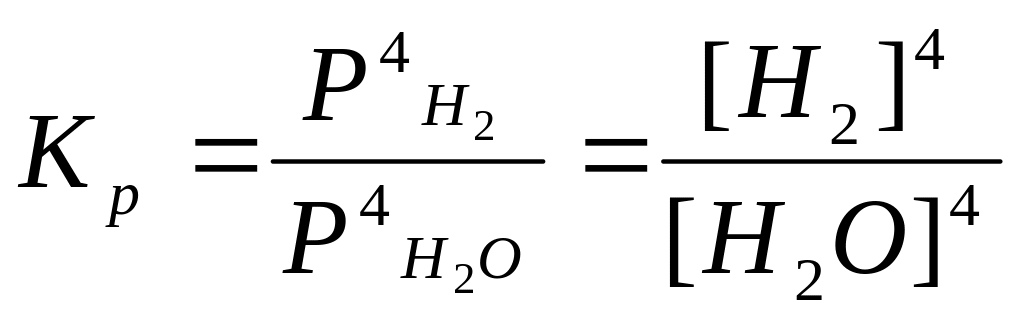 .
.
506. На величину константы химического равновесия влияют: природа реагирующих веществ, температура, давление.
А)
Y2
(г) + H2
(г) = 2HY
(г),
 ,
,
Б)
MgO(к)
+ CO2(г)
= MgCO3(к),
![]() .
.
507. N2 (г) + 3H2 (г) = 2NH3 (г),
-
Cисх.
х
у
0
Сравн.
3
9
4
 ,
Сисх. (N2)
= [N2]
+ 0,5[NH3]
= 3+ 0,5*4 = 5 моль/л.
,
Сисх. (N2)
= [N2]
+ 0,5[NH3]
= 3+ 0,5*4 = 5 моль/л.
Сисх(Н2) = [Н2] + 1,5[NH3] = 9 + 1,5*4 = 15 моль/л.
508. CO + Cl2 = COCl2
-
Cисх.
Х
у
0
Сравн.
0,2
0,3
1,2
![]() ,
Сисх. (Cl2)
= [Cl2]
+ [COCl2]
= 0,3 + 1,2 = 1,5 моль/л.
,
Сисх. (Cl2)
= [Cl2]
+ [COCl2]
= 0,3 + 1,2 = 1,5 моль/л.
Сисх(CO) = [CO] + [COCl2] = 0,2 + 1,2 = 1,4 моль/л.
509. CO + H2O = CO2 + H2
-
Cисх.
0,03
0,03
0
0
Сравн.
x
y
0,01
z
Согласно уравнению
реакции, водорода образуется столько
же, сколько и СО2:
[CO2]=[H2]=0,01
моль/л. СО и Н2О
израсходовалось 0,01 моль/л, следовательно
[CO]=[H2O]=0,02
моль/л.![]()
![]() .
.
510. FeO(k) + CO = Fe(k) + CO2
-
Cисх.
-
0,05
-
0,01
Сравн.
-
0,05-x
-
0,01+x
![]() 0,01+x=0,025-0,5x,
x=0,01. [CO] = 0,05 - 0,01 = 0,04 моль/л.
[CO2]
= 0,01 + 0,01 = 0,02 моль/л.
0,01+x=0,025-0,5x,
x=0,01. [CO] = 0,05 - 0,01 = 0,04 моль/л.
[CO2]
= 0,01 + 0,01 = 0,02 моль/л.
511. Br2 (г) + H2 (г) = 2HBr (г),
-
Cисх.
3
1
0
Сравн.
3-x
1-x
2x
![]() ,
3x2
+ 4x
- 3 = 0, x
= 0,54.
,
3x2
+ 4x
- 3 = 0, x
= 0,54.
[H2] = 3-0.54 = 2.46 моль/л, [Br2] = 1-0.54 = 0.46 моль/л, [HBr] = 2*0.54=1.08 моль/л.
w(H2)=(2.46/4)*100 %=61.5%, w(Br2)=(0.46/4)*100%=11.5%, w(HBr)=(1.08/4)*100%=27%.
512. N2O4 (г) = 2NO2 (г),
-
Cисх.
0.08
0
Сравн.
50%
X
Прореагировало 0.08*0.5 = 0.04 моль/л N2O4. Следовательно, образовалось 2*0.04 = 0.08 моль/л NO2 .
![]() .
.
513. Y2 (г) + H2 (г) = 2HY (г),
-
Cисх.
0.01
0.01
0
Сравн.
0.01-x
0.01-x
2x
К=40
![]() х
= 0.0076, [HY]=2*0.0076=0.015моль/л.
х
= 0.0076, [HY]=2*0.0076=0.015моль/л.
В=(0.015*100)/(2*0.01)=76%
514. Y2 (г) + H2 (г) = 2HY (г),
-
Cисх.
1
2
0
Сравн.
1-x
2-x
2x
К=50
![]() 46х2
-150х + 100=0, х = 0.57, Теоретически может
образоваться 2 моль HY,
образовалось 0.57*2 = 1.14 моль. В=(1.14*100%) / 2 =
57 %.
46х2
-150х + 100=0, х = 0.57, Теоретически может
образоваться 2 моль HY,
образовалось 0.57*2 = 1.14 моль. В=(1.14*100%) / 2 =
57 %.
515. 2HY (г) = Y2 (г) + H2 (г)
-
Cисх.
1
0
0
Сравн.
1-2x
x
x
К = 2*10-2
![]() х
= 0.11, разложилось 2*0.11 = 0.22моль HY,
степень разложения 22 %.
х
= 0.11, разложилось 2*0.11 = 0.22моль HY,
степень разложения 22 %.
516. Cl2 (г) = 2Cl(г)
-
Cисх.
0.04
0
Сравн.
0.04-x
2x
К=4.2*10-4
![]() 4х2
+ 4.2*10-4х
-1.68*10-5
= 0, х = 0.002, степень атомизации хлора равна
(002/0.04)*100 % = 5 %.
4х2
+ 4.2*10-4х
-1.68*10-5
= 0, х = 0.002, степень атомизации хлора равна
(002/0.04)*100 % = 5 %.
517. CO + H2O = CO2 + H2
Cисх. |
1 |
1 |
0 |
0 |
Сравн. |
1-x |
1-х |
х |
х |
К=1.
518. PCl5 = PCl3 + Cl2
-
Cисх.
0.3
0
0
Сравн.
0.3-x
х
х
К=125.
![]() ,
х2
+ 125х - 37.5 = 0, х = 0.299. Разложилось PCl5:
(0.299/0.3)*100% = 99.76 %.
,
х2
+ 125х - 37.5 = 0, х = 0.299. Разложилось PCl5:
(0.299/0.3)*100% = 99.76 %.
519. Принцип Ле Шателье: при оказании внешнего воздействия на реакцию, находящуюся в состоянии равновесия, ее равновесие смещается к состоянию, уменьшающему это воздействие. А) 2CO (г) + О2(г) = 2СО2 (г), ΔН0= -566 кДж/моль. Т.к. реакция экзотермическая, то при понижении температуры ее равновесие сместится вправо; т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при повышении давления равновесие сместится вправо. Б) N2 (г) + O2 (г) = 2NO (г), ΔН0= 180 кДж/моль. Т.к. реакция эндотермическая, то при понижении температуры ее равновесие сместится влево; т.к. количество газообразных продуктов реакции равно количеству газообразных исходных веществ, то повышение давления на равновесие не влияет.
520. При оказании внешнего воздействия на систему, находящуюся в состоянии равновесия, положение равновесия смещается к состоянию, уменьшающему это воздействие. А) 2H2 (г) + O2 (г) = 2H2O (г), ΔН0 = - 483.6 кДж/моль. Т.к. реакция экзотермическая, то при повышении температуры ее равновесие сместится влево; т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при понижении давления равновесие сместится вправо. Б) CaCO3 (k) = CaO (k) + CO2(г), ΔН0 = 179,0 кДж/моль. Т.к. реакция эндотермическая, то при повышении температуры ее равновесие сместится вправо; т.к. газообразные вещества - продукты реакции CO2 , то понижение давления сместит равновесие вправо.
521. N2 (г) + 3H2 (г) = 2NH3 (г), ΔH0= -92.4 кДж/моль. а) реакция экзотермическая, поэтому при увеличении температуры равновесие сместится влево, а при понижении - вправо. Б) Т.к. количество газообразных продуктов реакции меньше количества газообразных исходных веществ, то при повышении давления равновесие сместится вправо, а при понижении давления - влево. В) равновесие сместится вправо при повышении концентрации азота и водорода и понижении концентрации аммиака, при повышении концентрации аммиака и понижении концентрации азота и водорода равновесии сместится влево. Г) введение промоторов не смещает положение равновесия . д) Поглощение аммиака сместит равновесие вправо, а поглощение азота и водорода - влево. Е) введение инертного газа аналогично повышению давления.
522. 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г), ΔH0= -116.4 кДж/моль. а) равновесие сместится в сторону исходных веществ при повышении температуры, уменьшении давления, увеличении концентрации хлора и воды, понижении концентрации кислорода и соляной кислоты. Б) равновесие сместится в сторону продуктов при понижении температуры, увеличении давления, уменьшении концентрации хлора и воды, увеличении концентрации кислорода и соляной кислоты.
523. 3Fe(к) + 4H2O(г) = Fe3O4(к) + 4H2(г), ΔH0= -49,9 кДж/моль. Для увеличения выхода водорода необходимо понизить температуру, т. к. реакция протекает с выделением тепла. Давление не влияет на положение равновесия, т.к. количество газообразных продуктов равно количеству газообразных исходных веществ.
524 MgO(k) + CO2 (г) = MgCO3(к), ΔH0= -111,7 кДж/моль. Поглощение CO2 будет происходить при понижении температуры и повышении давления. Восстановление поглотителя будет протекать при повышении температуры и понижении давления.
525. CaO + H2O = Ca(OH)2.
ΔH0 = -986.6+635.5+241.8 = -109.3 кДж/моль. ΔS0 = 76.1-39.7-188.7 = -152.3 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 300 К. ΔG0 = -109.3 + 300*152.3*10-3 = -63.61 кДж/моль. Кр = 1.2*1011
б) Т = 1000 К. ΔG0 = -109.3 + 1000*152.3*10-3 = 43 кДж/моль. Кр = 5.7*10-3
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие экзотермической реакции смещается влево.
526. N2O3 = NO + NO2.
ΔH0 = 90.2 + 33.5 - 83.3 = 40.4 кДж/моль. ΔS0 = 210.6 + 240.2 - 178.2 = 272.6 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 00 C = 273 К. ΔG0 = 40.4 - 273*272.6*10-3 = -34.0 кДж/моль. Кр = 3.3*106
б) Т = 373 К. ΔG0 = 40.4 - 373*272.6*10-3 = -61.3 кДж/моль. Кр = 3.9*108
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
527. 2H2O = 2H2 + О2.
ΔH0 = 2*241.8 = 483.6 кДж/моль. ΔS0 = 2*130.5 - 205 - 2*188.7 = -321.4 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 500 К. ΔG0 = 483.6 + 500*321.4*10-3 = 644.3 кДж/моль. Кр = 4.5*10-68
б) Т = 1000 К. ΔG0 = 483.6 + 1000*321.4*10-3 = 805 кДж/моль. Кр = 8.5*10-43
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
528 ZnO + H2 = Zn + H2O.
ΔH0 = -241.8 + 350.6 = 108.8 кДж/моль. ΔS0 = 41.6 + 188.7 - 43.6 - 130.5 = 56.2 Дж/K*моль
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 300 К. ΔG0 = 108.8 - 300*56.2*10-3 = 91.94 кДж/моль. Кр = 9.6*10-17
б) Т = 1000 К. ΔG0 = 108.8 - 1000*56.2*10-3 = 52.6 кДж/моль. Кр = 5.7*10-3
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
529. FeO + H2 = Fe +H2О.
ΔH0 = -241.8 + 264.8 = 23 кДж/моль. ΔS0 = 27.3 + 188.7 - 60.8 -130.5 = 24.7 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0. ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT
а) Т = 500 К. ΔG0 = 23 - 500*24.7*10-3 = 10.65 кДж/моль. Кр = 0.077
б) Т = 1000 К. ΔG0 = 23 - 1000*24.7*10-3 = -1.7 кДж/моль. Кр = 1.23
Расчет согласуется с принципом Ле-Шателье, т.к. при повышении температуры равновесие эндотермической реакции смещается вправо.
530. 2HI = H2 + I2.
ΔH0 = 2*26.6 = 53.2 кДж/моль. ΔS0 = 130.5 + 116.2 - 2*206.5 = -166.3 Дж/(K*моль)
ΔG0 = ΔH0 - Т * ΔS0.
Т = 400 К. ΔG0 = 53.2 + 400*166.3*10-3 = 119.7 кДж/моль.
ΔG0 = -R*T*lnKp => Kp = e-ΔG/RT => Кр = 2.2*10-16
Согласно
закону Оствальда Кр
=
![]() .
Т.к. константа равновесия очень мала,
то можно пренебречь знаменателем. Тогда
.
Т.к. константа равновесия очень мала,
то можно пренебречь знаменателем. Тогда
![]() =
4.8*10-5 %.
К данному расчету принцип Ле-Шателье
применить нельзя, т.к. не рассматривается
смещение равновесия.
=
4.8*10-5 %.
К данному расчету принцип Ле-Шателье
применить нельзя, т.к. не рассматривается
смещение равновесия.
