
- •Индол и его производные
- •Фуран и его производные
- •Тиофен и его производные
- •Пятичленные гетероциклические соединения с двумя гетероатомами. Пиразол и его производные
- •Имидазол и его производные
- •Вопросы к кроссворду:
- •Ключ к кроссворду
- •Вопросы теста
- •Ключ к тесту
- •Задания
- •Ключ к заданиям
- •Игра: «Своя игра»
- •Синий раунд Тема «Или…или…»
- •Тема «Применение гетероциклических соединений»
- •Список литературы
Пятичленные гетероциклические соединения с одним гетероатомом.
Пиррол и его производные.
Название «пиррол» происходит от греческого слова «пир» - огонь и латинского слова oleum – масло. Сосновая лучинка, смоченная хлороводородной кислотой и высушенная в парах пиррола, окрашивается в красный цвет.

 N
N
Н
Пиррол
Пиррол – широко распространенное в природе гетероциклическое соединение. Пиррольное кольцо входит в состав многих биологически важных соединений. В значительных количествах пиррол находится в продуктах сухой перегонки различных белковых веществ.
Получение пиррола. Синтетически пиррол получают:
из фурана и аммиака при высокой температуре в присутствии АL 0 ;
нагреванием аммониевой соли слизевой кислоты, которая образуется при окислении лактозы азотной кислотой. Соль при этом диссоциирирует в свободную кислоту, подвергающуюся дегидратации, декарбоксилированием и циклизации с участием аммиака.
Лактоза НN0 H ОН ОН Н
 NH
OOC – C – C – C – C – COO NH
NH
OOC – C – C – C – C – COO NH
NН ОН Н Н ОН
НО ОН


 НС – СН
НС – СН
 Н
Н
Н
 С С НС - СН НС - СН
С С НС - СН НС - СН
 -Н О
-Н О
Н
 ООС СООН
НООС- С С - СООН --- НС СН
ООС СООН
НООС- С С - СООН --- НС СН
ОН ОН N N
H Н
Н Н
N
Н
N –Алкильные замещенные пиррола синтезируются при замене аммиака первичными аминамами.
Гомологи пиррола образуются при конденсации а – аминокетонов (полученных восстановлением нитрокетонов) с кетонами (лучше кетоэфирами), открытой Л.Кнорром в 1911 году:
СООR
Н С О Н С
С
СН С
Н С NН О СН
Н С ОН Н СООR
С С
С С
Н С NН НО СН
_________________________________________
2
 Н
О
Н
О
Н С СООR




 H C C
H
H C C
H
N

H
Физические свойства. Свежеперегнанный пиррол – бесцветная жидкость с температурой кипения 130 С, на воздухе сначала желтеет, затем темнеет и осмоляется. По запаху он напоминает хлороформ.
Строение и химические свойства. Значение межъядерных расстояний пиррола подтверждают предположение о сопряжении - электронов двойных связей с неподеленной парой - электронов атомов азота. Действительно, связь N C (0,142 нм) укорочена по сравнению со «стандартной» в метиламине, а межъядерные расстояния атомов углерода уподобляются таковым в бутадиене:
 НС СН НС СН
НС СН НС СН
 Н
С NН НС СН
Н С СН
Н
С NН НС СН
Н С СН
N
H
Дипольный момент пиррола равен 1,80 D, а его большее значение для N – метилпиррола (1,94D) указывает на то, что момент пиррола направлен от азота к ядру:


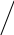
Распределение электронной плотности в молекуле пиррола, вычисленное методом молекулярных орбитателей, показывает, что эффективные заряды на атомах больше в а-, чем в - положениях:

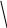

N
H
Полной делокализации -электронов препятствует невозможность существования пятивалентного 10-электронного атома азота, который неизбежно должен возникнуть в этом случае:





N N
H H
Таким образом, характер сопряжения в пирроле может быть приближенно выражен так:
Электрофильное замещение в молекуле пиррола протекает преимущественно в - положении вследствие его большего отрицательного заряда и более низкой энергии переходного состояния (по сравнению с энергией переходного состояния в случае электрофильной атаки в -положение). Переходное состояние а стабилизируется сопряжением двойной связи и неподеленной пары электронов атома азота с –С - ; в переходном состоянии б в делокализации положительного заряда участвует только неподеленная пара азота:

 N
N
N
N
 H
H
H
H

N
H
A B
Кислотно-основные свойства. Участие неподеленной пары гетероатома в образовании - электронного секстета сильно понижает основность пиррола по сравнению со вторичными алифатическими аминами. Пиррол имеет К =2,5 х 10 , а диэтиламин – К =0,6 х10
В сильнокислой среде протон реагирует с - атомом углерода, обладающим повышенной электронной плотностью (электрофильная атака), а не с поделенной парой азота. Образующийся катион неустойчив вследствие потери ароматического характера и легко полимеризуется. Поэтому пиррол неустойчив в кислой среде и является ацидофобным соединением. В присутствии сильных оснований пиррол образует соли и превращается в устойчивый ароматический анион:
`

N
H


N N
H H
N N
Катион пирролоний Анион пирролоний
Полимер
Таким образом, пиррол проявляет амфотерные свойства.
Восстановление пиррола преимущественно приводит к 3 –пирролину – продукту 1,4 – присоединения к диеновой системе. Каталитическое гидрирование завершается образованием насыщенного гетероцикла – пирролидина, являющегося сильным основанием:



«Н»

(Zn+CH COOH) 3-Пирролин
 N
N
H
N
H
2-пирролин
2 00
С
00
С
N
H
Пирролидин
Наибольший интерес представляют реакции электрофильного замещения в кольце пиррола. Галогенирование пиррола (например, иодирование) протекает легко с образованием тетрагалогенопроизводных (аналогичная реакция у ароматических соединений осуществляется с трудом):

I
 I
I
- HI
N N
H H
2-Иодпиррол
I I
3I
I I
-3HI
N
H
2,3,4,5- Тетраиодпиррол
Интересный прием был предложен для синтеза сульфокислот пиррола. Сульфирование обычными сульфирующими агентами невозможно вследствие ацидофобности пиррола. Поэтому в качестве сульфирующего вещества были использованы нейтральные продукты взаимодействия оксида серы (VI) с пиридином и диоксаном (А. П. Терентьев) – N-пиридинсульфотриоксид и диоксансульфотриоксид, которые легко разлагаются в момент реакции на исходные компоненты и сульфируют пиррол:
О



 N S O
N S O

H
O

 S O
S O
N -Пиридинсульфотриоксид N O O

H
O O
O S О O S O
O O
Диоксансульфотриоксид
SO H
N
H
Пиррол-2-сульфокислота
Этот метод является общим для сульфирования ацидофобных гетероциклических соединений. Нитрование пиррола ацетилнитратом приводит к 2-нитропирролу.
Пиррол, подобно фенолу карбилируется оксидом углерода (IV), образуя 2-пирролкарбоновую кислоту, а в более жестких температурных условиях – 3-пирролкарбоновую кислоту:

CO
N N
+ COOK
K

HCI

 COOK COOH
COOK COOH
-KCI
N N

H H
COOK COOH
HCI
-KCI
N N
H H
калиевая соль 3-пирролкарбоновая
3-пирролкарбоновой кислоты кислота
С диазосоединениеми в кислой среде пиррол дает неустойчивые моно- и диазокрасители.
Пиррольные ядра входят в состав порфина – соединения, лежащего в основе двух биологически весьма важных веществ: гемоглобина – красного красящего вещества крови, играющего исключительно ответственную роль в процессе дыхания, и хлорофилла – зеленого красителя растений и водорослей, принимающего активное участие в процессе фотосинтеза.
Порфин – устойчивое соединение, содержит 22 - электрона (11 сопряженных двойных связей и четыре пары - электронов атомов азота – неподеленные пары). Всего в сопряжении участвуют 30 электронов; их число отвечает правилу ароматичности Хюккеля (4 п +2) и делает порфин небензоидным ароматическим соединением. Экспериментально установлена тождественность четырех пиррольных ядер, что допускает миграцию протонов между атомами азота. Порфин обладает наибольшей энергией резонанса (840 кДж/моль) и, следовательно, термодинамической устойчивостью по сравнению с другими сопряженными - электронными системами, например, бензолом, пиримидином, пурином, имеющими энергию резонанса соответственно 155, 126-189, 210-336 кДж/моль.
Порфин обычно изображают приведенной формулой, как и бензол из формул Кекуле. В протопорфине ядро порфина связана с алкильными группами:
Гемоглобин красных кровяных телец (относительная молекулярная масса около 67 тыс.) состоит: 1) из геме – неустойчивого, почти плоскового комплексного соединения протопорфирина с ионом двухвалентного железа (Fе , ферро-состояние):
Гем
Он входит в состав гемоглобина в виде четырех частиц, взаимно расположенных на расстоянии примерно 3 нм в углублениях, образованных белковой цепью; 2) из растворимого в воде белка глобина, содержащего четыре полипептидные цепи – субъединицы ( две имеют - и две - - спиральное строение).Каждая частица гема связана с пептидной цепью ,непосредственная связь осуществляется атомом железа с остатком гистидина пептидной цепи. Итак, атом железа в гемоглобине координационно связан шестью лигандами, и шестым ,изменяющимся в различных производных гемоглобина, может быть молекула кислорода (оксигемоглобин) :
Полипептидная цепь
Полипептидная цепь
Порфиновое ядро (расположено
Перпендикулярно плоскости
Рисунка)
При извлечении гемоглобина из эритроцитов ( при его обработке уксусной кислотой и хлоридом натрия или при нагревании гем отделяется от глобина ) двухвалентное железо (F e ) окисляется до трехвалентного (Fe ,ферри-состояние ) и гем превращается в гемин- прочные красные кристаллы, содержащие анион хлора:
В гемине атом трехвалентного железа крмплексно связан с четырьмя атомами азота пиррольных остатков и ионно с анионом хлора. Полный синтез гемина был осуществлен Г. Фишером (1929 г.)
Биологическая роль гемоглобина заключается в осуществлении процесса дыхания – переносе кислорода в животном организме от легких к тканям. Гемоглобин,в котором гем является активным центром,образует с кислородом нестойкое молекулярное соединение _ оксигемоглобин, легко диссоцитрующий с выделением кислорода. Необходимо отметить, что железо гема связывает кислород только в присутствии глобина ; в течение всего процесса железо остается двухвалентным:
Гемоглобин + О = оксигемоглобин
(Fe ) (Fe )
По видимому, окружение гема полярным белком препятствует естественному окислению двухвалентного железа гема в трехвалентное и обеспечивапет необходимое обратимое присоединение кислорода к гемоглобину.
Хлорофилл состоит из и -хлорофиллов ( они различаются тем, что метильная группа первого окислена во втором до альдегидной), содержащих ядро дигидропорфина, комплексно связанного с магнием (Mg ) в хлорофилле остаток пропионовой кислоты этерифицирован высшим непредельным спиртом фитолом:
-хлорофилл
 CH
CH
CH
CH
 Н С
Н С
R - CHCH CH - - CH CHCH CH - - CH – C=CH
– CH-
- CHCH CH - - CH CHCH CH - - CH – C=CH
– CH-
H C
Остаток фитола
-Хлорофилл отличается от гемина не только заменой железа магнием, но наличием остатка фитола и двух атомов водорода в пиррольном ядре,а также дополнительным карбочиклическим кольцом. Хлорофилл, поглощая кванты света и используя поглощенную энергию для фотохимического разложения воды, участвует в процессе фотосинтеза.
Синтез хлорофилла осуществлен в 1960 году Р.Вудвордом и сотрудниками.
Материнским веществом хлорофилла является хлорофилловая кислота (ХлКН ). Вместо магния в ней два атома водорода находятся придвух вторичных азотах. Способность хлорофилловой кислоты к комплексообразованию является предметом интенсивных исследований, направленных на создание модельных соединений (аналогов хлорофилла) и имеющих конечную, пока далекую цепь, - овладение процессом фотосинтеза:
ХлКН + (СН СОО) Ме

Избыток Ме – Си , Со , Fе
СН СООН (100%)
Хл Кме
(комплекс)
Биологическая роль порфиринов значительно шире их участия в построении систем гемоглобина и хлорофилла. Установлено, что без них
живые организмы не могли бы приспособиться при переходе от ранней восстановительной к современной окислительной атмосфере.
Индол и его производные
Индол, или -бензопиррол, обладает неприятным запахом. Он может быть выделен из каменноугольной смолы (фракция, кипящая при 240-260 С) через индолкалий или долнатрий в небольших количествах.
Возрастающее применение индола при синтезе индолилуксусной кислоты и триптофана и важная биохимическая роль его производных привели к разработке различных синтетических методов образования индольного кольца: 1) термическая конденсация анилина и ацетилена (А.Е. Чичибабин, 1915 г.); 2) католическая циклизация фенилгидразонов алифатических альдегидов или кетонов (например, пропионового альдегида или ацетона) по Э.Фишеру (1983 г.):


 CH
CH; 600-700 С
CH
CH; 600-700 С
NH
N
Анилин Индол
 H
H

CH COCH ;Zn CI ; 180-200 С
-Н О
 NH-NH
NH-NH
Фенилгидразин
 CH CH
перегруппировка
CH
CH CH
перегруппировка
CH
C -NH
N N
H N
H
Фенилгидразон 2-метилиндол
Молекулярная диаграмма индола (эффективные заряды на атомах и порядки связей) указывает на повышенную электронную плотность на - углеродном атоме и высокую кратность углеродной связи:
N N
H H
Эффективные заряды Порядок связей
на атомах
В индоле, который содержит одновременно бензольный и пиррольный остатки, одна из пиррольных двойных -связей участвует в образовании бензольного - электронного секстета, а сопряжение другой - связи с неподеленной парой электронов атома азота повышает электронную плотность в положении 3 ( -положение):
 Э
Э
N
H
Индол во многом повторяет свойства пиррола, однако вследствие стабилизируещего сопряжения с бензольным кольцом характеризуется более низкой реакционной способностью. Для индола типичны реакции электрофильного замещения: нитрование, галогенирование, азотосочетание.
Некотрые - замещенные индола являются биологически активными соединениями, выполняющими ответственные функции в живоных организмаз.
Так, триптофан, незаменимая а-аминокислота в цепи биохимических превращений, в результате окислительного декарбоксилирования превращается в 5-окситриптамин – серотонин – важнейший биогенный амин. Серотонин, являясь медиатором нервных импульсов, участвует в процессе передачи нервного возбуждения центральной нервной системы и регуляции психической деятельности.
Антагнистом серотонина является диэтиламид лизергиновой кислоты, выделенный впервые из алкалоидов спорыньи (препарат LSD-25), который вытесняет серотонин из его рецепторов (опасный наркотик – причина появления слуховых, зрительных галлюцинаций, потери чувства собственной личности). LSD-25, охарактеризованный впервые в 1943 г., биогенетически связан с триптофаном.
Другое направление метаболизма триптофана приводит к триптамину и индолилуксусной кислоте.
Индолилуксусная и индолпропионовая кислоты являются стимуляторами роста растений, благоприятствующими корнеобразованию при вегетативном размножении. Индолилуксусная кислота получается совместной конденсацией индола с формальдегидом и цианидом калия по механизму электрофильного замешения, а индолпропионовая кислота синтезируется цианэтилированием индола.
Кислородные производные индола – оксиндол, индоксил, изатин. Оксиндол существует в кетоформе и образует два ряда производных. Это явление в свете классических представлений объяснялось таутомерией:
СН СН
 С=О С-ОН
С=О С-ОН
N N
H
Кетонная форма оксиформа
Возможно, что истинная причина кроется в способности иона, возникающего при отрыве протона, к двойственному реагированию. Индоксил важен как промежуточный продукт при синтезе индиго, в которое он легко превращается при окислении. Он, по-видимому, способен к таутомерии:
О ОН
С С
 СН СН
СН СН
N N
H H
Индоксил
Изатин был получен при окислении индиго хромовой смесью или азотной кислотой. Сейчас его синтезируют из анилина, хлоральдегида и гидроксиламина. Сначала образуется изонитрозоацетанилид, который затем превращается в изатин:
CH=NOH
 +CH(OH)
+ NH OH C=O
+CH(OH)
+ NH OH C=O
CCI -3HCI; NH
NH -Н О
О
С изонитрозоацетанилид
O
КОН C
С=О COOK
HCI
NH
N
H
Изатин калиевая соль
изатиновой кислоты
Изатин (кристаллы красного цвета с темп. Пл. 200-201 С) легко размыкает цикл,обратимо превращаясь в изатиновую кислоту.
Индиго – синий краситель, применявшийся еще в глубокой древности, впервые упоминается Ю. Цезарем в его «Записках о галльской войне». Первоначально его добывали из индигоносных растений (разновидности индигоферы и вайды), где он находился в виде глюкозида, гидролизующегося под влиянием ферментов или минеральной кислоты до глюкозы и индоксила:
ОС Н О ОН
С С
Н О
СН -С Н О СН
N N
H H
глюкозид индоксил
индоксила
Строение индиго было установлено А. Байером в 1870 г., им же впервые осуществлен синтез индиго. Технические способы были предложены учеником А. Байера – К. Гейманом. Исходными продуктами в них служат анилин или антраниловая и монохлоруксусная кислоты.
Конденсация анилина с натриевой солью хлоруксусной кислоты приводит к фенилглицину, который циклизуется при нагревании со щелочными агентами (гидрооксидом калия, смесью гидрооксида калия и гидроксида натрия или амидом натрия). Эта операция является наиболее ответственной. Далее индоксил окисляется кислородом воздуха в индиго.
Конденсация антраниловой кислоты с натриевой солью хлоруксусной кислоты дает фенилглицин-о-карбоновую кислоту, которая циклизуется в альфо-индоксилкарбоновую кислоту. Ее декарбоксилирование приводит к индоксилу, а затем при окислении образуется индиго:
NaO O O
+ C C + CH - COONa
OH CI
NH CH NH
CI
 Антрониловая
кислота
Антрониловая
кислота
 -HCI
NaCI
-HCI
NaCI
HO O
O
C C – OH
CH CH – COOH
N N
H H
Фенилглицин фенилглицин-о-карбоновая
Кислота
NaOH
-Н О
1 ) КОН; 300 С O
2) КОН + NaOH C
3 ) NaNH ; 150-200 С CH- COOH
N
H
O a-индоксилкарбоновая
C кислота
 CH
СО
CH
СО
N
H
индоксил О (воздух)
С N
N C
Индиго
Индиго имеет транс-строение, при котором пространственно сближенные карбонильные группы и атомы водорода иминогрупп образуют образуют внутримолекулярные водородные связи. Подобное строение индиго объясняет его высокую прочность, стойкость к свету.
Индиго – родоначальник большой группы индигоидных красителей. Это темно-синий порошок (темп.пл. 390-392 С), легко возгоняющийся с образованием пурпурно-красных паров. Он нерастворим в воде и в обычных органических растворителях, хорошо растворяется в кипящем анилине и нитробензоле. При восстановлении гидросульфитом натрия (Na S O ) получается бесцветное соединение – лейкоиндиго ( белое индиго, от греч. «лейкос» - белый) :
О H
С N

«Н»
 С=С
С=С
N C
H O
Синее индиго
ОН H
С N
С – С
N C
H OH
Лейкоиндиго содержит гидроксильные группы фенольного характера, поэтому легко растворяется в щелочах. На воздухе щелочной раствор лейкоиндиго легко окисляется, снова превращаясь в синее индиго. На этом принципе основано крашение индиго. При крашении ткань или пряжу погружают в щелочной раствор лейкоиндиго, называемый индиговым кубом ( способностью выбираться целлюлозой обладает кислая соль лейкоиндиго, В.Г. Абозин), затем вынимают и оставляют на воздухе. Лейкоиндиго на ткани или пряже окисляется и превращается в синее индиго, окрашивающее материал в глубокий чистый синий цвет. Индиго применяют для крашения хлопка, в ситцепечатании, а также для крашения шерсти. Исследования по установлению строения индиго и разработке методов его синтеза являются одной из ярких страниц развития органической химии второй половины 19в.
Соединение, в котором пиррольный цикл конденсирован с двумя бензольными кольцами, называется карбазолом. Карбазол входит в состав антроценовой фракции каменноугольной смолы. Это бесцветное кристаллическое соединение ( темп.пл. 245-247 С). Его используют для получения ценных сернистых кубовых красителей и инсектицидов, применяемых для борьбы с вредителями виноградников.Технический интерес представляет N-винилкарбазол, получаемый присоединением ацетилена к карбазолу:
 СН
СН
СН
СН
N N
H CH=CH
Карбазол N-винилкарбазол
N- Винилкарбозол при полимеризации образует поливинилкарбазол, известный под названием полектрона, обладающий исключительно высокой диалетрической постоянной. Винилкарбазольные полимеры применяют в качестве покровных материалов, для пропитывания бумаги и т.д. N – Винилкарбозол физиологически активен: попадая на кожу, он вызывает дермит (воспаление кожи).
