
Занятие № 4 химическая кинетика. Химическое равновесие
Тема занятий |
1. Вводный контроль на тему «Химическая кинетика и равновесие». 2. Семинар по теме «Химическая кинетика и равновесие. Энергетика и направление химических реакций». 3. Лабораторная работа № 3 «Кинетика химических реакций и химическое равновесие» 4. Индивидуальное домашнее задание № 4 по вариантам |

Теоретическая часть
Скорость химических реакций
Химическая кинетика изучает химические реакции с точки зрения скорости их протекания. Скорость химической реакции измеряется изменением концентрации веществ, вступающих в реакцию или образующихся в результате реакции за единицу времени: СМ V = (моль/(л·с) (1)
Скорость химической реакции зависит: - от природы реагирующих веществ – описывается законом действия масс (законом Гульдберга-Вааге): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ,
Например, для реакции аА + bB cC + dD
V = k СAa СBb (3)
где k – константа скорости химической реакции, а и b – стехиометрические коэффициенты.
При наличии в реакционной системе газовых фаз увеличение или уменьшение давления соответственно увеличивает или уменьшает концентрацию реагирующих веществ, что и определяет зависимость скорости реакции от давления.
В случае гетерогенных реакций концентрации веществ, находящихся в твердой фазе представляют собой постоянную величину и в уравнение закона действия масс не включаются.
- от температуры – определяется правилом Вант-Гоффа: скорость реакции возрастает в 2-4 раза при повышении температуры системы на каждые 10 градусов: V2 = V1 · (t2–t1)/10 (4) где V1 – скорость реакции при температуре t1; V2 – скорость реакции при температуре t2; – температурный коэффициент (как правило, = 2–4)
|
Химическое равновесие Необратимыми называют химические реакции, в результате которых исходные вещества практически полностью превращаются в продукты. Необратимые реакции могут протекать только в одном направлении, например: Zn + 4HNO3 = Zn(NO3)2 + 2NO2↑ + 2H2O.
Обратимыми называют химические реакции, идущие одновременно в двух противоположных направлениях, в результате чего в реакционной смеси присутствуют как продукты реакции, так и исходные вещества:
2 В тот момент, когда скорость прямой реакции (синтез продуктов) становится равной скорости обратной реакции (разложение продуктов с образованием исходных соединений), в системе устанавливается химическое равновесие. Количественной характеристикой химического равновесия является константа равновесия (К), представляющая собой отношение констант скорости прямой и обратной реакций. По значению константы равновесия можно судить о степени превращения исходных соединений в продукты реакции.
Для реакции
k 1 [C]c • [D]d K = = (5) k 2 [A]a • [B]b
где k 1, k 2 – константы скорости прямой и обратной реакций; a, b, c, d – стехиометрические коэффициенты в уравнении реакции; [A], [B], [C], [D] – равновесные молярные концентрации соединений A, B, C, D.
Влияние изменения условий на положение равновесия определяется принципом Ле-Шателье: при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению оказанного воздействии:
– при увеличении концентрации какого-либо вещества равновесие смещается в сторону расхода этого вещества; – при повышении температуры равновесие смещается в направлении эндотермической реакции, а при понижении – экзотермической реакции; – при увеличении давления равновесие смещается в сторону уменьшения объема, а при понижении давления – в сторону увеличения объема системы.
|


 SO2
+ O2
2SO3
SO2
+ O2
2SO3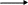 aA + bB
cC + dD
aA + bB
cC + dD