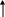Тема амикарбоновые кислоты и их производные
1. Общая характеристика.
|
Карбоновые кислоты, содержащие в молекуле карбоксильную группу и аминогруппу одновременно называются аминокислотам (аминокарбоновые). |
Они широко распространены в природе и являются структурными элементами белковых молекул, ферментов, гормонов. Играют важную роль в биологических процессах организма. Аминокислот много более 200, 60 входят в состав живых организмов, и только 20 – в состав белковых молекул.
А минокислоты алифатические
ароматические
гетероциклические
Алифатические (аминокислоты жирного ряда) Отличаются по свойствам от ароматических. Они чаще растворимы в воде и не растворимы в органических растворителях.
По химическим свойствам являются амфотерными соединениями, так как имеет
кислотную группу - CООН и основную NH2 . И могут образовывать соли с
основаниями и минеральными кислотами. Аминокислоты, являясь амфотерными электролитами существуют в виде биполярных ионов (внутренних солей) как в водных растворах, так и в твердом состоянии.
R – CН
– CООН
R
– CH
– CОО-
– CН
– CООН
R
– CH
– CОО-

NH2 NH3+
Поэтому применяются в медицине в свободном виде и в виде солей.
- Одним из характерных свойств аминокислот является легкое окисление.
А) до NH3 , CO2 и альдегида с более короткой цепью
Б) При действии аминокислоты NaNO2 в кислой среде или HNO3, окисление идет до молекулярного N2 и выделение гидроксикислот.
- Для аминокислот характерно образование солей меди (в них Cu2+ связан дополнительными валентностями с атомами азота, образуя комплекс темно-синего цвета.
- Все аминокислоты жирного ряда даю реакцию с нингидрином. Конечный продукт окрашен. Нингидрин не является строго специфичным реактивом на аминокислоты, так как образует окрашенные продукты с некоторыми другими соединениями ( пример сине-фиолетовое окрашивание с мезатоном, эфедрином, зеленое – с рибофлавином; красное с изониазидом.
Общим методом количественного определения аминокислот является определение в их молекулах органически связанного азота - Метод Кьельдаля.
Масса навески препарата прокаливается в присутствии к H2SO4 , CuSO4 , K2SO4
С оли являются катализаторами. В результате минерализации органически связанный азот переходит в ионогенное состояние (NH4)2SO4 . Затем добавляют 30% раствор NaOH, при этом выделяется NH3, который отгоняется в раствор борной кислоты = метаборат аммония
|
+ H2SO4 (NH4)2SO4 + CO2 + SO2 + H2O
|
( NH4)2SO4 + 2NaOH 2NH3 + Na2SO4 +2H2O
N H3 + H3BO3 NH4BO2 + H2O
Образовавшийся метаборат аммония оттитровывают HCl
N H4BO2 + HCl NH4Cl + HBO2
И ндикатор
метиловый красный: до перехода
зеленого цвета в красно-фиолетов.
ндикатор
метиловый красный: до перехода
зеленого цвета в красно-фиолетов.
Наиболее широкое применение из аминокислот жирного ряда имеют глутаминовая кислота, аминокапроновая кислота, метионин, аминалон.
2. КИСЛОТА ГЛУТАМИНОВАЯ Acidum glutaminicum
H OOC - CH2 – CH2 – CH – CООН
NH2
C5H9NO4 М = 147
Представляет собой - аминоглутаровую кислоту. Глутаминовая кислота входит в состав миозина (белок мышц); козеина (беок кожи), В – лактоглобулина, содержится в белках мозга, много её в белках злаковых растений.
А) Получение: ранее получали из злаков. Сейчас синтетически из акрилонитрила и ацетиламиномалонового эфира.
Б) Физические свойства: белый кристаллический порошок кислого вкуса. Мало растворим в холодной воде, лучше в горячей. Нерастворим в органических растворителях. Растворяется в кислотах и основаниях, образуя соли. При нагревании отщепляется вода и образуется циклическая пиррролидонкарбоновая кислота. Оптически активна, определяют её удельное вращение, которое д.б. от +30 до +34 - 5% раствор в разведенной HCl.
В). Определение подлинности.
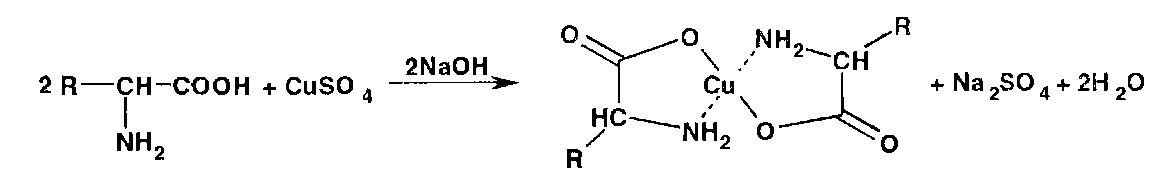
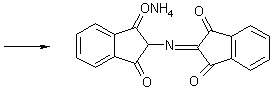
ГФ – реакция с нингидрином: глутаминовая кислота окисляется нингидрином при нагревании и распадается на альдегид, CO2 , NH3. NH3 конденсируется со второй молекулой нингидрина (1) и с продуктом его восстановления дикетооксигидринденом. В результате реакции образуется аммонийная соль енольной формы дикетогидринденкетогидринамина, имеющая сине-фиолетовую окраску. Это соединение называют «Синь Роймана».
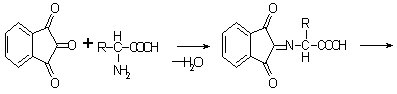
Она может применяться как реактив на многие соли металлов (СuSO4, CaCl2, AgNO3 ) Этот реактив образует хелатные комплексы с металлами, многие из которых окрашены
- глутаминовая кислота + CuSO4 + NaOH окрашенный комплекс темно-синего цвета.
ГФ - реакция с резорцином в присутствии к. H2SO4 при нагревании образуется плав красного цвета,
|
при разбавлении водой и раствором NH4OH = красно-фиолетовое окрашивание с зеленой флюоресценцией. Сущность реакции: при нагревании глутам. к-ты с H2SO4, отделяется вода и образуется пирролидинкарбоновая кислота, она вступает в реакцию с резорцином, образуя продукт, имеющий в аммиачной среде красно-фиолетовое окрашивание |
Г) Количественное определение
ГФ рекомендуется определять 2-мя методами.
по количеству органически связанного азота (метод Кьельдаля).
метод нейтрализации. Кислоту титруют раствором NaOH в присутствии индикатора бромтимолового синего до перехода желтой окраски голубовато-зеленую.
формальный метод. Кислоту глутаминовую можно оттитровать раствором NaOH по 2 –м карбоксильным группам, если вначале связать аминогруппу формальдегидом образующееся N- метиленовое производное обладает сильными кислотными свойствами и может быть оттитровано раствором NaOH.
Д). Применение. Нейротропное ср-во.
Участвует в процессе азотистого обмена в организме, она связывает образующийся в процессе обмена веществ NH3 и обезвреживает его.
Применяется при заболеваниях ЦНС – при различных психических расстройствах, эпилепсия, психозы, реактивн. состояния ДЦП, болезнь Дауна.
внутрь: в виде 1% раствора и таблеток, реже 1% р-р в/в.
Выпуск: порошок, таблетки 0,25 покрытые оболочкой, таблетки по 0,25 растворимые в кишечники, 1% раствор в ампулах.
Ё) Хранение: в хорошо укупоренной таре, в защищённом от света месте.