
- •Классификация методов комплексонометрического титрования
- •Комплексоны и комплексонаты
- •Индикаторы
- •Использование комплексных соединений в анализе
- •Устойчивость комплексных соединений в растворе
- •Константа устойчивости и константа нестойкости комплекса
- •Определение содержания магния
- •Анализ смеси ионов кальция и магния
Комплексоны и комплексонаты
Комплексонами обычно называют органические соединения, представляющие собой производные аминополикарбоновых кислот. Простейший комплексон — нитрилотриуксусная кислота (НТА), известная под названием комплексон 1 (сокращенно H3Y):
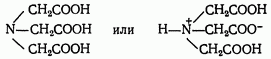
Наибольшее значение имеет четырехосновная этидендиаминтетрауксусная кислота (ЭДТА) — комплексон II (сокращенно H4Y):
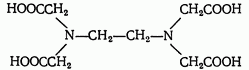
или
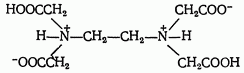
Комплексоны
наряду с карбоксильными группами (-СООН)
содержат аминный азот (
N).
Благодаря такому строению эти соединения
отличаются мульти(поли)дентатностью,
т. е. способностью образовывать сразу
несколько координационных связей с
ионами металлов-комплексообразователей.


На практике обычно применяют двунатриевую соль этилендиаминтетрауксусной кислоты, которую называют комплексоном III или трилоном Б (сокращенно Na2H2Y):
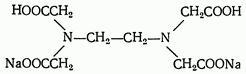
Комплексон III образует со многими катионами устойчивые малодиссоциированные растворимые в воде внутрикомплексные соли, построенные по типу известной комплексной соли диметилглиоксимата никеля.
С некоторыми ионами металлов-комплексообразователей комплексны образуют настолько устойчивые слабые электролиты, что обычными качественными реакциями невозможно доказать присутствие данного катиона в растворе этого комплексного соединения.
Реакции между комплексоном и ионами металлов-комплексообразователей протекают стехиометрически, т. е. в строго эквивалентных отношениях, это обстоятельство открывает широкие возможности применения комплексонов для количественного определения многих катионов, в том числе кальция, цинка, меди, алюминия, индия и др.
Комплексонаты. Комплексные соединения с полидентатными лигандами (хелаты), которые образуются при взаимодействии катионов металлов с комплексонами, называют комплексонатами. В ЭДТА шесть донорных атомов: два атома азота и четыре атома кислорода (по одному в каждой карбоксильной группе), поэтому во всех многоядерных комплексонатах он является шестидентатным лигандом. Комплексонаты имеют октаэдрическую форму.
В процессе образования комплексоната на 1 моль двух-, трех и четырехзарядных катионов Мen+ в большинстве случаев расходуется 1 моль комплексона Na2H2Y и образуется соединение состава MeY(n-4)+ с молярным отношением компонентов (комплексообразователя и лиганда) 1:1. Комплексонаты различаются числовым значением заряда внутренней координационной сферы и ее прочностью. Для катионов металлов, имеющих одинаковые ионные радиусы, прочность соединения возрастает с увеличением заряда иона-комплексообразователя. Более высокая прочность комплексонатов по сравнению с комплексными соединениями, построенными из монодентантных лигандов, объясняется тем, что катион металла входит в состав хелатных циклов. Чем больше хелатных циклов образуется во внутренней координационной сфере комплексоната, тем он прочнее (хелатный эффект).
Индикаторы
В качестве индикаторов при комплексонометрических титрованиях часто применяют красители: кислотный хром темно-синий, кислотный хромоген черный специальный (иначе называемый эриохром черный Т или хромоген специальный ЕТ 00) и др. Эти индикаторы в щелочной среде имеют синюю окраску.
Ионы кальция, магния и ряда других металлов образуют с индикаторами внутрикомплексные соединения, окрашенные в вишнево-красный цвет. При титровании комплексоном III раствора, содержащего определяемый катион и индикатор, ионы металла переходят от индикатора к комплексону III, при этом выделяется свободный индикатор. В точке эквивалентности красная окраска раствора переходит в синюю, свойственную индикатору.
Эриохром черный Т. Эриохром черный Т является органическим азокрасителем группы o,o'-диоксиазонафталина:
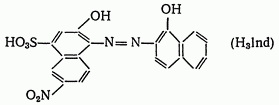
диссоциирующий с образованием H+, H2Ind-, Hind2-, Ind3-. В его молекулу входят две фенольные группы и хромофорная азогруппа. Поэтому эриохром черный Т способен реагировать с ионами металла-комплексообразователя с образованием комплексных соединений. Сам индикатор окрашен в синий цвет. В нейтральной или щелочной среде при pH=7-11 он образует с ионами металлов (Cu2+, Mg2+, Zn2+, Mn2+, In3+, Al3+ и др.) соединения красного цвета.
Уравнение реакции можно представить в следующем виде: заключительная стадия титрования комплексоном III протекает согласно уравнению
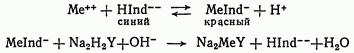
Для поддержания pH раствора на требуемом уровне обычно в титруемый раствор добавляют аммиачную буферную смесь.
Ксиленоловый оранжевый. Ксиленоловый оранжевый является органическим красителем трифенилметанового ряда. Сам индикатор окрашен в желтый цвет. В кислой среде при pH даже значительно меньше 7 он дает с ионами металлов (Zn2+, ThIV, ZrIV и др.) комплексные соединения красного цвета. Переход окраски очень резкий.
К числу катионов, определяемых титрованием комплексоном III в присутствии ксиленолового оранжевого, относятся Fe3+(pH=1-1,5); ZrIV(pH=1-2); Bi3+(pH=2-3,5); Al3+(pH=2-4); In3+(pH=3-4,5); Tl3+(pH=4-5); Zn2+, Cd2+, Cu2+, Hg2+, РЗЭ(pH=5-6).
По своему строению ксиленоловый оранжевый представляет собой 3,3’-бис(ди(карбоксиметил)-аминометил)-о-крезосульфофталеин:
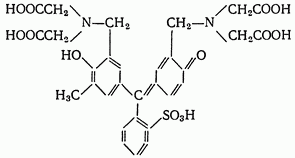
Кислотный хром темно-синий. Кислотный хром темно-синий является органическим азокрасителем:
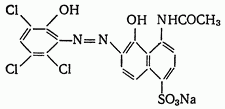
Сам индикатор окрашен в синий цвет. С катионами металлов в щелочной среде он образует комплексные соединения вишнево-красного цвета. Его применяют при титровании растворами комплексонов катионов цинка, кадмия (pH=9-10), марганца (pH=10), магния (pH=10-11), кальция (pH>12) и др.
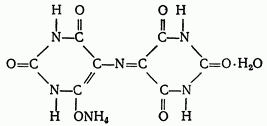
Мурексид (пурпурат аммония). Мурексид представляет собой темнокрасный порошок. Водный раствор мурексида окрашен в фиолетовокрасный цвет, изменяющийся в зависимости от среды: при pH≤9 — красно-фиолетовый, pH=9-10 — фиолетовый, pH>11 — синефиолетовый. С катионами кальция, никеля, кобальта, меди и другими мурексид образует комплексные растворимые в воде соединения красного или желтого цвета, разлагаемые комплексоном III с образованием более устойчивых внутрикомплексных солей. В процессе титрования солей кальция и других металлов в присутствии мурексида в точке эквивалентности наблюдается изменение красного цвета раствора в сине-фиолетовый цвет. Структурную формулу мурексида можно представить следующим образом:
Гидроны. В ряде случаев в процессе комплексонометрического титрования бывает очень трудно различить переход одной окраски к другой. Поэтому в таких случаях прибегают к различным приемам, обеспечивающим оптимальные условия наблюдения за наступлением конечной точки титрования.
И. С. Мустафин и Е. С. Кручкова предложили добавлять к раствору индикаторного вещества так называемый внутренний светофильтр, значительно улучшающий контрастность перехода индикатора. Рекомендованные ими индикаторные растворы гидрон I (для суммарного определения кальция и магния) и гидрон II (для определения кальция в присутствии магния) в присутствии избытка определяемых катионов имеют вишнево-красный цвет, переходящий в зеленый при избытке комплексона. У этих индикаторов внутренним светофильтром является краситель нафтоловый желтый. Применяя гидроны, можно пользоваться 0,002 н. растворами титранта и определять 0,0003-0,005 мг-экв/л кальция и магния. В настоящее время гидрон II является, вероятно, одним из наилучших индикаторов для комплексонометрического определения кальция в присутствий магния.
