
4. Кислотно-основное равновесие. Константы диссоциации кислот и оснований. Гидролиз солей как частный случай кислотно-основного равновесия. Константа гидролиза. Буферные системы в анализе. Буферная ёмкость.
Системы, в которых протекают химические реакции, могут достигать специфического конечного состояния - химического равновесия. Внешнее проявление химического равновесия заключается в том, что концентрации веществ, образующих данную химическую систему, перестают меняться и остаются постоянными во времени, если не изменяются внешние условия. Установление постоянной концентрации – один из признаков химического равновесия. Химическое равновесие может установиться только в тех системах, где происходят обратимые реакции( реакции, где продукты и реагенты реакции могут превратиться друг в друга). Равновесие не означает прекращение реакции. Истинное химическое равновесие имеет динамический характер. Это такое состояние реакционной системы, когда скорость прямой реакции равна скорости обратной реакции. Кислотность раствора является одним из основных факторов, влияющих на протекание химических реакций, в связи с чем исследование и расчёт равновесия в растворах кислот и оснований имеют большое практическое значение. При смешивании растворов кислоты и основания устанавливается равновесие. Чтобы рассчитать концентрацию ионов водорода и концентрацию аниона в растворах различных кислот и оснований, выделяют группу сильных кислот и оснований и группу слабых кислот и оснований. Реакции кислотно-основного взаимодействия в растворе протекают быстро, но скорость взаимодействия не является причиной каких-либо затруднений в анализе.
По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон. Сильными в водном растворе являются все галогенводородные кислоты, кроме фтороводородной, концентрация ионов водорода в растворах сильных кислот равна концентрации кислоты, а концентрация аниона зависит от кислотности раствора. Сильными основаниями являются водные растворы гидроксидов щелочных, щелочно-земельных металлов. Концентрация ОН ионов равна концентрации соответствующего гидроксида. Слабые кислоты диссоциируют частично: НА+Н2О=Н3О+А
Многоосновные кислоты диссоциируют ступенчато, и каждая ступень диссоциации характеризуется ступенчатой константой диссоциации. Общая константа диссоциации равна произведению ступенчатых.
Константы диссоциации кислот и оснований
Электролитическая диссоциация- распад молекул или кристаллов растворяемого вещества на катион и анионы. (Аррениус изучал 1886г.)
Сольватация- взаимодействие растворяемых веществ с молекулами растворителя.
Электролиты- вещества, молекулы и кристаллы которых в растворе вследствие электорилитической диссоциации распадаются на ионы. Сильные электролиты- вещества, которые при растворении практически полностью диссоциируют на ионы.
Связь между равновесными концентрациями всех реагентов и продуктов реакции выражает закон действующих масс:
Отношение произведений концентраций продуктов реакции, взятых в степенях, равных их стехеометрическим коэффициентам, к произведению концентраций реагентов, также взятых в степенях, равных их стехеометрическим коэффициентам, является постоянной величиной, т.е. константой равновесия
Закон действующих масс может быть применен к водным растворам кислот. Например, в водном растворе уксусной кислоты устанавливается следующее равновесие:
![]()
Константа этого равновесия определяется выражением
![]()
Величина называется константой диссоциации кислоты. Ее размерность такая же, как размерность концентрации( моль/л
Константу диссоциации кислоты можно также выразить с помощью закона разбавления Оствальда:
![]()
где с исходная концентрация кислоты, а а - степень диссоциации кислоты. Эту степень диссоциации можно установить, определяя молярные электропроводности раствора с заданной концентрацией, а также бесконечно разбавленного раствора (подробнее об этом см. в гл. 10).
Константа диссоциации кислоты
является мерой силы этой кислоты. Для
таких кислот, как соляная кислота,
которая практически полностью
диссоциирована в водном растворе,
константа диссоциации имеет очень
большую величину. И наоборот, для слабых
кислот константа диссоциации КЛ имеет
чрезвычайно малые значения. Поэтому
для сопоставления относительной силы
кислот удобнее пользоваться вместо их
констант диссоциации величинами , которые
определяются следующим выражением![]()
Таблица . Константы диссоциации кислот и оснований в воде при 25 °С
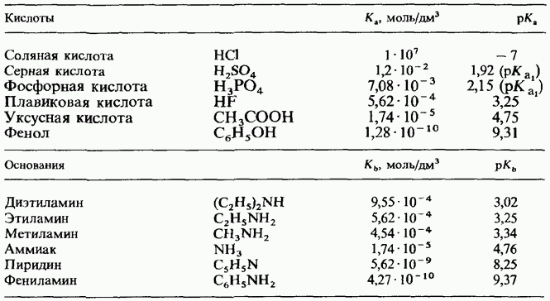
Для большинства известных кислот эта величина принимает значения в интервале от 1 до 14. Сильные кислоты имеют низкие значения а слабые кислоты - высокие значения. В табл. указаны значения Кл и pKa для некоторых кислот. Многопротонные кислоты, как, например, фосфорная характеризуются несколькими константами диссоциации. Например, как трехпротонная кислота имеет три константы диссоциации . Они называются первой, второй и третьей константами диссоциации и обозначаются соответственно .
Константа диссоциации кислоты (Ka) — константа равновесия реакции диссоциации кислоты на катион водорода и анионкислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д. Чем больше значение Ka, тем больше молекул диссоциирует в растворе и, следовательно кислота более сильная. Степениь диссоциации- это отношение концентрации продиссоциировавших молекул к общей концентрации молекул.
Закон действующих масс можно также применить и к диссоциации оснований в водном растворе. Например, при растворении аммиака в воде устанавливается следующее равновесие:
![]()
Константа диссоциации основания для этого равновесия определяется выражением
![]()
Для определения относительной силы оснований удобно пользоваться шкалой значений , где
![]()
Сильные основания характеризуются низкими значениями , а слабые основания-высокими значениями.
Ионное произведение воды
Электропроводность воды, даже в самых ее чистых образцах, никогда не уменьшается строго до нуля. Это обусловлено самоионизацией воды. Чтобы понять это явление, рассмотрим равновесие
![]()
Применяя к этому равновесию закон действующих масс, получим
![]()
Константа равновесия Кw называется ионным произведением воды. Она имеет размерность (концентрация). Конкретные значения ионного произведения воды зависят от температуры.
![]()
Между ионным произведением воды и константами диссоциации любой кислоты и сопряженного ей основания существует простое соотношение. Это соотношение можно вывести снова, рассматривая в качестве примера равновесие диссоциации уксусной кислоты в водном растворе:
![]()
Для ацетата, который является сопряженным основанием уксусной кислоты:
![]()
Перемножая полученные выражения получим
![]()
Логарифмируя последнее равенство, находим
![]()
Полученное соотношение позволяет легко определить по известному значению какой-либо кислоты значение для сопряженного ей основания.
Обратим внимание на то, что если кислота является сильной, т. е. характеризуется низким значением то сопряженное ей основание должно иметь большое значение Это означает, что сопряженное основание сильной кислоты должно быть слабым, как уже было указано ранее. Для выражения меры кислотности или щелочности среды в химии используют понятие водородного показателя.
