
АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра органической, биологической и
физколлоидной химии
БИОЛОГИЧЕСКАЯ ХИМИЯ
Методические указания по выполнению лабораторных работ для студентов специальности 020803.65 “Биоэкология”,
240902.65 “Пищевая биотехнология”, 110901.65 “Водные биоресурсы и аквакультура”, 080401.65 “Товароведение и экспертиза товаров",
260100.62 “Технология продуктов питания”.
Часть II
АСТРАХАНЬ 2010 г.
Методические указания содержат введение, описание техники безопасности и противопожарных мер при работе в лаборатории органической химии, описание лабораторных работ по органической химии (часть 2).
Составители: к.х.н., доц. кафедры органической химии Фоменко Алевтина Ивановна, ведущий инженер Васильева Елена Андреевна.
Методические указания рассмотрены и утверждены на заседании кафедры органической химии (протокол № 9 от 25 октября 2010 г.)
Рецензент: д.т.н., профессор Долганова Наталья Вадимовна
Содержание
Лабораторная работа № 1……….........................................……….....4
Лабораторная работа № 2……………………………………………..8
Лабораторная работа № 3……………………………………………..12
Лабораторная работа № 4……………………………………………..21
Тема: "СВОЙСТВА ФЕРМЕНТОВ".
При выполнении данной работы вам понадобятся реактивы, являющиеся в той или иной степени токсичными - это СuSO4, раствор Фелинга II, а также раствор Люголя (р-р J2 в H2O с добавлением КJ). СuSO4 и раствор Фелинга не летучи, из раствора Люголя J2 может улетать. Все реактивы, в особенности раствор Люголя, не следует без надобности держать открытыми!
После работы с ними следует тщательно мыть руки.
Лабораторная работа № 1.
"ОБЩИЕ СВОЙСТВА ФЕРМЕНТОВ"
Опыт №1: Влияние температуры на скорость реакции, ускоряемой ферментом.
Скорость реакций, идущих в присутствии неорганических катализаторов, возрастает с повышением температуры.
Так, крахмал быстро гидролизуется в присутствии соляной и разбавленной серной кислоты только при кипячении.
Наиболее благоприятной температурой для действия большинства ферментов, находящихся в организме человека, является температура 35-40ºС. При повышении температуры фермент начинает денатурировать.
Понижение температуры ниже оптимума является причиной понижения реакционной способности молекул. В этом можно убедиться, исследуя действие амилазы слюны на крахмал при 0º, 37º, 100ºС.
Оборудование и реактивы:
1. Штатив с пробирками.
2. Воронка.
3. Стаканчик на 30 мл.
4. Водяная баня.
5. Чаша со льдом.
6. Крахмал – 0,1% раствор.
7. Р-р Люголя.
8. Амилаза слюны - готовится каждым студентом.
Ход работы: В стаканчик собирают слюну и разбавляют ее в пять раз дистиллированной водой. Если в растворе будут загрязнения, то фильтруют его через несколько слоев марли.
В три пробирки вносят по 10 капель разбавленной слюны и помещают их:
1- в кипящую баню
2- в баню при 37-40ºС
3- в баню со льдом
Через 5-7 минут во все три пробирки добавляют по 10 капель крахмала, тщательно перемешивают содержимое каждой пробирки и ставят в те же условия. Замечают время. Через пять минут пробирки вынимают из бань. Пробирку вынутую из кипящей бани, охлаждают под краном. Добавляют в каждую пробирку по 1 капле раствора Люголя и отмечают результат.
Таблица №1.
-
субстрат
катализатор
КРАХМАЛ
0º
37º
100º
амилаза
Как далеко прошел гидролиз в каждой пробирке? Сделайте вывод. Гидролиз крахмала протекает по схеме:

Каждый продукт реакции дает разное окрашивание с раствором Люголя.
Опыт №2: Специфичность действия амилазы и сахаразы.
Для изучения специфичности действия амилазы и сахаразы можно воспользоваться тем, что при гидролизе субстратов (крахмал, сахароза), на которых мы будем исследовать ферменты, образуются соединения, обладающие редуцирующими свойствами, т.е. дающие положительную реакцию Троммера. Фелинга, Толленса и др., в то время как исходные субстраты - крахмал, сахароза - этих реакций не дают, т.к. в их молекуле нет свободных гликозидных гидроксилов (карбонильной группы).

крахмал α-D-глюкоза (при полном гидролизе)
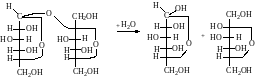
сахароза α,D-глюкоза β,D-фруктоза
Оборудование и реактивы:
Штатив с пробирками
Водяная баня
Сахароза 0,1% р-р свежеприготовленный
Крахмал 0,1% р-р свежеприготовленный
Сахараза
Амилаза
Реактив Фелинга I и II.
Можно использовать раствор амилазы, оставшийся от опыта №1.
СПЕЦИФИЧНОСТЬ АМИЛАЗЫ.
Ход работы: Вносят в одну пробирку 10 капель раствора крахмала, во вторую 10 капель раствора сахарозы. В обе пробирки добавляют по 5 капель амилазы слюны и помещают пробирки в водяную баню при t =37-40ºС.
Через 10 минут пробирки вынимают, охлаждают, добавляют по 5-6 капель реактива Фелинга (3 капли раствора Фелинга I и 3 капли раствора Фелинга II).
Нагревают пробирки в пламени горелки. Отмечают результаты.
СПЕЦИФИЧНОСТЬ САХАРАЗЫ.
Ход работы: В одну пробирку вносят 10 капель раствора крахмала, в другую 10 капель раствора сахарозы. Затем в обе пробирки добавляют по 5 капель сахаразы. Помещают пробирки в баню при 37-40°С на 10 минут. Затем вынимают их из бани, охлаждают и проводят реакцию Фелинга, так, как описано выше.
Результаты вносят таблицу № 2 (полученная окраска).
Таблица №2.
РЕАКЦИЯ ФЕЛИНГА |
||
субстрат
фермент |
КРАХМАЛ
|
САХАРОЗА
|
АМИЛАЗА |
|
|
САХАРАЗА |
|
|
Сделайте выводы.
Опыт №3. Влияние активатора и ингибитора на активность амилазы слюны.
Ход работы: В три пробирки наливают:
в первую - 10 капель Н2О;
во вторую - 8 капель H2О +2 капли 1% р-ра NаС1;
в третью - 8 капель Н2О +2 капли 1% р-ра СuSO4.
В каждую пробирку приливают по 10 капель слюны, разведенной 1:5, перемешивают, добавляют по 5 капель 0,5% р-ра крахмала, вновь перемешивают и оставляют при комнатной температуре.
Через 1-2 минуты в три пробирки с водой, подкрашенной каплей раствора йода, отливают по 2-3 капли содержимого каждой опытной пробирки.
Какую окраску приобретает содержимое каждой из пробирок? Если разницы в окрасках содержимого пробирок нет (все синие), опыт повторяют, увеличивая время выдержки.
Аналогично пробу берут через 1-2 минуты после взятия первой пробы. Результаты работы фиксируют в таблице №3.
Таблица №3.
-
№
фермент
субстрат
Время действия фермента (в мин.)
Окраска жидкости после добавления J2 в присутствии
NаС1
Н2О
СuSO4
1
амилаза
крахмал
1-2
2
амилаза
крахмал
2-4
Сделайте вывод.
