
Основные представления теории Бора.
е = 1,6×10-19 Кл,
0 = 8,8510-12 Ф/м
= 1,6×10-19 Кл,
0 = 8,8510-12 Ф/м
Линейчатые спектры
Формула Ридберга – Бальмера, описывающая серии в спектре атома водорода и водородоподобных ионов (He+ и Li++ и т.д.)
![]()
 ,
,
где – частота спектральных линий, R = 1,097107 м-1 – постоянная Ридберга, с = 3108 м/с – скорость света в вакууме, n и m – целые числа. n определяет серию (n = 1, 2, 3, …), m определяет отдельные линии в серии (m = n +1, n +2, n +3, …).
n = 1
– серия Лаймана (УФ),
= 1
– серия Лаймана (УФ),
n = 2 – серия Бальмера (УФ, В),
n = 3 – серия Пашена (ИК),
n = 4 – серия Брэкета (ИК),
n = 5 – серия Пфунда (ИК),
n = 6 – серия Хэмфри (ИК).
Каждая серия имеет
границу, соответствующую m =
.
Это наибольшая частота серии или
наименьшая длина волны ![]() .
.
![]() ,
где U
– разность потенциалов
,
где U
– разность потенциалов
![]() ,
UI
– первый потенциал возбуждения
,
UI
– первый потенциал возбуждения
![]() ,
UII
– второй потенциал возбуждения
,
UII
– второй потенциал возбуждения
![]() ,
Ui
–потенциал ионизации,
,
Ui
–потенциал ионизации,
![]() –
энергия ионизации
–
энергия ионизации
Волны де Бройля.
![]() ;
если v
с,
если
v
с,
,
;
если v
с,
если
v
с,
,
![]() .
.
где h = 6,6210-34 Джс – постоянная Планка, р – импульс, m – масса частицы, Wk – кинетическая энергия, U – ускоряющая разность потенциалов, q– заряд, с = 3108 м/с – скорость света в вакууме, v – скорость движения,. Для электрона q = е = 1,6×10-19 Кл, m = mе = 9,110-31 кг.
С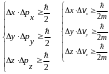
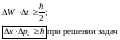 оотношение
неопределенностей
оотношение
неопределенностей
г![]() де
= 1,0510-34 Джс,
де
= 1,0510-34 Джс,
x– неопределенность координаты, рx – неопределенность проекции импульса на ось x, vx – неопределенность проекции скорости на ось x, рx– проекция импульса на ось x, vx – проекция скорости на ось x, m – масса, W – неопределенность энергии частицы в каком–либо состоянии, t – время пребывания частицы в этом состоянии.
Уравнение Шредингера
![]() – уравнение
Шредингера для стационарных состояний.
= f(x,
y,
z)
– волновая функция, U(x,
y,
z)
– потенциальная энергия, W
– полная энергия, m
– масса частицы,
= 1,0510-34 Джс–
постоянная Дирака
– уравнение
Шредингера для стационарных состояний.
= f(x,
y,
z)
– волновая функция, U(x,
y,
z)
– потенциальная энергия, W
– полная энергия, m
– масса частицы,
= 1,0510-34 Джс–
постоянная Дирака
Ч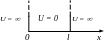
 астица
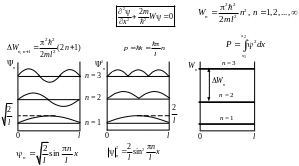
в одномерной прямоугольной бесконечно
глубокой «потенциальной яме»
астица
в одномерной прямоугольной бесконечно
глубокой «потенциальной яме»
где Wn – собственные значения энергии, l – ширина ямы, n – квантовое число, Wn – энергетическая разность между уровнями, p –импульс частицы, k – волновое число, P – вероятность нахождения частицы в интервале от x1 до x2, n – волновая функция , ||2n – плотность вероятности.
Сложные (многоэлектронные) атомы
n = 1, 2, …, ¥ – главное квантовое число
l = 0, 1, 2, …, (n-1) – азимутальное (орбитальное) квантовое число
m = 0, ±1, ±2, …,± l - магнитное квантовое число
ms = 1/2 - магнитное спиновое квантовое число
|
Слой |
Число электронов в состояниях |
Максимальное число электронов |
||||
s (l = 0) |
p (l = 1) |
d (l = 2) |
f (l = 3) |
g (l = 4) |
|||
1 |
K |
2 |
- |
- |
- |
- |
2 |
2 |
L |
2 |
6 |
- |
- |
- |
8 |
3 |
M |
2 |
6 |
10 |
- |
- |
18 |
4 |
N |
2 |
6 |
10 |
14 |
- |
32 |
5 |
O |
2 |
6 |
10 |
14 |
18 |
50 |
АТОМ |
||||||
собственные значения энергии n = 1, 2, …, – главное квантовое число |
||||||
|
|
|||||
l = 0, 1, 2, …, (n -1) – орбитальное (азимутальное) квантовое число |
||||||
|
|
|||||
m = 0, 1, 2, …, l – магнитное квантовое число |
||||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
||||||
