
- •Cодержание
- •Введение
- •Правила техники безопасности. Общие правила синтеза Техника лабораторных работ
- •1. Порядок работы в лаборатории
- •Общие положения
- •Основные правила, которых надо придерживаться при работе в химической лаборатории:
- •2. Обязательные требования к технике безопасности при работе студентов в химической лаборатории
- •3. Правила оказания первой медицинской помощи
- •Рекомендации по оформлению отчётов
- •Работа 1. Получение оксида меди (I) из сульфата меди (II)
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Работа 2. Получение дихромата аммония
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Семинар: «Очистка и разделение веществ»
- •Вопросы для подготовки к семинару
- •Тестовые задания для самоконтроля
- •Работа 3. Получение тиосульфата натрия
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Работа 4. Получение йодистого азота
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Работа 5. Получение меди из её солей
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Работа 6. Выделение поташа из золы
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Семинар: «Новые методы синтеза неорганических соединений»
- •Вопросы для подготовки к семинару
- •Задания для самоконтроля знаний
- •Работа 7. Получение сульфата меди (II) из меди
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Работа 8. Получение комплексных соединений меди
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Работа 9. Получение роданида ртути (II)
- •Теоретическая часть
- •Практическая часть
- •Вопросы для самопроверки.
- •Литература Основная:
- •Дополнительная:
- •Малый практикум по неорганическому синтезу
- •607220, Г. Арзамас, Нижегородская обл., ул. К.Маркса, 36
- •607220, Г. Арзамас, Нижегородская обл., ул. К.Маркса, 36
Работа 1. Получение оксида меди (I) из сульфата меди (II)
При подготовке к лабораторной работе необходимо повторить материал об условиях протекания реакций и о скорости реакции. Необходимо знать характерный цвет некоторых веществ и их растворов. Повторить материал об окислительно-восстановительных реакциях.
Теоретическая часть
Оксид меди(I) Cu2O — твёрдое вещество красно-бурого цвета, нерастворимое в воде и органических растворителях. Температура плавления 1235 °C.; плотность 6,1 г/см3. При нагревании до 1800 °C разлагается на металлическую медь и кислород. В природе оксид меди(I) содержится в минерале куприт красно-бурого цвета (крупные кристаллы) или желтый (мелкие кристаллы) Плавится без разложения. Во влажном состоянии медленно окисляется кислородом воздуха. Не реагирует с водой. Разлагается кислотами, щелочами. Переводится в раствор гидратом аммиака, солями аммония. Восстанавливается водородом, монооксидом углерода, активными металлами. Токсичен.
Получение
Прокаливанием металлической меди при недостатке кислорода:
Cu + O2 = 2 Cu2O
Электролизом раствора NaCl с использованием медных электродов при т-ре не выше 70 °С; в лаборатории - при нагревании СuО до 1100°С, восстановлением (глюкозой, гидразином) CuSO4 в щелочном растворе.

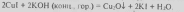

Химические свойства
Растворяется в водном растворе аммиака, образуя бесцветный комплекс [Cu(NH3)2]+, который на воздухе быстро окисляется до [Cu(NH3)4(H2O)2]2+ синего цвета.
Водородом и оксидом углерода(II) легко восстанавливается до металлической меди:
Cu2O + H2 = 2Cu + H2O
Cu2O + CO = 2Cu + CO2
В разбавленой серной кислоте растворяется только в присутствии кислорода. В концентрированной серной кислоте растворяется с выделением диоксида серы SO2. Заметно взаимодействует с КОН и NaOH. Восстанавливается до металла Н2, СО и активными металлами (Mg, Al, Zn). При нагр. окисляется О2 до СuО. С НBr и HI дает соответственно СuBr и CuI. В разбавленной H2SO4 образует Сu и CuSO4, в водных растворах NH3 - аммиакат [Cu(NH3)2]OH.
Изменяет цвет огня при внесении в огонь.
Применение
Применяют оксид меди(I) для окрашивания стекла, эмалей и для борьбы с вредителями в сельском хозяйстве. Оксид меди(I) - полупроводник. Применяют Сu2О как пигмент для стекла, керамики, глазурей, компонент красок, защищающих подводную часть судна от обрастания, в качестве фунгицида.
Практическая часть
Оборудование и реактивы: химические стаканы, плоскодонные колбы, термометр, стеклянная палочка, электрическая плитка, весы с разновесами, воронка, фильтровальная бумага; гидроксид натрия, сульфат меди (II), глюкоза, хлорид бария, соляная кислота, дистиллированная вода.
Ход работы
19 г. медного купороса растворяют в 110 мл. дист. воды. В раствор добавляют 4,8 г. глюкозы, растворенной в 3,5 мл. воды. Полученную смесь фильтруют. Фильтрат нагревают до 73 ºС и быстро при помешивании приливают 50 мл. 20%-ного раствора NaOH. Выпадает оранжевый осадок Cu2O. Смеси дают постоять один час. Раствор над осадком должен быть бесцветным. Осадок промывают горячей водой декантацией (отмыть от иона SO42-). Проба с BaCl2 при присутствии HCl. Осадок промывают и высушивают при комнатной температуре.
Оксид меди (I) можно получить нагреванием (при постепенном повышении температуры) смеси оксида меди (II) с металлической медью, взятых в стехиометрических количествах.
Исходные вещества – восстановленную порошкообразную медь и прокаленный при температуре 400-500 ºС оксид меди (II) – тщательно перемешивают, растирают в фарфоровой ступке, перемещают в фарфоровую лодочку и прокаливают в фарфоровой или кварцевой трубке под вакуумом при температуре 800-900 ºС в течение 4 ч. в трубчатой печи.
