
- •Лекция №1 Роль котлов в промышленной теплоэнергетике.
- •Лекция №2 Энергетическое топливо.
- •Технические характеристики
- •Элементарный состав топлива
- •Влажность топлива
- •Зольность топлива
- •Лекция №3 Изменение зольности топлива. Отрицательное влияние зольности на работу котла:
- •Лекция №4 Приведенные характеристики топлива.
- •Лекция №5 Коэффициент избытка воздуха.
- •Лекция №6 Основы теории горения.
- •Лекция №7 Пути интенсификации сжигания мазута.
- •Лекция №8 Потеря теплоты от химической неполноты сгорания топлива.
- •Организация слоевого сжигания топлива
- •Полумеханические топки
- •Механические топки.
- •Факельно-слоевая топка.
- •Подготовка топлива к сжиганию Организация сжигания твердого топлива.
- •Механизм рассева
- •Лекция №10 Оптимальная тонкость помола.
- •Механическая прочность углей
- •Абразивность твердого топлива
- •Взрываемость угольной пыли
- •Системы пылеприготовления Система пылеприготовления с промежуточным бункером.
- •Пылесистема с прямым вдуванием пыли в топку
- •Шаровая барабанная мельница (шбм)
- •Мельница шаровая среднеходная (мшс)
- •Лекция №11 Молотковая мельница.
- •Пылеугольные горелки.
- •Лекция №12
- •Т опка с твёрдым шлакоудалением.
- •Топка с жидким шлакоудалением.
- •Организация сжигания жидкого топлива.
- •Паровые форсунки.
- •Механические центробежные форсунки.
- •Лекция №13 Комбинированные форсунки.
- •Дисперсионные характеристики.
- •Организация сжигания природного газа.
- •Газомазутные горелки.
- •Газомазутные топки.
- •Основные характеристики паровых котлов.
- •Лекция №14 Схемы водопаровых трактов котла.
- •Типы и типоразмеры паровых котлов.
- •Профили паровых котлов.
- •Компоновка и тепловая схема парового котла.
- •Гидродинамика парового котла.
- •Режимы течения и структура рабочей среды в испарительных поверхностях нагрева.
- •Лекция №15
- •Особенности работы металла труб поверхностей нагрева.
- •Газовая коррозия труб и окалино образование.
- •Марки сталей.
- •Температурный режим работы труб барабанного котла.
- •Лекция №16 Водоподготовка.
- •Виды катионитовых установок:
- •Схемы катионовых установок.
- •Деаэрация воды.
- •Гидродинамика контура естественной циркуляции.
- •Простой контур естественной циркуляции.
- •С ложный контур естественной циркуляции.
- •Надёжность режимов циркуляции.
- •Лекция №17 Полная гидравлическая характеристика к.Е.Ц. И оценка надёжности режимов.
- •Меры борьбы с авариями.
- •Причины парообразования в опускных трубах.
- •Т епловая и гидравлическая неравномерность в поверхностях нагрузки.
- •Влияние способов подвода и отвода рабочей среды на гидравлическую характеристику секции.
- •Избирательный унос солей с паром.
- •Водный режим работы барабанных котлов (организация безнакипного режима).
- •Коррекционный метод обработки котловой воды.
- •Парообразующие поверхности барабанных котлов.
- •Лекция №19 Топочные экраны.
- •Пароперегреватель.
- •Конвективный пароперегреватель.
- •Радиационный пароперегреватель.
- •Ш ирмовый перегреватель.
- •Общая компоновка перегревателя.
- •Факторы, влияющие на tпе.
- •Газовое регулирование tпе.
- •Пуск барабанного котла в работу.
- •Пусковая схема.
- •Последовательность пуска.
- •Плановый останов котла.
- •Компоновка низкотемпературных поверхностей нагрева (эко и взп).
- •Лекция №21 Экономайзер.
- •Водяные экономайзеры.
- •Чугунный ребристый экономайзер.
- •Стальные гладко трубные экономайзеры.
- •Воздухоподогреватель.
- •Трубчатый взп.
- •Регенерационный вращающийся взп.
- •Низкотемпературная коррозия взп.
- •Лекция №22 Переменный режим работы парового котла.
- •Рабочий диапазон нагрузок котла.
Лекция №6 Основы теории горения.
При горение:
Окислительные (прямые) реакции: С + О2 = > СО2 + Q1↑
2Н2 + О2 = > 2Н2О + Q2↑
Восстановительные (обратные) реакции: СО2 = > СО + О–Q3↑
H2O = > OH + OH–Q4↑
Различают горения:
гомогенное (горючие и окислитель в одном агрегатном состоянии);
гетерогенное (горючие и окислитель в разных агрегатных состояниях).
При гомогенном горении скорость реакции пропорциональна концентрации реагирующих веществ WP = kAmBn.
При гетерогенном горении скорость горения пропорциональна концентрации кислорода WP = kO2стенки.
k – константа скорость химической реакции.
k = k0e -E/RT
k0 характеризует максимальное число активных молекул в реакционном объеме
k0 = А![]()
Е – энергия активации, которую необходимо сообщить системе для разрушения старых внутримолекулярных связей и образования активных осколков, дающих
начало новым реакциям.
Q = E1–Е
С + О2 = > СО2 + 140,
![]()
СО + 0, 5О2 = СО + 60,

Е

Е Е1

Е0

τ
Для воспламенения смеси ее необходимо нагреть для , того чтобы увеличить долю активных молекул, т.е. таких у которых энергия больше энергии активации.

При Т = 0 к = 0;
с ростом Т растет и к;
при Т = ∞ к = к0.
Скорость реакции горения зависит:
о
 т
Т
т
Т
от Е

от концентрационных свойств смеси

Температура воспламенения топливной смеси.
Это температура, при которой смесь воспламеняется и начинает устойчиво гореть.
В топке происходит два процесса:
тепловыделение


Теплоотдача от факела к экрану
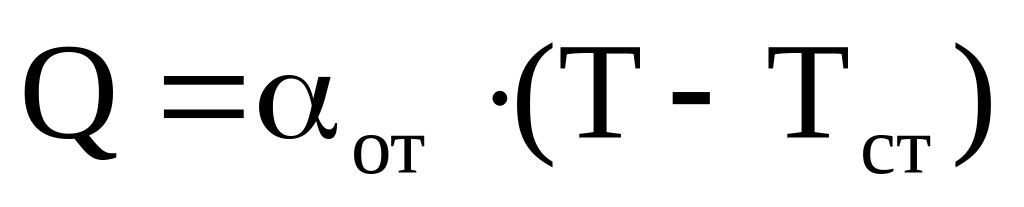 Для
воспламенения необходимо, чтобы Qвыд
> Qот
Для
воспламенения необходимо, чтобы Qвыд
> Qот
Твоспл зависит:
от состава топлива;
от условий расхолаживания топлива.
tвоспл = 225 – 250 – 400 – 900, ºС
Торф БУ КУ Антр
Области горения топлива.
Общее время горения складывается из двух стадий: продолжительность химических реакций и продолжительности физических процессов.
![]()
если продолжительность химических реакций много больше продолжительности физических процессов, то общее время горения равно
продолжительности химических реакций и горение происходит в кинетической области (зависит от температуры).
если продолжительность химических реакций много меньше продолжительности физических процессов, то общее время горения равно
продолжительности физических процессов и горение происходит в диффузионной области (определяется скоростью доставки окислителя).
если продолжительность химических реакций равна продолжительности физических процессов – промежуточная область.
Горение твердого топлива.
![]()
τтепл – время тепловой подготовки топлива. Оно включает в себя нагрев, испарение влаги и выход летучих веществ.
τгор включает в себя горение летучих веществ и горение коксового остатка.

Механизм горения частиц.
Поверхность частицы адсорбирует кислород с образованием комплексов СхОу, которые генерируют СО и СО2.
С + О2 = > СхОу = > mCO
+ nCO2.
+ О2 = > СхОу = > mCO
+ nCO2.
Соотношение СО и СО2 зависит от температуры.
при t = 1200ºС 4С + 3О2 = 2СО + 2СО2 Из области СО2макс часть СО2 возвращается к частице и раскисляется СО2 + С = 2СО При малом расходе СО, О2 полностью не перехватываясь достигает поверхности частицы.
при t = 1700ºС 3С + 2О2 = 2СО + СО2

При высоком расходе СО, О2 расходуется полностью, не достигая поверхности частицы.
Скорость горения твердого топлива.


![]()
gO2 – расход окислителя,
αдиф – константа скорости диффузии.
Скорость реакции горения
![]()
Если решить эти два уравнения относительно О2ст, то получаем скорость горения:
 ,
kГ – константа
горения.
,
kГ – константа
горения.
при низких Т имеет место низкое значение k, значит
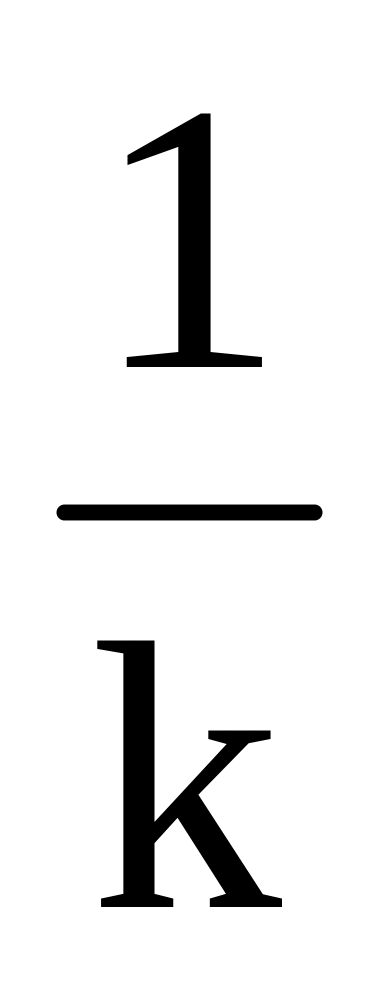 много
больше
много
больше
 ,
поэтому
,
поэтому
 и WГ зависит от Т.
и WГ зависит от Т.при высоких Т имеет место высокое значение k, а значит много больше , поэтому
 и WГ зависит от
скорости подачи окислителя.
αдиф~
и WГ зависит от
скорости подачи окислителя.
αдиф~ ,
где
,
где
 – размер частицы топлива.
– размер частицы топлива.
 область
кинематического горения;
область
кинематического горения;промежуточная область.
область диффузионного горения;
Пути интенсификации горения.
предварительное измельчение;
интенсивное перемешивание в корне факела;
эффективная доставка О2 к горючим в конце факела.
Горение жидкого топлива.
Мазут в факеле сгорает в виде капель при распылении форсунками.
Стадии горения:
нагрев до tкип ;
испарение топлива;
образование топливной смеси;
ее воспарение и сгорание.

капля;
зона диффузии паров;
зона диффузии кислорода;
зона горения;
r0 – начальный радиус капли;
rгор – радиус горения.
rгор = (4–10) r0
Время горения капли определяется временем ее испарения.

при снижении r0, растет удельная наружная поверхность, а значит, растет теплота сгорания и снижается время испарения;
с ростом ТГ, растет
 ,
а значит, растет теплота сгорания и
снижается время испарения;
,
а значит, растет теплота сгорания и
снижается время испарения;с ростом О2п, растет скорость горения, а значит, снижается время испарения.
За счет высокой теплоты сгорания QнР, мазут горит в диффузионной области.
Особенность:
При сжигании мазута имеет место термический крекинг (последовательное отщепление Н2 с образованием частиц сажи).
Недостатки сажеобразования:
неполнота сгорания (0, 1-0, 3%);
загрязнение окружающей среды;
загрязнение поверхностей нагрева (снижается коэффициент теплопередачи k, поэтому снижается Qотд, а значит растет температура уходящих газов и снижается КПД котла).
Для исключения сажеобразования проводят окислительный крекинг при активном внедрении воздуха в корень факела. При этом кислород, разрывая зону горения, проникает в зону диффузии паров для насыщения углеводородов кислородом.
