
- •1. Введение
- •Альберт Эйнштейн, 1935 г.
- •2. Первый закон термодинамики
- •3.Второй закон термодинамики
- •4. Фазовые переходы. Аллотропия
- •5.Водяной пар
- •6. Термодинамика открытых систем. Течение газов
- •7. Дросселирование газов и паров
- •8.Температура адиабатического торможения
- •9. Компрессоры. Детандеры
- •10.Циклы поршневых двигателей внутреннего сгорания (двс)
- •11. Циклы газотурбинных установок и реактивных двигателей
- •12. Циклы паротурбинных установок (пту)
- •13. Циклы холодильных установок
- •14. Цикл теплового насоса
- •1.Стационарные задачи теплопроводности твердых тел
- •2.Нестационарные задачи теплопроводности твердых тел
- •Tаблица 2. Расчетные выражения для составляющих формул (28,29).
- •3. Пути интенсификации теплопередачи
- •4.Конвективный теплообмен
- •5. Теплообмен излучением
- •6.Теплообменные аппараты
- •Раздел II. Лабораторные работы по разделу “Теплопередача” курса “Техническая термодинамика и теплопередача”.
- •Стационарный метод определения коэффициента теплопроводности материалов
- •4. Методические указания по выполнению работы
- •Работа № 2 нестационарный метод исследования тепловых свойств веществ
- •Метод регулярного теплового режима первого рода
- •Определение коэффициента температуропроводности
- •4. Методические указания по выполнению работы
- •Работа № 4 исследование условий теплообмена в термокамере
- •4. Методические указания по выполнению работы
- •5. Порядок выполнения работы
- •Литература
3.Второй закон термодинамики
Второй закон термодинамики состоит из двух независимых закономерностей (частей) , установленных экспериментально.
Первая часть для обратимых процессов - принцип существования энтропии , как функции состояния , ее изменение происходит под действием энергии ,подводимой (отводимой ) в форме теплоты . Математическое выражение принципа существования энтропии
dSоб =dQ/T . …(3.1)
Вторая часть для необратимых процессов – принцип возрастания энтропии .
В необратимом процессе (3.1) становится
dSнеоб = dQ/T + dQr /T , …(3.2)
где dQ – элементарное количество теплоты при внешнем теплообмене , а dQr – обусловленное необратимостью .В необратимом процессе всегда dQr > 0 .
Реальные процессы передачи энергии в форме работы или теплоты от одного тела к другому происходят только если между телами есть перепад давления или температуры. Энергия в форме работы самопроизвольно переходит от тел с большим давлением к телам с меньшим давлением, в форме теплоты – от тел с большей температурой к телам с меньшей температурой . В реальном процессе передачи работы и/или теплоты от среды к телу дополнительно ,по сравнению с обратимым процессом, увеличивается энтропия тела .Часть работы самопроизвольно переходит в теплоту ,а часть потенциально возможной работы при переходе теплоты от тела с температурой T1 к телу с температурой T 2< T1 также превращается в теплоту.
3.1 ОБЩЕЕ ВЫРАЖЕНИЕ ВТОРОГО ЗАКОНА ТЕРМОДИНАМИКИ
При объединении (3.1) и (3.2) и без индексов при dS получается общее выражение второго закона термодинамики
dS ≥dQ/T. …(3.3)
Второй закон термодинамики не противоречит закону сохранения энергии.
3.2. КРУГОВОЙ ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС или ЦИКЛ
Система для непрерывного перевода теплоты в работу путем осуществления кругового процесса , или цикла , называется тепловым двигателем . На рисунке 3.1 , внизу , изображен произвольный круговой процесс a-b-c –d . Для непрерывного перевода теплоты в работу необходимо многократно повторять процесс a –b –c . Возможны две схемы : первая – после расширения a –b –c рабочее тело удаляется , в двигатель вводится новая порция рабочего тела с состоянием точки а и процесс повторяется; вторая – после расширения a –b –c рабочее тело совершает работу l 1= пл. abcc./ a/ и возвращается в исходное состояние (точка a ) путем сжатия в процессе c –d –a с затратой работы (-l2 ) , численно равной пл. cdaa /c/ .
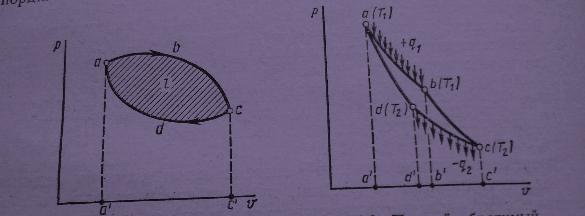
Рис. 3.1. Круговой процесс. Рис. 3.2.Прямой Цикл Карно .
 Если цикл состоит из обратимых
процессов ,то он называется обратимым
циклом. Если цикл осуществляется по
часовой стрелке – его называют прямым
, - это цикл теплового двигателя
(работа l положительна,
т. е. совершается рабочим телом ). Если
цикл осуществляется против часовой
стрелки ,например в направлении a
–d –c –b
–a , его называют обратным
(работа l отрицательна
,т. е. подводится к рабочему телу извне
)-это цикл холодильной установки или
теплового насоса .
Если цикл состоит из обратимых
процессов ,то он называется обратимым
циклом. Если цикл осуществляется по
часовой стрелке – его называют прямым
, - это цикл теплового двигателя
(работа l положительна,
т. е. совершается рабочим телом ). Если
цикл осуществляется против часовой
стрелки ,например в направлении a
–d –c –b
–a , его называют обратным
(работа l отрицательна
,т. е. подводится к рабочему телу извне
)-это цикл холодильной установки или
теплового насоса .
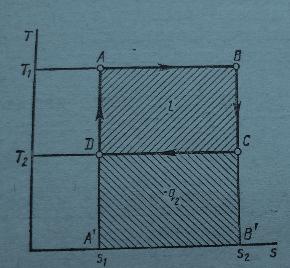
Прямой обратимый цикл Карно. Французский инженер Сади Карно в 1824 Рис.3.3. Прямой обратимый цикл Карно. году в “ Размышлениях о движущей силе огня” предложил цикл идеального теплового двигателя, т. е. цикл, состоящий из обратимых термодинамических процессов (рис. 3.2 . и рис 3.3. ) . Цикл состоит из двух изотерм a –b, (T1) и c –d, (T2) и двух адиабат b –c и d –a .
Термическим к. п. д. цикла называют отношение количества теплоты ,переведенного в работу, ко всему подведенному количеству теплоты
Ƞt = l/q1 =( q1 –q 2)/q 1 = 1 –T2 /T1 . …( 3.4)
Теорема Карно : термический к.п. д. обратимого цикла Карно не зависит от природы рабочего тела. Он определяется только температурами источника тепла Т1 и приемника тепла Т2 . Он в этом интервале температур является наивысшим для любой тепловой машины . Нет источников тепла с Т1= ∞ , нет и приемников тепла с Т2 = 0 ,т. е всегда Ƞt < 1 . Так как ( дηt/дТ1)T2 > ( дηt /дТ2 )Т1 , ( Т2 > Т1), то Т2 влияет больше, чем Т1 ,но оснащать тепловую машину холодильной установкой вряд ли целесообразно . Ниже , в таблице 2 , приведены значения к. п.д. ηt при t2 ≈ 20 0 C и отдельных температур t1 , встречающиеся обычно в практике .
Таблица 2. Значения к.п.д. Ƞt цикла Карно при t2 ≈20 0C и при некоторых температурах t1 .
t1 ,0С |
200 |
400 |
600 |
800 |
1000 |
1200 |
1400 |
1600 |
2000 |
Ƞt |
0.4 |
0.58 |
0.68 |
0.74 |
0.78 |
0.81 |
0.83 |
0.85 |
0.87 |
Из (3.4) следует ,что находя отношение q2 /q1 в изотермических процессах цикла Карно , можно получить отношение температур. Шкала на этой основе и есть термодинамическая шкала , она не связана со свойствами вещества ( лорд В. Томсон –Кельвин ,1848 год ). Надо только одну реперную точку – выбрана тройная точка воды при равновесии трех фаз пар- вода-лед (Т =273К ) ; это выбрано потому, что в стоградусной шкале 0С одна из реперных точек - 00С , ( другая - 1000С ).
Обратный обратимый цикл Карно. Он изображен на рис 3.4 внизу. Для передачи теплоты q2 от тела ,мене нагретого , (охлаждаемые предметы) с температурой Т2 к телу , более нагретому , (окружающая среда ) с температурой Т1путем осуществления обратного цикла Карно необходимо затратить работу l =пл. ABCD.
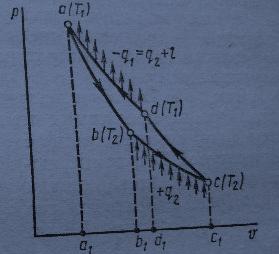
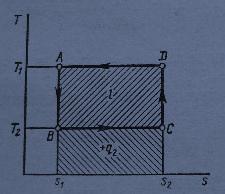
Рис. 3.4.Обратный обратимый цикл Карно.
Для оценки степени совершенства обратного цикла используют холодильный коэффициент
Ԑ = q2/l
=T 2/ (T1
–T2 ).
…(3.5)
В отличие от термического к.п.д. Ƞt, , который всегда меньше единицы , он может быть больше, меньше или равен единице . Отношение коэффициента Ԑ для холодильной машины, работающей на данном агенте, к его значению для обратного цикла Карно характеризует сам агент : аммиак, сернистый ангидрид , фреоны , углеводороды и т. д. ( имеют низкие температуры кипения).
 Регенеративный цикл. Цикл Карно
принят за эталонный , как имеющий
максимальный к.п. д. .
На рис 3.5 представлен цикл А-В-С –D
, отличающийся от цикла Карно А-В-B1-A1
, но имеющим с ним одинаковый к.п.д. в
том же диапазоне температур от Т1
до Т2 Процессы В-С и D-A
осуществляются в регенераторе , например,
толстостенной трубе , где( B-C
)- подвод тепла от газа к стенкам трубы,
а (D-А ) – отвод тепла от
стенок к газу. Принцип регенерации
широко применяется в технике, например
, в паротурбинных установках для
подогрева питательной воды паровых
котлов , в
газотурбинных установках для
подогрева воздуха
перед
подачей в камеру горения и т. п. .
Рис.3.5. Регенеративный цикл.
Регенеративный цикл. Цикл Карно
принят за эталонный , как имеющий
максимальный к.п. д. .
На рис 3.5 представлен цикл А-В-С –D
, отличающийся от цикла Карно А-В-B1-A1
, но имеющим с ним одинаковый к.п.д. в
том же диапазоне температур от Т1
до Т2 Процессы В-С и D-A
осуществляются в регенераторе , например,
толстостенной трубе , где( B-C
)- подвод тепла от газа к стенкам трубы,
а (D-А ) – отвод тепла от
стенок к газу. Принцип регенерации
широко применяется в технике, например
, в паротурбинных установках для
подогрева питательной воды паровых
котлов , в
газотурбинных установках для
подогрева воздуха
перед
подачей в камеру горения и т. п. .
Рис.3.5. Регенеративный цикл.
 3.3. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ
ПРОИЗВОЛЬНЫЕ ЦИКЛЫ
3.3. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ
ПРОИЗВОЛЬНЫЕ ЦИКЛЫ
Энтропия рабочего тела и системы (рабочее тело , источник теплоты и охладитель) при осуществлении , произвольного обратимого цикла равны нулю . В реальных условиях могут осуществляться только необратимые циклы .
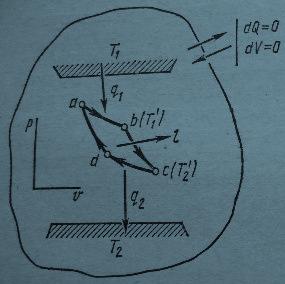
В необратимом цикле Карно теплота q 1 может быть подведена от источника с температурой Т1 к рабочему телу только с температурой Т/ 1 < T1 , а теплота q2 передана от рабочего тела с температурой T/ 2 при условии Т/2 > T2 , что иллюстрировано на рис.3.6, справа. Поэтому термический к. п. д. необратимого цикла меньше , чем обратимого при температурах источника теплоты ( Т1 ) и охладителя ( Т2 ) Рис.3.6.Необратимый цикл Карно.
(Ƞt/ = 1 –T2/ / T /1) < ( Ƞt = 1 – T2 /T1 ). ...(3.6.) Для необратимого цикла Карно Ƞt/ =(1 – q2/q 1)) <(1 –T2 /T1) , т. е. q2 /T2 > q1 /T1.. Теплота q1 отводится от источника , а теплота q2 подводится к охладителю - разные знаки , но (q1 /T1 + q / т2) > 0 , следовательно ,
ds > 0. …(3.7) Это же следует и из примера изолированной системы с тепловым контактом двух тел с температурами Т1 > Т2 соответственно в начальный момент и Т1/< T1 и Т2/ > T2 в текущий момент .
Из (3.7) следует что энтропия системы при осуществлении необратимого цикла возрастает . Но изменение энтропии рабочего тела как в обратимом ,так и в необратимом цикле ( круговом процессе ) равно нулю .
Термический к. п. д. необратимого цикла Карно меньше ,чем для обратимого ,т. е. меньше и доля теплоты ,переведенной в работу. Следовательно , при возрастании энтропии изолированной системы одновременно происходит деградация энергии . В системе необратимые процессы прекратятся при достижении теплового равновесия ,при этом энтропия достигнет максимального значения , а качество энергии станет самым низким ,ее нельзя будет передать в форме работы . Но ВСЕЛЕННАЯ –не изолированная система (солнечная система – одна из ее минимальных частиц) , поэтому предположение Р. Клаузиуса о ее “тепловой смерти” здесь ввиду многих других аспектов (в том числе и понятия о времени, и о том, что за границами) не рассматривается .
3.4. ФОРМУЛИРОВКИ ВТОРОГО ЗАКОНА ТЕРМОДИНАМИКИ
Все формулировки отражают принцип возрастания энтропии и не содержат никаких сведений о принципе ее существования .
Наиболее популярные формулировки классиков :
“ Теплота не может сама собой переходить от холодного тела к горячему” – ( Р. Клаузиус ) ;
Т.е. для перевода теплоты от холодного тела к горячему необходимо осуществить цикл с затратой работы .
“ Теплоту какого-либо тела невозможно превратить в работу ,не производя никакого другого действия , кроме охлаждения этого тела “ - ( В. Томсон ) ;
“Невозможно создать вечный двигатель второго рода (или перпетуум-мобиле второго рода ) “ – ( В. Оствальд ) .
Второй закон термодинамики , таким образом , утверждает ,что невозможно полностью перевести в работу все тепло , сообщенное рабочему телу от источника тепла ,часть этого тепла неминуемо должна быть отдана другому телу с низкой температурой ,вследствие чего эта часть тепла с точки зрения преобразования в механическую энергию оказывается потерянной .
