
- •Питання контрольної роботи
- •До контрольної роботи №2
- •Фармацевтичний факультет
- •1. Основні етапи методу виділення, за яким проводять визначення вмісту сульфатної золи у лікарських препаратах.
- •2. Вказати основні етапи визначення за методом відгонки на прикладі визначення вмісту вологи у коренях валеріани.
- •3. Як можна кількісно визначити магній сульфату у фармацевтичному препараті? Дати коротку характеристику можливих методів.
- •6. Інструментальні методи. Основи полярографічного методу. Дати коротку характеристику.
- •7. Інструментальні методи. На чому базується кондуктометрія? Дати коротку характеристику. Електричної провідності розчинів.
- •8. Інструментальні методи. За допомогою яких приладів вимірюють кут обертання поляризованого світла? Дати коротку характеристику такого методу.
- •9. Інструментальні методи. Закон Бугера — Ламберта — Бера, математичне відображення. За яких умов цей закон виконується?
- •10. Інструментальні методи. Які прилади використовують для роботи у фотоколориметрії? Дати коротку характеристику.
- •11. Способи визначення концентрацій у фотоколориметрії та спектрофотометрії.
- •Спектрофотометрія
6. Інструментальні методи. Основи полярографічного методу. Дати коротку характеристику.
Полярографія є одним з електрохімічних методів аналізу. Назва методу пов'язана з процесами поляризації, які виникають при пропусканні електричного струму через розчини електролітів.
Найчастіше полярографічний метод застосовують для визначення іонів металів, які електролітично відновлюються на ртутному катоді. Звичайно аналіз проводять так.
У досліджуваний розчин уводять два електроди. Один з них, катод, має малу поверхню (найчастіше це ртуть, яка витікає краплями з дуже тонкого капіляра); анодом є шар ртуті з великою поверхнею на дні електролітичної посудини. Електроди з’єднують з джерелом постійного струму і поступово збільшують напругу, фіксуючи зміну сили струму. На відміну від провідників першого роду (наприклад, металів), для яких спостерігається пряма пропорційна залежність сили струму від напруги, ця залежність має нерівномірний характер і виражається кривою з перегинами. Така крива називається «полярографічна хвиля». За параметрами полярографічної хвилі можна визначити якісний та кількісний склад аналізованого розчину. Принцип якісного виявлення іонів у розчині можна розглянути на прикладі виявлення іонів кадмію у розчині. До досліджуваного розчину добавляють хлорид амонію і занурюють у розчин електроди, які з'єднують з джерелом постійного струму. Спочатку до електродів прикладають малу напругу, яку поступово збільшують, безперервно спостерігаючи за силою струму, який проходить через розчин. Результати спостережень записують у вигляді кривої залежності сили струму І від напруги V . Якщо ж у розчині є іони кадмію, то за певної напруги іони кадмію починають розряджатись на катоді, струм починає проходити через розчин. Ця напруга для кожного іона має певне значення і може бути використана для ідентифікації іонів у досліджуваному розчині. Величина цієї напруги залежить також від концентрації іонів металу в розчині, від наявності у розчині інших електролітів, а також від того, чи знаходиться метал, який визначають, у вигляді хлориду, нітрату, аміачного комплексу тощо. Тому якісний полярографічний аналіз можливий тільки в строго визначених умовах.
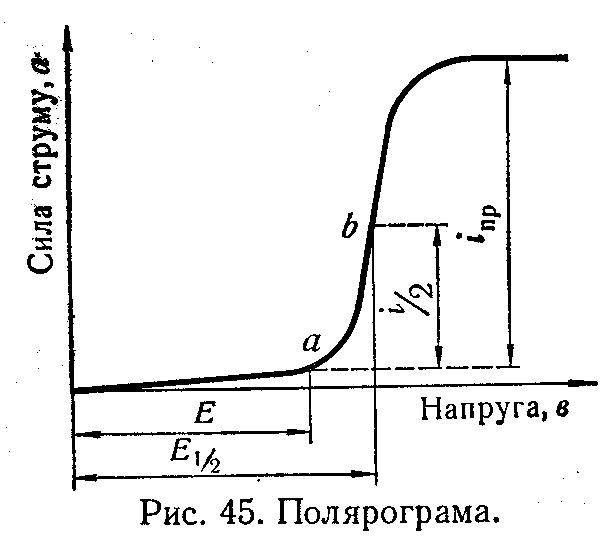
Основні параметри та характеристики полярографічної хвилі.
Для якісного полярографічного аналізу зручно користуватися деякими стандартними величинами потенціалів, які визначалися б тільки природою іонів, що відновлюються, і не залежали б від їх концентрації.
Цій умові відповідає точка, розташована посередині між двома горизонтальними частинами кривої. Відстань на абсцисі від нуля до проекції цієї точки називається потенціалом півхвилі і позначається в полярографії Е1/2. Отже, потенціалом півхвилі називається те його значення, при якому струм зростає до половини граничного значення. При постійному фоні (складі електроліту) і будь-якій концентрації іонів, які відновлюються, потенціал півхвилі залишається незмінним.
Отже для ідентифікації іонів використовують потенціал півхвилі (E1/2)
Кількісний полярографічний аналіз ґрунтується на процесах, які розглянуто для якісного аналізу. У тих самих умовах (сторонні електроліти, температура, розмір капіляра і т. д.) граничний струм прямо пропорційний концентрації іонів, які відновлюються на катоді. Ця залежність і є основою кількісного полярографічного аналізу. Докладніше вона описується рівнянням Ільковича. Залежність сили дифузійного струму від концентрації виражається рівнянням, виведеним Ільковичем:
![]()
де: I ― сила струму, мкА; n - число електронів, які приймає один іон при відновленні на краплинному катоді; D — коефіцієнт дифузії іона, см2∙с-1; m ― маса ртуті (у мг), що витікає з капіляра за 1c; τ — час "життя" 1 краплі ртуті, с; C ― концентрація визначуваного іона, ммоль/л.
Якщо полярографування проводять із одним типом іонів, то для них n і D є постійними величинами. У випадку, якщо працюють із тим самим капіляром і з однією і тією ж швидкістю витікання ртуті, то і добуток
![]()
буде постійною величиною. Тоді рівняння Ільковича приймає такий простий вигляд:
![]()
На практиці використовують:
а) метод градуювального графіка;
б) метод стандартних розчинів;
в) метод добавок.
Метод градуювального графіка. Готують ряд стандартних розчинів з різною точно відомою концентрацією визначуваної речовини. Знімають полярограми цих стандартних розчинів і визначають дифузійний струм (висоту хвиль). За отриманими даними будують градуювальний графік, відкладаючи по осі абсцис величини концентрацій, а по осі ординат відповідні значення дифузійного струму (висоти хвиль). Потім знімають полярограму випробуваного розчину і, користуючись калібрувальним графіком, знаходять концентрацію визначуваної речовини. Метод доцільно застосовувати при аналізі великої кількості однотипних серійних розчинів. Цей метод найбільш точний.
Метод стандартних розчинів. У випадку аналізу окремих проб користуються більш простим методом стандартних розчинів, який полягає в тому, що спочатку полярографують випробуваний розчин, а потім у тих же умовах полярографують 2 – 3 стандартних розчини, що містять визначувану речовину у відомій концентрації. Концентрація стандартних розчинів підбирається з таким розрахунком, щоб отримана висота хвилі була приблизно рівною висоті хвилі невідомого розчину. Зіставляючи висоту хвиль стандартних розчинів з висотою хвилі випробуваного розчину, розраховують концентрацію речовини у випробуваному розчині.
Метод добавок. Спочатку полярографують досліджуваний розчин і вимірюють висоту хвилі h, яка відповідає невідомій концентрації X. Потім до такої ж порції випробуваного розчину додають певну кількість стандартного розчину, внаслідок чого концентрація іона, який визначають, збільшується і стає рівною X + C. Розчин знову полярографують і вимірюють висоту хвилі h1, яка відповідає концентрації X + C. Визначувану концентрацію X знаходять за формулою:
![]()
Для забезпечення більшої точності визначення стандартний розчин додають у такій кількості, щоб висота хвилі виходила приблизно вдвічі більшою від первісної. Метод має особливе значення при аналізі розчинів, для яких невідомо точний вміст присутніх у ньому сторонніх речовин. Відносна помилка полярографічних методів складає 2 – 5%.
