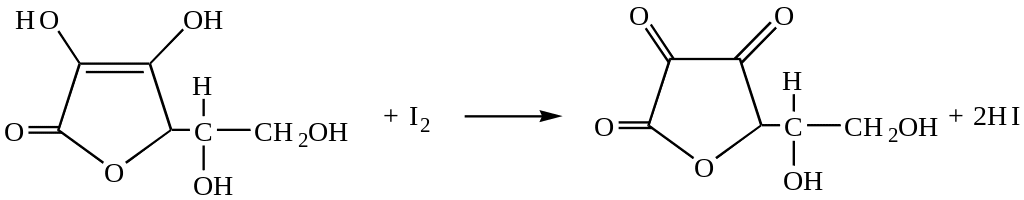- •Питання контрольної роботи
- •До контрольної роботи №2
- •Фармацевтичний факультет
- •2. Перманганатометрія. Дати коротку характеристику. Приклади застосування в аналізі.
- •3. Титранти в йодометрії. Дати коротку характеристику. Навести приклади
- •4. Методи окисно-відновного титрування. Дати коротку характеристику.
- •5. Метод Фольгарда. Дати коротку характеристику. Приклади застосування методу в аналізі.
- •6. Комплексонометрія (трилонометрія). Дати коротку характеристику.
- •8. Потенціометричне титрування. Дати коротку характеристику. Переваги потенціометричного титрування у порівнянні з хімічними методами.
- •9. Інструментальні методи. На чому базується кондуктометрія? Дати коротку характеристику. Електричної провідності розчинів.
- •10. Способи визначення концентрацій у фотоколориметрії та спектрофотометрії
- •Спектрофотометрія
- •Основний закон світлопоглинання
- •Колориметрія та фотоколориметрія
- •12. Тонкошарова хроматографія. Сутність методу, визначення якісного та кількісного складу аналізованої суміші./
3. Титранти в йодометрії. Дати коротку характеристику. Навести приклади
Йодометрія – метод титриметричного аналізу, який використовує окисно-відновні реакції відновників з молекулярним йодом, крім того можна використовувати взаємодію окисників з розчином йодиду калію. Основна реакція методу:
![]() ⇄
⇄![]()
Ця реакція оборотна. У залежності від умов вона може проходити в прямому та у зворотному напрямках. Йод є окисником середньої сили: нормальний окисно-відновний потенціал дорівнює +0,54В. Тому сильні відновники легко окисляються вільним йодом. Прикладом може бути окислення йодом аскорбінової кислоти:
|
|
Аскорбінова кислота |
|
Цю реакцію застосовують для йодометричного визначення аскорбінової кислоти.
Сильні окисники виділяють вільний йод із розчинів йодидів. Так відбувається взаємодія між йодидом калію і дихроматом калію або перманганатом калію, або солями заліза (III) тощо. Реакція між йодидом калію й іонами заліза (III):
![]()
застосовується для визначення заліза.
Отже, йодометрію можна використовувати для визначення як відновників, так і окисників. У першому випадку для титрування застосовують робочий розчин йоду. В другому випадку застосовують робочий розчин тіосульфату натрію, що реагує з йодом за таким рівнянням:
![]()
З
рівнянь видно, що реакції в системі
![]() відбуваються
без участі водневих іонів. Тому
окисно-відновний потенціал системи
не залежить від концентрації водневих
іонів у розчині Йодометричне титрування
можна проводити у широкому інтервалі
рН. Це дає можливість підбирати в кожному
окремому випадку потрібні значення рН
для визначення окисників чи відновників.
відбуваються
без участі водневих іонів. Тому
окисно-відновний потенціал системи
не залежить від концентрації водневих
іонів у розчині Йодометричне титрування
можна проводити у широкому інтервалі
рН. Це дає можливість підбирати в кожному
окремому випадку потрібні значення рН
для визначення окисників чи відновників.
Йодометричний метод можна застосовувати для визначення більшого числа речовин, ніж в інших методах титриметричного аналізу. Ця особливість йодометричного методу обумовлює його широке застосування при аналізі різноманітних речовин. Існують добре розроблені і точні методи йодометричного визначення міді, олова, миш'яку, сурми, сірки, хрому, марганцю, заліза, церію, ванадію і багатьох інших елементів та сполук.
Другою важливою особливістю йодометрії є висока точність визначення точки еквівалентності, що пояснюється наявністю чутливого специфічного індикатора. Індикатором у методі йодометрії є розчин крохмалю, який утворює навіть з найменшими кількостями молекулярного йоду забарвлену в інтенсивно-синій колір адсорбційну сполуку.
4. Методи окисно-відновного титрування. Дати коротку характеристику.
В окисно-відновному титруванні (оксидиметрії) застосовують окисно-відновні реакції. При його проведенні речовина, що титрується, вступає в окисно-відновну реакцію з титрантом. Для кількісного аналізу підходять тільки ті реакції, які:
а) протікають швидко і до кінця (є практично необоротними);
б) утворюють продукти певного складу;
в) не вступають у побічні реакції;
г) дозволяють фіксувати точку еквівалентності.
При титруванні окисників або відновників змінюється окисно-відновний потенціал системи. Характер цієї зміни має велике значення для встановлення точки еквівалентності потенціометричним методом, для правильного вибору потрібного індикатора.
Необхідною умовою придатності реакції є можливість визначення точки еквівалентності. Для цього різниця електродних потенціалів окисника і відновника повинна бути не меншою, ніж 0,4В (якщо беруть індикатор). А при визначенні точки еквівалентності інструментальними методами ця різниця потенціалів повинна бути не меншою, ніж 0,2В. Інакше реакція не проходить до кінця, або при титруванні відсутній відповідний різкий стрибок потенціалу поблизу точки еквівалентності.
Найбільше застосування одержали такі методи окисно-відновного титрування:
- перманганатометричне титрування, титрант – розчин KMnO4;
- йодометричне титрування, титранти – розчини I2 і Na2S2O3;
- броматометричне титрування, титрант – розчин КВrО3;
- дихроматометричне титрування, титрант – розчин К2Сr2О7;
- цериметричне титрування, титрант – розчин Ce(SO4)2.