
- •Предисловие
- •Введение
- •Глава 1 свойства пищевых продуктов как объектов консервирования
- •1.1. Состав и свойства пищевых продуктов
- •1.2. Свойства влаги как основного компонента пищевых продуктов
- •1.3. Формы связи влаги, содержащейся в биологических материалах
- •1.4. Вымороженная вода в пищевых продуктах
1.4. Вымороженная вода в пищевых продуктах
В холодильной технологии принято воду, превратившуюся в процессе замораживания в лед, называть вымороженной.
Фазовое превращение воды в твердое состояние (кристаллообразование) является основным физическим явлением при замораживании биологических материалов, разовый переход начинается при отводе теплоты в момент нарушения переохлаждения. В биологических материалах содержатся различные минеральные и органические вещества, поэтому понижение температуры образца ниже криоскопической температуры сопровождается увеличением концентрации жидкой части раствора. Криоскопическая температура1 tкр (температура начала кристаллизации системы при условии, что переохлаждение отсутствует) зависит от концентрации растворов, молекулярной массы, диссоциации растворенных веществ и свойств растворителя. В простейшем случае — для двухкомпонентного раствора — связь между температурой замерзания и массовой концентрацией изображается диаграммой состояния (рис.1.12). В этом случае предполагается, что переохлаждение, обычно предшествующее замерзанию, отсутствует.
1 Термин «криоскопическая температура»
в словаре МИХ отсутствует, однако
в последнее время большинство
исследователей пользуются этим понятием.
На
наш взгляд, это не случайно, поскольку
криоскопическая температура, являясь
величиной постоянной для данного
продукта, определяется его.
физико-химическими
свойствами и влагосодержанием, а это
удобно для анализа явлений теплообмена
при холодильной обработке пищевых
продуктов. Определение криоскопической
температуры дано в приложении I.
Термин «криоскопическая температура»
в словаре МИХ отсутствует, однако
в последнее время большинство
исследователей пользуются этим понятием.
На
наш взгляд, это не случайно, поскольку
криоскопическая температура, являясь
величиной постоянной для данного
продукта, определяется его.
физико-химическими
свойствами и влагосодержанием, а это
удобно для анализа явлений теплообмена
при холодильной обработке пищевых
продуктов. Определение криоскопической
температуры дано в приложении I.
К онцентрация,
соответствующая эвтектической температуре
tэ,
называется эвтектической
концентрацией Сэ.
Если начальная концентрация
Снач<
Сэ,
то отвод теплоты от раствора сопровождается
понижением
температуры (ab)
вплоть
до значения, соответствующего
данной начальной концентрации. При
температуре, соответствующей
Снач
(точка b),
раствор
замерзает и выделяется твердый
растворитель
(кристаллы льда). Концентрация жидкого
раствора при
этом увеличивается. Этот процесс
происходит до тех пор, пока температура
системы не достигнет tэ,
а
концентрация — Сэ.
При дальнейшем отводе теплоты происходит
изотермический процесс кристаллизации
эвтектической фазы.
онцентрация,
соответствующая эвтектической температуре
tэ,
называется эвтектической
концентрацией Сэ.
Если начальная концентрация
Снач<
Сэ,
то отвод теплоты от раствора сопровождается
понижением
температуры (ab)
вплоть
до значения, соответствующего
данной начальной концентрации. При
температуре, соответствующей
Снач
(точка b),
раствор
замерзает и выделяется твердый
растворитель
(кристаллы льда). Концентрация жидкого
раствора при
этом увеличивается. Этот процесс
происходит до тех пор, пока температура
системы не достигнет tэ,
а
концентрация — Сэ.
При дальнейшем отводе теплоты происходит
изотермический процесс кристаллизации
эвтектической фазы.
Если Снач>Сэ,, то процесс идет подобно описанному выше, только выделяются не кристаллы льда, а кристаллы растворенного вещества.
При замораживании биологических материалов, являющихся сложными многокомпонентными системами, общая закономерность возрастания концентрации сохраняется. Таким образом, замораживание биологических материалов может быть представлено как постоянное понижение tкр и повышение соответствующих концентраций.
При данной температуре доля вымороженной воды
w = Gл/Gw,
где Gл - масса льда при данной температуре; Gw — общая масса воды в исходном материале.
Естественно, что по мере замораживания материала доля вымороженной воды растет.
Наиболее простое, приближенное решение задачи о доле вымороженной воды при любой температуре для разбавленных недиссоциированных растворов
основывается на законе Рауля:
w = 1 – tкр/t, (1.2)
где tкр — криоскопическая температура, °С; t — расчетная температура, °С.
При t = tкр будет w = 0, при t = tэ должно быть w = 1, т. е. при эвтектической температуре вся способная к замерзанию вода должна быть выморожена. Для пищевых продуктов tэ = -65...-55°С.
Формула (1.2) справедлива до t = —30°С, однако даже при более высоких температурах доля вымороженной воды получается завышенной на 8% по сравнению с экспериментальными данными.
Многими исследователями доля вымороженной воды оценивалась экспериментально. При этом использовались калориметрический, дилатометрический или электрометрический методы. На рис. 1.13 и в табл.1.3 даны расчетные данные по доле вымороженной воды в функции температуры w = f (t) для различных пищевых продуктов.
Таблица 1.3
Вид продукта |
Значения w при температуре, °С |
||||
-5 |
-10 |
-15 |
-20 |
-30 |
|
Говядина Треска Яичный белок Зеленый горошек |
0,74 0,76 0,87 0,64 |
0,82 0,85 0,91 0,8 |
0,85 0,87 0,93 0,86 |
0,87 0,89 0,93 0,89 |
0,88 0,9 0,94 0,92 |
А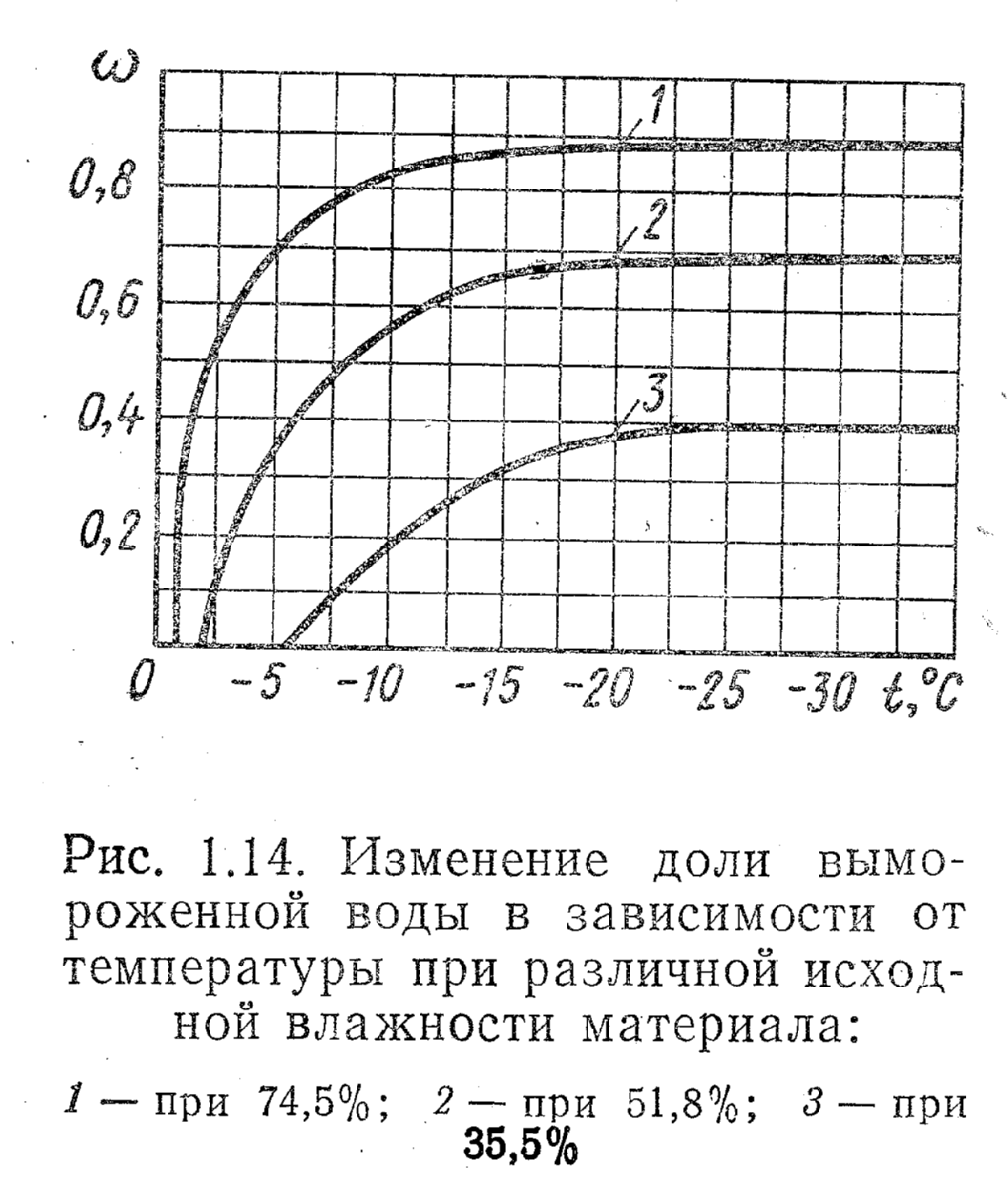 нализ
представленных кривых показывает, что
чем выше криоскопическая
температура материала, тем быстрее идет
вымораживание
влаги на начальном участке изменения
температуры.
нализ
представленных кривых показывает, что
чем выше криоскопическая
температура материала, тем быстрее идет
вымораживание
влаги на начальном участке изменения
температуры.
Исходная влажность материала также влияет на количество вымороженной воды при данной температуре, хотя общий характер кривых w=f(t) остается прежним. Интенсивность льдообразования в начале процесса замораживания сокращается с уменьшением влажности объекта. На рис. 1.14 представлены экспериментальные данные Риделя о количестве вымороженной воды в говядине различной исходной влажности.
Все приведенные рассуждения касались влаги (воды), которая способна замерзать. Однако по данным ряда исследователей, в биологических материалах существует вода, которая не замерзает даже при температуре -120°С и ниже.
Количество незамерзающей воды в биологических материалах незначительно (0,2…0,4 кг на 1кг сухого вещества).
Как уже отмечалось, при сравнении результатов, полученных. по формуле (1.2), с экспериментальными данными Риделя для говядины наблюдается значительное отклонение — завышение на 7...8%. Это отклонение объясняется тем, что при выводе фодмулы не учитывалась связанная вода, находящаяся во влагосодержащих материалах биологического происхождения. Для определения доли вымороженной воды с учетом связанной влаги Д. Г. Рютовым предложена формула:
![]() ,
,
где W — общее содержание воды в продукте (кг на кг продукта); b —содержание связанной воды (кг на кг сухих веществ); tкр—криоскопическая температура материала, °С; t — температура, при которой ведется расчет, °С.
Ниже приведены приближенные данные по количеству связанной воды в некоторых пищевых продуктах.
Вид продукта |
W, кг/кг |
tкр, °С |
t, °С |
Говядина Треска Яичный белок Зеленый горошек |
0,74 0,8 0,86 0,76 |
-0,95 -0,91 -0,45 -1,74 |
0,25 0,27 0,27 0,08 |
Считается, что в продуктах животного происхождения количество связанной воды составляет в среднем b = 0,27 кг/кг сухого вещества, а в продуктах растительного происхождения b = 0,12 кг/кг сухого вещества.
Количество вымороженной воды может быть определено методом электрометрии. Метод основан на измерении электрического сопротивления системы в процессе оттаивания предварительно замороженного материала. Лед — хороший изолятор (удельное электрическое сопротивление льда рл= 10б... 107 Ом·м), в то же время йодные растворы в продуктах хорошо проводят электрический ток. По мере замораживания раствора образующиеся в нем кристаллы препятствуют прохождению тока, и общее сопротивление раствора с понижением температуры резко возрастает. Таким образом, удельное электрическое сопротивление является источником информации о соотношении твердой и жидкой фаз в замороженном образце. По результатам измерения электрического сопротивления можно вычислить количество льда в замороженной единице объема при любой отрицательной температуре.
В основу определения w положено уравнение Оделевского для гетерогенных двухфазных систем:
![]()
где σ — удельная электрическая проводимость системы, (Ом·м) -1;
σ1 — удельная электрическая проводимость среды, (Ом·м) -1;
σ2 — удельная электрическая проводимость включения, (Ом·м) -1;
С — объемная концентрация включений, доли единицы.
Е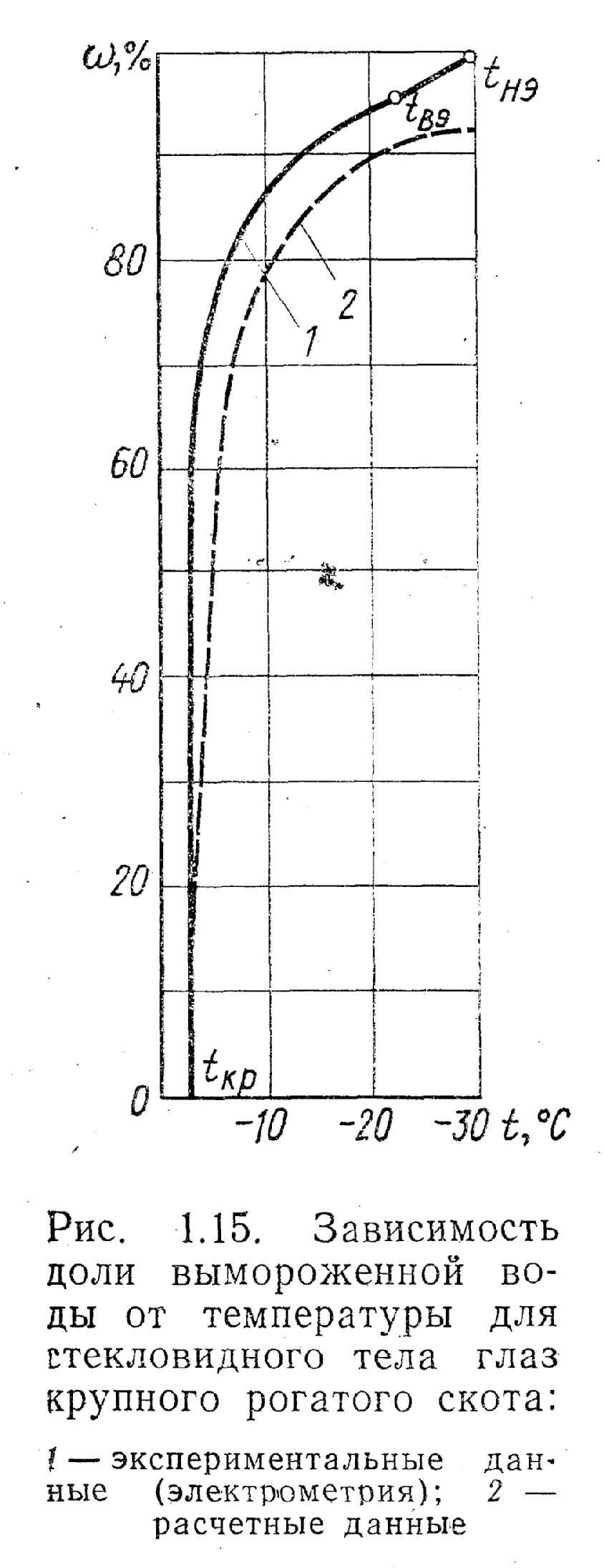
![]() сли
раствор в момент кристаллизации
представить как систему
с ледяными включениями, то на него можно
распространить уравнение
Оделевского. Приняв, что электрическая
проводимость льда мала, считаем σ2=0.
Тогда
уравнение примет вид
сли
раствор в момент кристаллизации
представить как систему
с ледяными включениями, то на него можно
распространить уравнение
Оделевского. Приняв, что электрическая
проводимость льда мала, считаем σ2=0.
Тогда
уравнение примет вид
Заменив в указанном выше уравнении электрическую проводимость удельным электрическим сопротивлением σ =1/ρ и сделав некоторые преобразования, получим
С = w = 2(ρ – ρ1)/(2ρ + ρ1),
где w — относительный объем льда в системе; ρ-удельное электрическое сопротивление замороженной системы; ρ1 — удельное электрическое сопротивление системы до замораживания.
В качестве примера приведем данные по изменению доли вымороженной воды от температуры для стекловидного тела глаза крупного рогатого скота, полученные методом электрометрии (рис. 1.15). На том же рисунке дана зависимость w = f(t), рассчитанная на основании закона Рауля по формуле (1.2). Сравнение расчетных данных с экспериментальными показало, что вблизи криоскопической температуры расхождение незначительно, однако вблизи эвтектической температуры расхождение увеличивается, и это понятно, поскольку вблизи эвтектической температуры концентрация электролитов высокая, а закон Рауля может быть применим и то с определенной степенью допущения только для слабых растворов. Поэтому чем ближе к эвтектической температуре, тем больше концентрации солей, тем больше расхождение.
Таким образом, полученная с помощью электрометрии зависимость w = f(t) может быть использована для обоснования выбора температуры хранения замороженных продуктов.
Следует обратить особое внимание на связь температуры хранения продукта с количеством вымороженной в нем влаги: понижение температуры (см. рис. 1.3) приводит к повышению количества вымороженной влаги, сокращается количество невымороженной влаги, что ведет к сокращению потерь массы.
