
- •Grundtext 4.
- •2 Lies: [pwa'so:] — Пуассон
- •Vorübungen
- •1. Von wem ist hier die Rede (um wen handelt es sich, wessen Name wird genannt)? — Hier ist von Ostwald die Rede usw. 2. Mit welchen
- •Vorübungen
- •Muster I. Es entwickelt sich Äthylen. Beobachten wir dabei starke Schaumbildung? — Ja, Äthylen entwickelt sich unter starker Schaumbildung.
- •Muster II. Man versetzt die Lösung mit 300 ml Methanol. Muß man dabei kräftig rühren? — Ja, man versetzt die Lösung mit 300 ml Methanol unter kräftigem Rühren.
- •Von Quellungsvorgängen.
- •II) Brief
- •3 Lies: flju:is]—Льюис, Гильберт Ньютон
- •4 Lies: ['laerimju:r] —Лёнгмюр, Ирвинг
- •1 Lies: [pur 1э me'rit] — für das Verdienst. Я
- •1 Ibid., s. 263 ff; Голодников г. В., Манделштам т. В. Практикум по органическому синтезу, с. 64 и сл.
- •2 Sieh: Organikum, s. 218.
Von Quellungsvorgängen.
Trägt man die Werte graphisch auf, so erhält man eine Kurve der Quellungsgeschwindigkeit (Abb. 11).
Analog der Formel für die Auflösungsgeschwindigkeit eines festen Stoffes findet man.
Q — Quellungsgrad, M — Quellungsmaximum, R — Materialkonstante, d — Dicke der Schicht.
. Die Methoden zur Messung der Quellung lassen sich einteilen in solche der Längen-, Volumen- und Gewichtsmessung. Hinzu kommen die indirekten Methoden. Einmal kann man die Ander- ung der Länge oder der Dicke des quellenden Körpers messen. Dann kann man die Quellung durch Wägen verfolgen oder das Volumen vor und während der Quellung messen. Die nicht auf genommene Quellflüssigkeit kann man abtrennen und aus der Differenz des ursprünglichen und dieses Volumens die vom Quellkörper aufgenommene Menge bestimmen. Für uns ist die Volumenmethode vorzuziehen. Den quellenden Körper verwenden wir als körniges oder feines Pulver und messen seine Volumenänderung in hohen Meßgeräten (Abb. 12).
TEXT 9. QUELLUNGSMINIMUM DER GELATINE IN IEP
Die Hydratation der Proteine ist abhängig von der Wasser- stoffionenkonzentration oder genauer Wasserstoffionenaktivität der Lösung.
In gleichgroße Reagenzläser geben wir je 0,5 gekörnte Gelatine und fügen je 20 ccm einer Pufferlösung von bekanntem pH
hinzu. Die Gläser werden verschlossen und in eine Vorrichtung eingespannt, welche sie mechanisch langsam umwendet. Nach 1—2 Stunden läßt man absitzen und mißt mit Millimeterpapier oder einem Maßstab den Stand der gequollenen Gelatine und trägt die Werte in Abhängigkeit von der pH-Zahl graphisch auf. Das Minimum der Quellung wird bei etwa 5 gefunden. Genauer wird der Wert erhalten, wenn man zwischen pH 4 und 6 nochmals eine Reihe mit kleineren Abständen bildet. Der genaue Wert liegt bei pH 4,7 (Abb. 13). Hier im isoelektrischen Punkt der Gelatine ist die Ladung des Ampholyten am kleinsten. Die Menge der freien Anionen und Kationen ist gering und demgemäß die Hydratation und Quellung.
Aufgaben
Abb.
13.
Quellung
von Gelatine in Abhängigkeit vom pH. Quellungsminimum im
isoelektrischen Punkt JEP.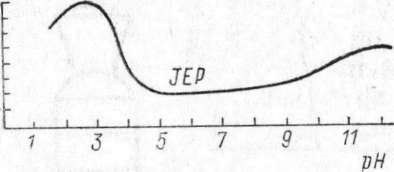
1. Freie Radikale. 2. Erzeugung und Stabilität von Radikalen (Homolyse oder homolytische Spaltung einer homöopolaren Bindung). 3. Dissoziationsenergien. Abhängigkeit der Dissoziationsenergie von der Stabilität der Radikale; Bindungsspaltung durch Wärmeenergie (Thermolyse); Bindunsspaltung durch Strahlungsenergie (Photolyse= Bindungsspaltung durch Einwirkung von sichtbarem oder UV-Licht; Radiolyse=Bindungsspalt- ung durch energiereiche Strahlung); Radikalbildung durch Re- doxprozesse (Ein-Elektronen-Übergang). 4. Reaktionen freier Radikale. Radikalkettenreaktionen (Reaktionen unter Übertragung der Radikaleigenschaften). 5. Reaktivität und Selektivität bei radikalischen Substitutionen.
Aufgabe 4. Beschreiben Sie eine der von Ihnen durchgeführten radikalischen Substitutionen. Den erforderlichen Wortschatz finden Sie im Text 2 und in den Textfragmenten 1—5. Berücksichtigen Sie die folgenden Anhaltspunkte: 1. Bezeichnung der dargestellten Verbindung. 2. Literaturkonstanten und gefundenen Konstanten. 3. Reaktionsgleichung.
Größe des Ansatzes (alle Angaben in Gramm und Mol).
Verwendete Apparatur. 6. Genaue Beschreibung der praktischen Durchführung des Präparats. 7. Ausbeute (wird in Prozent der theoretischen angegeben: % d. Th.) und Ausbeuteberechnung.
Aufgabe 5. Beschreiben Sie die Addition von Brom an Olefine auf Grund des Textes 3. Bilden Sie dabei kurze einfache Sätze (sieh Muster auf S. 12, Übung 1).
Aufgabe 6. Sprechen Sie zum Thema "Der Mechanismus der elektrophilen Addition".1
Aufgabe 7. Beschreiben Sie eine der von Ihnen durchgeführten Additionsreaktionen. Berücksichtigen Sie die in der Aufgabe 4 angegebenen Anhaltspunkte. Aufgabe 8. Beschreiben Sie die Darstellung von Benzophe non auf Grund des Textes 4. Aufgabe 9. Sprechen Sie zum Thema "Elektrophile Substitution an Aromaten". Folgende Gliederungspunkle können als Anhaltspunkte dienen.2
1. Die wichtigsten Reaktionen dieser Art. 2. Mechanismus der elektrophilen aromatischen Substitution. 3. Reaktivität und Selektivität bei der aromatischen Substitution.
Aufgabe 10. Beschreiben Sie eine der von Ihnen durchgeführten elektrophilen aromatischen Substitutionen; berücksichtigen Sie die in der Aufgabe 4 angegebenen Anhaltspunkte. Aufgabe 11. Gestalten Sie ein Gespräch zum Thema "Laborarbeit: Neutralisationsenthalpie" auf Grund des Textes 5 und des Stücks 10 (VH), indem Sie sich auf die folgenden Fragen stützen.
1. Was ist die Neutralisationsenthalpie? 2. Schreiben Sie die Reaktionsgleichung. 3. Welchen Wert hat die Neutralisationsenthalpie bei der Neutralisation starker Basen mit starken Säuren? 4. Ist die Neutralisationsenthalpie von der Natur der reagierenden Stoffe abhängig? 5. Worin besteht das Wesen jeder Neutralisation? 6. Woraus setzt sich der Wert der Neutralisationsenthalpie bei der Neutralisation schwacher Basen mit schwachen Säuren zusammen? 7. Was sollen Sie in Ihrem Versuch bestimmen und berechnen? (formulieren Sie Ihre Aufgaben). 8. Welche Geräte und Reagenzien brauchen Sie für Ihren Versuch? 9. Was geht der Enthalpiebestimmung voraus? 10. Worin besteht die Eichung des Kalorimeters? 11. Wie wird die Wärmekapazität des Kalorimeters ermittelt? 12. Wie wird die Eichung des Kalorimeters durchgeführt? (Beschreiben Sie den Arbeitsablauf ausführlich). 13. Wie wird die Bestimmung der Neutralisationsenthalpie AH für die Neutralisation von Salzsäure mit Natronlauge durchgeführt? (Beschreiben Sie den Arbeitsablauf ausführlich).
Aufgabe 12. Skizzieren Sie an der Tafel kalorimetrische Apparatur und erläutern Sie deren Aufbau auf Grund des Textes 5.
Aufgabe 13. Werten Sie Ihre Versuchsergebnisse an der Tafel graphisch aus und erläutern Sie jeden Ihren Schritt dabei.
a) Ermittlung von AT; b) Ermittlung der Wärmekapazität; c) Ermittlung der Neutralisationsenthalpie.
Aufgabe 14. Beschreiben Sie Ihre Laborarbeit: "Lösungsenthalpie". Berücksichtigen Sie folgende Anhaltspunkte: 1) Aufgaben. 2) Grundlagen des Versuchs. 3) Beschreibung und Handhabung der Apparatur. 4) Arbeitsablauf. 5. Meßprotokoll. 6. Auswertung (Berechnungen, graphische Darstellungen). 7) Diskussion der Ergebnisse
Aufgabe 15. Erläutern Sie die theoretischen Grundlagen der konduktometrischen Titration auf Grund des Textes 6 und des Stücks 11 (VH).
Aufgabe 16. Beschreiben Sie die Ausführung der konduktometrischen Titration anhand des Textes 6.
Aufgabe 17. Zeichnen Sie an die Tafel das konduktometrische Diagramm für die Leitfähigkeitstitration und begründen Sie seinen Verlauf.
Aufgabe 18. Beschreiben Sie die Titration einer schwachen Säure mit einer starken Base. Berücksichtigen Sie folgende Anhaltspunkte:
1) Geräte und Reagenzien. 2) Arbeitsablauf. 3) Meßprotokoll. 4) Auswertung.
Aufgabe 19. Beschreiben Sie eine konduktometrische Titration, die Sie durchgeführt haben.
Aufgabe 20. Skizzieren und erläutern Sie die Meßanordnung für die Bestimmung des Widerstandes einer Elektrolytlösung:
Aufgabe 21. Beantworten Sie die folgenden Fragen:
1. Warum ist zur Messung des Widerstandes eines Elektrolyten ein hochfrequenter Wechselstrom erforderlich? 2. Unter welcher Voraussetzung lassen sich mehrere Säuren nebeneinander konduktometrisch bestimmen? 3. Nehmen Sie eine Einschätzung des zu erwartenden Kurvenverlaufes für die konduktometrischen Titrationen von NaCl-, NaBr- und NaJ-Lösungen mit AgN03 vor.
Aufgabe 22. Beantworten Sie die folgenden Fragen zum Thema "Unregelmäßige Reihen" anhand des Textes 7.
1. Was bedeuten die unregelmäßigen Reihen? 2. An welchen Solen kann man die unregelmäßigen Reihen beobachten? 3. Nennen Sie Sole, an denen man eine solche Beobachtung anstellen kann? 4. Womit flockt man die genannten Sole? 5. Wie verläuft die Flockung? 6. Wie wird beim Versuch verfahren? 7. Was ist die Ursache der unregelmäßigen Reihen? 8: An welchem Versuch könnte man die Umladung der Solteilchen demonstrieren? 9. Was bedeutet die Kataphorese? 10. Sind umgeladene Sole stabil? 11. Lassen sich beliebige Sole umladen? Aufgabe 23. Gestalten Sie ein Gespräch zum Thema "Flockung" auf Grund des Stücks 12 (VH). Es werden möglichst viele Fragen verlangt (sieh Muster auf S. 72, Übung 2). Aufgabe 24. Sprechen Sie zum Thema "Quellung" auf Grund
des Textes 8 und des Stücks 13 (VH). Aufgabe 25. Beschreiben Sie die Bestimmung des Quellungsminimums der Gelatine auf Grund des Textes 9. Aufgabe 26. Sprechen Sie zum Thema "Quellung" nach den folgenden Gliederungspunkten:
1. Begriff "Quellung". 2. Kristalle und Mizellen. 3. Quellung verschieden strukturierter Stoffe. 4. Messung der Quellungsgeschwindigkeit. 5. Quellungsminimum der Gelatine im IEP.
Aufgabe 27. a) Stellen Sie graphisch dar.
1. Geschwindigkeit der Quellung. 2. Quellung der Gelatine in Abhängigkeit vom pH. 3. Abhängigkeit der Proteinform von der Ladung.
b) Erläutern Sie Ihre Darstellungen.
THEMA 3. WISSENSCHAFTLICHER VERKEHR (MÜNDLICHER UND SCHRIFTLICHER)
I) Wissenschaftliche Konferenz Aufgaben
Aufgabe 1. Merken Sie sich die folgenden Ausdrücke, Sätze und Satzfragmente.
Vorsitzender: Gestatten Sie mir, unsere Konferenz zu eröffnen; Ich erkläre unsere Tagung für eröffnet; Unsere Konferenz ist eröffnet; Thema unserer Konferenz ist ...; Unsere Tagung ist dem Thema ... gewidmet; Wir wollen (widmen) unsere Konferenz dem Thema ... widmen; Heute wenden wir uns dem Thema .. zu; Thema des Vprtrages (des Referats) ist ...; Der Vortragende (der Referent) ist ...; Zum' Thema spricht (referiert) ...; Den Vortrag über ... (zum Thema) hält Kollege N.; Das Wort ergreift (hat) ...; Es spricht Kollege N.; Bitte um Ruhe! Bitte ruhig! Die Anwesenden werden gebeten, Fragen zu stellen; Wer hat Fragen zu stellen? Wer möchte fragen? Wer möchte sich an der Diskussion (Aussprache) beteiligen? Wer möchte das Wort ergreifen? Wer möchte seine Meinung zum Problem (zum Vortrag) sagen (äußern)? Wer hat etwas zu sagen? Erlauben Sie mir die Konferenz hiermit zu schließen; Ich erkläre die Konferenz für geschlossen; Die Tagung ist geschlossen.
Diskussionsteilnehmer: Ich bitte ums Wort; Ich möchte einige Bemerkungen sagen (äußern); an den Vortragenden: Bitte wiederholen Sie Ihre These über ...; Erläutern Sie bitte Ihre Feststellung (Behauptung) .. .; Was haben Sie mit Ihrer Behauptung ... gemeint? Darf ich fragen? Glauben Sie, daß ...? Sind Sie der Meinung, daß ...? Ist das Gesagte so aufzufassen, daß ...? Darf ich Ihre Angaben bezweifeln? Ich möchte Zweifel an der Möglichkeit ... äußern; Ich möchte meine Meinung zum Problem (zur diskutierten Frage) sagen. Zu dem, was Sie gesagt haben, sollte man vielleicht noch folgendes bemerken; Erlauben Sie mir bitte eine Bemerkung; Es taucht die Frage auf.
wie ...; Ich möchte das Vorgetragene vervollständigen (einiges ergänzen, hinzufügen); Ich bin mit der Behauptung nicht einverstanden, daß ...; Ich kann der Feststellung nicht zustimmen, daß ...; Ich halte Ihre Schlußfolgerung für unberechtigt, daß .. .; Unsere Meinungen (Gesichtspunkte, Standpunkte) stimmen überein; Ich stimme mit dem Kollegen N. dahingehend überein, daß ...; Wir freuen uns, daß Ihre Resultate so gut mit unseren übereinstimmen; Nach meiner Meinung ist ...; Das trifft nach unserer Überzeugung sicher zu; Es wäre interessant, festzustellen ...; Wäre es nicht interessant, nachzuprüfen ...? Es war ein interessanter Vortrag; Das Referat war sehr interessant (aufschlußreich); Der Vortrag regt zum Denken an; Der Vortrag gibt Anregungen; Ich finde es sehr interessant, daß ...; Es sei hier auf einen Mangel hingewiesen; Als Nachteil wird empfunden, daß ...; Das Problem wurde sehr knapp behandelt; Die Frage ist von Wichtigkeit (von großer Bedeutung, aktuell).
Vortragender: Ich möchte Fragen beantworten; Zur Bemerkung von Kollegen N. möchte ich folgendes sagen; Auf die Frage nach ... möchte ich näher einzugehen; Hierüber ist mir nichts bekannt; Ich erlaube mir den Einwand nicht anzunehmen (abzulehnen); Ich kann der Bemerkung von Kollegen N. nicht zustimmen; Ich bin einer anderen Meinung; Die These wäre meines Erachtens abzulehnen; Ich möchte meine Formulierung präzisieren (verbessern); Ich danke dem Kollegen N. (allen Anwesenden, Teilnehmern) für Aufmerksamkeit (für das aufgebrachte Interesse, das lebhafte Interesse für die angeschnittenen Probleme, für Ihre Bemerkungen, für wertvolle Ergänzungen, für freundliche Kritik); Zu danken habe ich auch allen denjenigen, die . ..; Ich schließe mich vollinhaltlich den Ausführungen des Kollegen N. an, .. .
A u f g a b e 2. Führen Sie die folgenden Aufgaben in der deutschen Sprache aus.
а) 1. Откройте заседание. 2. Объявите тему конференции, доклада, докладчика, выступающего. 3. Попросите у аудитории тишины. 4. Предложите присутствующим: задать вопросы, принять участие в дискуссии, высказать свое мнение по докладу, проблеме. 5. Закройте заседание.
б) 1. Попросите слова. 2. Попросите докладчика повторить формулировку, объяснить тезис. 3. Попросите разрешения задать вопрос, высказать мнение по докладу, критическое замечание, сомнение в правильности утверждения. 4. Выразите: желание дополнить сказанное, несогласие с выводами докладчика, совпадение точек зрения (Вашей и докладчика). 5. Выскажите положительную оценку доклада. 6. Отметьте важность темы. 7. Укажите на недостатки.
в) Выскажите желание ответить на вопросы, уточнить или исправить формулировку, остановиться на вопросе; выскажите
свои соображения по замечаниям. 2. Позвольте себе не согласиться с возражением. 3. Поблагодарите за внимание, полез-| ные замечания, критику.
Aufgabe 3. Veranstalten Sie eine Konferenz zu einem der ■ Themen Ihres Praktikums oder zu einem anderen wissen-i schaftlichen Thema. Verteilen Sie die Rollen des Vorsitzenden, des Vortragenden, des Opponenten und weiterer Diskussionsteilnehmer
