
- •Активность катализатора, промотирование и ингибирование катализатора
- •Энергия активации гомогенных каталитических реакций
- •Обозначения: 1 ; 2 е1; 3 h1; 4 е2
- •Ферментативный катализ
- •Кинетические закономерности односубстратных ферментативных реакций. Вывод уравнения Михаэлиса-Ментен
- •Определение параметров уравнения Михаэлиса-Ментен
- •Ингибирование ферментативных реакций
- •Гетерогенная каталитическая реакция
- •Кинетика гетерогенной реакции, в которой лимитирующей стадией является адсорбция.
- •Теории гетерогенного катализа
- •Взаимодействие реагентов с катализатором и принципы каталитического действия
КАТАЛИЗ
Специфичность, селективность катализа
Катализ-это явление, заключающееся в ускорении химической реакции под влиянием катализатора - вещества, реагирующего на промежуточных стадиях превращения и регенерирующегося в конце реакции. Реакции в присутствии катализатора (Kt) называются каталитическими. Формально катализатор не фигурирует в стехиометрическом уравнении, поскольку выступает как в роли исходного вещества, так и продукта реакции.
Катализ, увеличивающий скорость химической реакции, называется положительным, замедляющий скорость - отрицательным. Отрицательный катализ называется также ингибированием, а катализатор в отрицательном катализе - ингибитором.
Концентрация катализатора может быть очень незначительной, например сернокислая медь заметно ускоряет процесс окисления тиосульфата кислородом воздуха в водном растворе, присутствуя в растворе в количестве 10-13 моль/л. Присутствие катализатора не изменяет коэффициенты активности реагентов так как концентрация катализатора мала и он формально не входит в уравнение равновесия, вследствие этого концентрационная константа равновесия тоже не изменяется., то есть катализатор не смещает химическое равновесие, а лишь способствует его более быстрому достижению. Изменение энергии Гиббса каталитических и некаталитических реакций будет одним и тем же. В процессе каталитической реакции ускоряется (или замедляется, если катализ отрицательный) процесс достижения равновесия, но не обеспечивается получение сверхравновесных концентраций продуктов реакции.
Катализ бывает гомогенным и гетерогенным. В случае гомогенного катализа и катализатор и реагенты образуют одну фазу (пример- гидролиз углеводов в водном растворе в присутствии кислоты). В случае гетерогенного катализа – фазы катализатора и реагентов разные (окисление аммиака на поверхности платины).
Если взять за основу признак, характеризующий механизм каталитического действия, то гомогенный катализ подразделяется:
кислотно-основной, вызываемый кислотами и основаниями
окислительно-восстановительный, вызываемый соединениями металлов переменной валентности
координационный, вызываемый комплексными соединениями;
гомогенный газофазный, вызываемый газами
ферментативный, вызываемый биологическими катализаторами – ферментами.
К каталитическим реакциям относятся самые разнообразные процессы, поэтому не существует единого механизма катализа.
Рассмотрим некоторые общие характеристики катализаторов.
Специфичность катализа заключается в том, что реакции данного типа ускоряются катализаторами лишь определенного химического состава. Специфичность свойственна в той или иной мере всем катализаторам и обусловлена специфичностью химических связей, возникающих между катализатором и реагентом. В образовании химической связи с реагентами участвуют лишь определенные атомы катализатора(их называют каталитическим или активным центром). В гомогенном катализе кислотно-основном, например, каждая молекула, например ион гидроксония, может считаться каталитическим центром. В комплексных соединениях переходных металлов в качестве активных центров может выступать «вакантное место» в координационной сфере комплексного соединения иона металла. Активные центры гетерогенных катализаторов находятся на поверхности твердого тела и представляют собой один или группу атомов, ионов кристаллической решетки.
Селективность – это свойство катализатора ускорять химическое превращение лишь в одном из возможных направления. Так в присутствии оксида алюминия при 700 К происходит увеличением скорости дегидратации этилового спирта, а в присутствии металлической меди – дегидрирования
Селективность катализатора может быть охарактеризована долей реагента, превратившегося в целевой продукт. Селективность зависит от условия проведения и степени завершенности реакции. Селективность – очень важное свойство катализатора, так как повышение селективности позволяет уменьшить количество побочных веществ и снизить количество отходов производства.
Активность катализатора, промотирование и ингибирование катализатора
Активность катализатора очень важная характеристика. Любая каталитическая реакция включает в себя как минимум две стадии:
1. Взаимодействие активного центра с молекулой реагента и образованием промежуточного соединения
2. Распад промежуточного соединения с образованием продуктов реакции и «свободного» активного центра. Последний вновь вступает во взаимодействие с молекулами исходных веществ. Такие циклы могут повторяться неоднократно. Число циклов, совершающихся за единицу времени на одном активном центре, называют числом оборотов катализатора. Мерой каталитической активности является число оборотов катализатора. Для гомогенных катализаторов активность определяется скоростью реакции, разделенной на концентрацию катализатора. Для гетерогенных катализаторов активность характеризуют скоростью реакции, отнесенной к единице поверхности катализатора
Активность катализатора зависит от условий проведения каталитического процесса: от температуры, концентрации реагентов, давления, природы растворителя, если реакция происходит в жидкой фазе.
Промотирование и отравление катализатора. Активность и селективность можно изменить путем модификации катализатора. Например, модификация гетерогенного катализатора достигается путем введения в объем твердого тела или на его поверхность веществ, не обладающих каталитическим действием, но повышающих активность катализаторов. Такие вещества называются промоторами. Введение некоторых веществ в реакционную систему, где находится катализатор, даже в очень малых количествах может привести к снижению или полному прекращению его каталитического действия. Вещества, вызывающие такой эффект называются каталитическими ядами. Соединения мышьяка, ртути, серы – являются каталитическими ядами для многих гомогенных и гетерогенных катализаторов. Некоторые вещества при низкой концентрации в катализаторе работают, как промоторы, а при высокой - как яды, то есть ингибируют (отравляют катализатор).
Энергия активации гомогенных каталитических реакций
Зависимость константы скорости каталитической реакции от температуры описывается уравнением Аррениуса.
Механизмы одной и той же реакции, протекающей без катализатора и в его присутствии, могут существенно отличаться. Это затрудняет сравнение величин энергий активации каталитических и некаталитических реакций. Но если такое сравнение возможно, то энергия активации каталитической реакции ниже, чем некаталитической. Рассмотрим профиль поверхности потенциальной энергии вдоль координаты реакции для двухстадийной каталитической реакции ( рис.2).
Отметим, что энергии активации стадий реакции называют истинными, а найденные по температурной зависимости – эффективными. Так же как и константы скорости.
Воспользуемся
выражением для эффективной константы
скорости реакции![]()
![]() .
.
Прологарифмируем, а затем продифференцируем это выражение по температуре
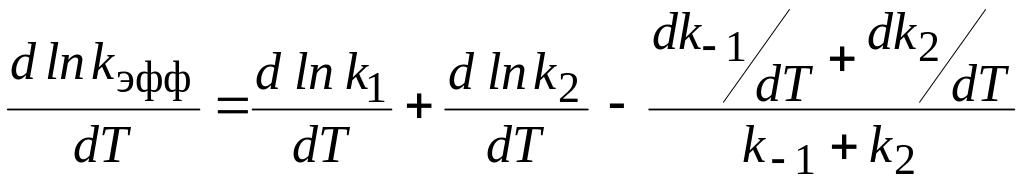
Сравнив полученное уравнение с уравнением Аррениуса, имеем
![]()
Из этого уравнения следуют два важных вывода:
1. Величина
эффективной энергии активации зависит
от соотношения констант. Если
![]() ,
первая стадия лимитирующая
,
первая стадия лимитирующая
![]()
2.
Если
![]() ,
т.е. вторая стадия лимитирующая, в первой
устанавливается равновесие, то
,
т.е. вторая стадия лимитирующая, в первой
устанавливается равновесие, то
![]() , где
, где
![]()
тепловой эффект первой равновесной
стадии.
тепловой эффект первой равновесной
стадии.
Эффективная энергия активации может зависеть от температуры, так как константы скорости k1 , k2 являются функцией температуры.
Снижение
энергии активации реакции хотя и является
определяющей, но не единственной причиной
увеличения скорости реакции в присутствии
катализатора. Увеличение скоростей
некоторых реакций связано с величиной
энтропии активации, которая несет
важную информацию о механизме
каталитической реакции и структуре
активированного комплекса. Большие
отрицательные значения
![]() ( до 120
Дж/(мольК))
характерны для реакций, в которых
активированный комплекс включает
молекулы обоих реагентов и активный
центр катализатора. В таком комплексе
образование новых и разрыв старых
связей в молекулах исходных веществ
происходит одновременно или синхронно.
Для таких реакций наблюдаются низкие
значения энергии активации и говорят
о синхронном механизме реакций. Если
же в реакции образованию активированного
комплекса предшествует разрыв связей
в молекулах исходного вещества, то
энтропия переходного состояния имеет
положительные значения (следовательно
и высокие значение предэкспоненциального
множителя). Тут наблюдается и высокие
значения энергии активации ( хотя они
и ниже, чем в некаталитическом процессе).
Механизм таких реакций называется
диссоциативным.
( до 120
Дж/(мольК))
характерны для реакций, в которых
активированный комплекс включает
молекулы обоих реагентов и активный
центр катализатора. В таком комплексе
образование новых и разрыв старых
связей в молекулах исходных веществ
происходит одновременно или синхронно.
Для таких реакций наблюдаются низкие
значения энергии активации и говорят
о синхронном механизме реакций. Если
же в реакции образованию активированного
комплекса предшествует разрыв связей
в молекулах исходного вещества, то
энтропия переходного состояния имеет
положительные значения (следовательно
и высокие значение предэкспоненциального
множителя). Тут наблюдается и высокие
значения энергии активации ( хотя они
и ниже, чем в некаталитическом процессе).
Механизм таких реакций называется
диссоциативным.
Д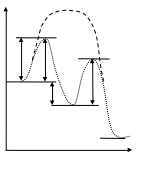
 алее
приведен профиль поверхности потенциальной
энергии вдоль координаты реакции для
каталитической реакции, протекающей
по раздельному механизму.
алее
приведен профиль поверхности потенциальной
энергии вдоль координаты реакции для
каталитической реакции, протекающей
по раздельному механизму.
а) лимитирующая I стадия б) лимитирующая II стадия
