
- •Раздел 6. Химическая кинетика
- •Основные понятия
- •Скорость реакции
- •Кинетический закон действующих масс
- •Кинетические кривые
- •К инетические кривые могут иметь различный вид.
- •Частные случаи реакции второго порядка
- •Методы определения частных порядков реакций
- •Зависимость константы скорости от температуры
- •Методы определения величины энергии активации
- •Кинетика простых реакций в открытых системах
- •Кинетика сложных гомогенных реакций
- •Мономолекулярные обратимые реакции
- •Мономолекулярные параллельные реакции
- •Мономолекулярные последовательные реакции
- •Сопряженные реакции
- •Автокаталитические реакции
- •Стационарное и квазистационарное протекание реакций. Метод квазистационарных концентраций Боденштейна.
- •Теоретические представления химической кинетики
- •Теория активных столкновений
- •Теория активированного комплекса
- •Поверхность потенциальной энергии
- •Константа скорости реакции как функция термодинамических характеристик переходного состояния
- •Стерический фактор. Трансмиссионный коэффициент
- •Фотохимические реакции
- •Полный (общий, интегральный) квантовый выход фотохимчиеского процесса
- •Квантовый выход первичной фотохимической реакции
- •Основные понятия кинетики цепных реакций.
- •Неразветвленные цепные реакции (нцр)
- •Разветвленные цепные реакции (рцр)
- •Анализ модельного уравнения цепных реакций для определения предельных значений числа активных частиц и скоростей реакций
- •Основные понятия кинетики гетерогенных реакций
- •Кинетика гетерогенных процессов, контролируемых адсорбцией
Кинетика сложных гомогенных реакций
При рассмотрении кинетики сложных реакций делается допущение о том, что все элементарные реакции (стадии) , составляющие сложную реакцию, протекают независимо друг от друга. Иначе говоря, максвеллбольцмановское равновесное распределение молекул по скоростям не нарушается, т.е. то нарушение, которое неизбежно привносится в систему при химическом превращении молекул с высокими скоростями (энергиями), очень быстро восстанавливается в процессе хаотического теплового движения молекул.
Задачи, решаемые в формальной кинетике, делятся на прямые и обратные. В прямых задачах по известным значениям кинетических параметров сложной реакции находят уравнения кинетических кривых, в обратных, наоборот, по кинетическим кривым ( опытным) находят кинетические параметры, механизм реакций, порядок стадий, значение констант скоростей.
Рассмотрим формальную кинетику для сложных гомогенных реакций в закрытых системах.
Мономолекулярные обратимые реакции
Двусторонние элементарные реакции первого порядка состоят из прямой и обратной элементарной реакций первого порядка:
![]()
![]()
![]()
К таким реакциям относятся, например, изомерные превращения в различных классах органических соединений.
Приведенную выше реакцию можно записать отдельно по стадиям:
1.
![]()
Константу
скорости этой стадии (называемой прямой
стадией) обозначим
![]() ,
,
2.
![]() с константой скорости, соответственно,
с константой скорости, соответственно,
![]() .
.
Скорость каждой из стадий равна соответственно
![]()
![]()
Скорость двусторонней реакции равна разности скоростей прямой и обратной элементарных реакций:
![]() ,
,
а с другой стороны скорость реакции можно выразит через плотность глубины реакции :
![]()
Решая эти уравнения совместно, получим:
![]()
В результате получаем дифференциальное кинетическое уравнение двусторонней реакции первого порядка.
Преобразуем его:
![]()
При достижении равновесия скорость прямой реакции становится равной скорости обратной реакции , то есть общая скорость равна нулю:
![]()
При
этом плотность глубины реакции
обозначается
![]() .
.
![]()
![]()
Теперь дифференциальное кинетическое уравнение имеет вид
![]()
Оно по форме напоминает дифференциальное уравнение просто реакции первого порядка:
![]()
только вместо одной константы имеем сумму констант скоростей, а вместо начальной концентрации равновесную плотность глубины реакции. Найдем решение этого уравнения :
Разделим
переменные, и, обозначив сумму констант
скоростей прямой и обратной стадий как
![]() ,
получим после интегрирования:
,
получим после интегрирования:
![]()
Сумму констант из этого уравнения можно найти расчетным методом, либо графически, обрабатывая данные по эксперименту следующим образом:
1. Получить кинетическую кривую.

2. Определить графически величину равновесной плотности глубины реакции.
3.Подготовить соответствующие данные и построить график в координатах:

Чтобы найти каждую из констант скоростей реакций по отдельности , выразим, чему равна константа равновесия данной реакции:
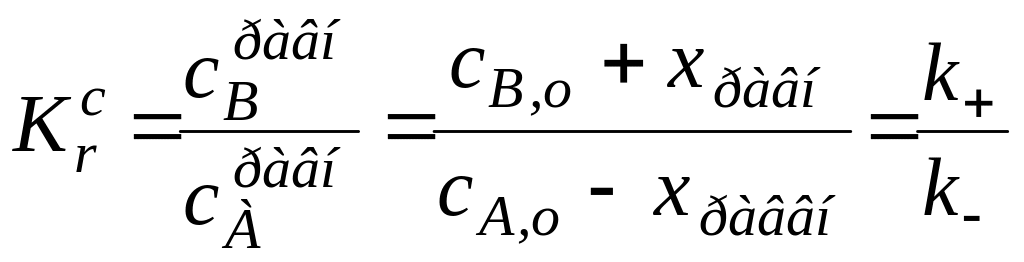
Решая совместно последние два уравнения, получим:
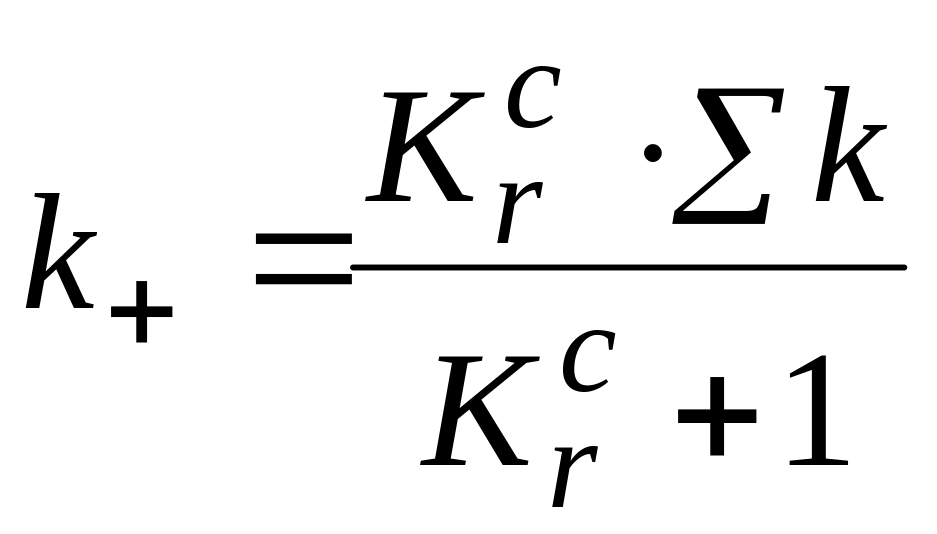
![]()
Таким образом, обратная кинетическая задача решена.
Чтобы
решить прямую задачу кинетики, то есть
получить теоретическое выражение
зависимости концентраций
![]() и
и
![]() от времени, нужно выразить в явном виде
зависимость концентраций
от времени, нужно выразить в явном виде
зависимость концентраций
веществ А и В от времени
Сначала выразим плотность глубины реакции :
![]()
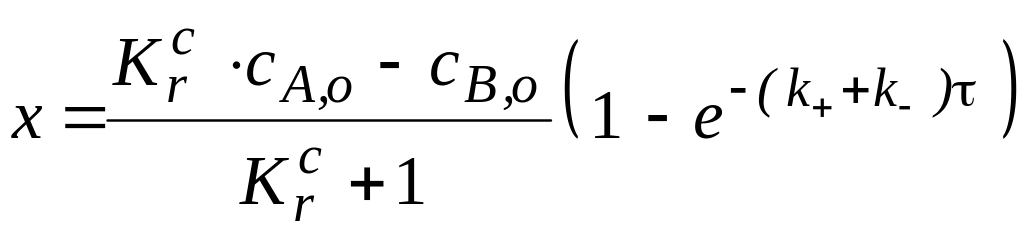
Зная, что в любой момент времени концентрации веществ связаны с начальными концентрациями соотношениями:
![]() и
и
![]()
легко получить желаемые соотношения.
Вывести самостоятельно.
Несколько общих замечаний:
1.Следует отметить, что практически для любой двусторонней реакции существует некоторый начальный промежуток времени, когда величина глубины протекания реакции мала и двустороннюю реакцию можно рассматривать как одностороннюю.
2.Если
скорости прямой и обратной реакций
вообще несопоставимы, например,
![]() ,
то двустороннюю реакцию можно считать
практически односторонней (прямой)
практически во всем интервале времени
протекания реакции. Обычно при этом
наблюдаются большие значения константы
скорости прямой реакции, большие
начальные концентрации вещества А и
большая величина константы равновесия.
,
то двустороннюю реакцию можно считать
практически односторонней (прямой)
практически во всем интервале времени
протекания реакции. Обычно при этом
наблюдаются большие значения константы
скорости прямой реакции, большие
начальные концентрации вещества А и
большая величина константы равновесия.
3. С другой стороны при приближении к концу любой реакции, то есть через бесконечно большое время, все абсолютно реакции становятся обратимыми и скорости прямой и обратной реакции становятся соизмеримыми, то есть можно сказать, что реакция односторонняя только если скорость прямой реакции гораздо больше скорости обратной и кроме того, эта реакция находится далеко от равновесия.
