
- •Раздел 6. Химическая кинетика
- •Основные понятия
- •Скорость реакции
- •Кинетический закон действующих масс
- •Кинетические кривые
- •К инетические кривые могут иметь различный вид.
- •Частные случаи реакции второго порядка
- •Методы определения частных порядков реакций
- •Зависимость константы скорости от температуры
- •Методы определения величины энергии активации
- •Кинетика простых реакций в открытых системах
- •Кинетика сложных гомогенных реакций
- •Мономолекулярные обратимые реакции
- •Мономолекулярные параллельные реакции
- •Мономолекулярные последовательные реакции
- •Сопряженные реакции
- •Автокаталитические реакции
- •Стационарное и квазистационарное протекание реакций. Метод квазистационарных концентраций Боденштейна.
- •Теоретические представления химической кинетики
- •Теория активных столкновений
- •Теория активированного комплекса
- •Поверхность потенциальной энергии
- •Константа скорости реакции как функция термодинамических характеристик переходного состояния
- •Стерический фактор. Трансмиссионный коэффициент
- •Фотохимические реакции
- •Полный (общий, интегральный) квантовый выход фотохимчиеского процесса
- •Квантовый выход первичной фотохимической реакции
- •Основные понятия кинетики цепных реакций.
- •Неразветвленные цепные реакции (нцр)
- •Разветвленные цепные реакции (рцр)
- •Анализ модельного уравнения цепных реакций для определения предельных значений числа активных частиц и скоростей реакций
- •Основные понятия кинетики гетерогенных реакций
- •Кинетика гетерогенных процессов, контролируемых адсорбцией
Кинетика гетерогенных процессов, контролируемых адсорбцией
Часто гетерогенная реакция кроме процессов переноса включает в себя еще и адсорбцию в качестве одной из стадий механизма.
Скорость реакции
в этом случае будет пропорциональна
концентрации адсорбированного
вещества на
поверхности
![]() ,
а не просто концентрации вещества в
поверхностном слое
,
а не просто концентрации вещества в
поверхностном слое
![]() .
.
Поверхностная
концентрация адсорбированного вещества
А
будет пропорциональна доле занятой
поверхности (![]() ) :
) :
![]() .
.
Основной постулат химической кинетики тут звучит не как закон действующих масс, а как закон действующих поверхностей .
Причем, при адсорбции вещества из раствора вместо парциального давления используют объемную концентрацию вещества.
![]() (1)
(1)
Случай 1. Продукт реакции Р не адсорбируется на поверхности
Закон действующих поверхностей
Для реакции первого порядка закон действующих
![]() (2)
(2)
![]() (3)
(3)
где
![]()
доля свободной поверхности
доля свободной поверхности
![]() (4)
(4)
Адсорбционное равновесие
![]() (5)
(5)
Доля занятой
поверхности
![]() (6)
(6)
![]()
![]() (7)
(7)
адсорбционный коэффициент вещества А.
![]() (8)
(8)
![]() (9)
(9)
Проанализируем уравнение (9).
В
области высоких давлений, т.е. если
![]()
![]() (10)
(10)
нулевой порядок реакции по веществу А.
В
области низких давлений, когда
![]()
![]() (11)
(11)
реакция первого порядка.
В области промежуточных значений давлений,
к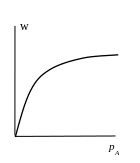 огда
огда
![]() уравнение дробного порядка.
уравнение дробного порядка.
Зависимость
скорости поверхностной реакции
![]() от давления адсорбата
от давления адсорбата
Случай 2. Продукт реакции Р также адсорбируется на поверхности .
![]() (12)
(12)
Если адсорбция А и Р на одних и тех же активных центрах, то
![]() =
=
![]() (13)
(13)
![]() − адсорбционный
коэффициент продукта реакции
− адсорбционный
коэффициент продукта реакции
![]()
![]() (14)
(14)
Если адсорбируется и реагент А и продукт Р, причем адсорбция на разных активных центрах, то
=
![]() (15)
(15)
(16)
Бимолекулярная гетерогенная реакция
с лимитирующей адсорбционной стадией
A + B = P1+P2
Механизм Лэнгмюра-Хиншельвуда
![]()
![]()
![]()
![]()
Скорость реакции
![]()
![]() (1)
(1)
Если при слабой адсорбции продукта оба вещества адсорбируются на одних и тех же активных центрах, то
=
![]() (2)
(2)
![]() =
=
![]() (3)
(3)
![]() (4)
(4)
Если и А и В
адсорбируются слабо,
т.е. парциальные давления невелики, т.е.
![]() и
и
![]() ,
то
,
то
![]() (5)
(5)
Если один газ адсорбируется слабее другого
Например, А адсорбируется сильнее, чем В. Тогда
![]()
![]() (6)
(6)
Реакция имеет первый порядок по В и минус первый по А.
Скорость будет проходить через максимум. Координаты его при постоянном парциальном давлении В
![]()
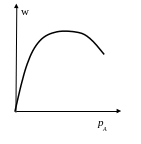
![]() (7)
(7)
Вещества А и В адсорбируются независимо друг от друга
![]()
![]() .
(8)
.
(8)
наличие предельной скорости реакции:
п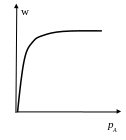 ри
ри
![]() >>1
и
>>1
и
![]() >>1
>>1
(9)
т.е. реакция протекает при полном заполнении поверхности.
Вещество А адсорбируется, вещество В
не адсорбируется
![]()
![]() (10)
(10)
при >>1 (11)
при
<<1
![]() (12)
(12)
Топохимическими реакциями называют гетерогенные реакции, происходящие на границе раздела: твердое исходное вещество – твердый продукт реакции. То есть в топохимических реакциях участвует, по крайней мере, одно твердое исходное вещество и, по крайней мере, один твердый продукт реакции.
В качестве примеров таких процессов можно привести:
CuSO45H2O CuSO43H2O + 2H2O(г);
CaCO3 CaO + CO2(г) ;
FeO + H2(г) Fe + H2O(г).
Специфика этих процессов обусловлена малой подвижностью молекул в твердой фазе, поэтому химическая реакция, возникнув в какой-либо точке реакционного пространства, будет распространяться в соседние области исходного реагента.
Этим обстоятельством определяются особенности топохимических реакций:
для инициирования процесса необходимо образование критического зародыша новой фазы (конечного продукта) на поверхности или в объеме исходной твердой фазы. В данном случае большую роль играют поверхностные и объемные дефекты исходного продукта;
− рост зародышей новой фазы вглубь исходной старой фазы. Можно говорить о формировании границы раздела старой и новой фаз, где локализована химическая реакция. В изотропной среде граница раздела (фронт химической реакции) с постоянной скоростью движется вглубь исходной фазы. Т.е можно постулировать, что скорость топохимической реакции (w) , будет пропорциональна площади границы раздела (s) и скорости движения фронта реакции (wфр);
В случае наличия некоторых исходных реагентов в газообразном состоянии совершенно очевидно, что скорость реакции будет зависеть от парциального давления исходного реагента. Кроме того, нужно учитывать тормозящее действие фазы конечного продукта на доступность газообразного исходного реагента к фронту реакции.
Т опохимическая
реакция начинается обычно с образования
зародышей (ядер) кристаллизации твердого
продукта на поверхности кристалла
исходного вещества.
опохимическая
реакция начинается обычно с образования
зародышей (ядер) кристаллизации твердого
продукта на поверхности кристалла
исходного вещества.
Центры этих ядер часто связаны с наличием на поверхности различного типа дефектов: дислокаций, вакансий (дырок) или ионов в междоузлиях.
Около центров ядер начинается рост самих ядер, обычно сферического типа. По мере их роста увеличивается поверхность раздела фаз и реакция ускоряется. Когда ядра сливаются и образуют общий реакционный фронт, поверхность раздела фаз и скорость реакции становятся максимальной
Затем наступает замедление вследствие перекрывания ядер. Из этого механизма топохимической реакции ясно, что скорость ее определяется как скоростью образования ядер, так и скоростью их роста.
Зависимость скорости реакции от времени проходит через максимум. Наличие индукционного периода обусловлено процессами зародышеобразования. Затухание реакции после прохождения максимума скорости связано с несколькими причинами: выработкой исходного реагента; слиянием зародышей и связанным с этим уменьшением площади границы раздела.
Т акой
вид зависимости можно объяснить следующим
образом: в начальный момент времени
скорость появления ядер и их роста мала.
Затем их поверхность начинает быстро
расти, так что к некоторому времени
скорость становится максимальной,
акой
вид зависимости можно объяснить следующим
образом: в начальный момент времени
скорость появления ядер и их роста мала.
Затем их поверхность начинает быстро
расти, так что к некоторому времени
скорость становится максимальной,
а степень превращения достигает 0,5. После этого из-за отсутствия свободной поверхности, новых ядер не образуется, а перекрывание ядер приводит к уменьшению поверхности раздела
Граница раздела фаз продвигается в объем твердой фазы, и скорость реакции уменьшается.
Поскольку реакция идет на поверхности раздела фаз, теряет смысл понятие концентрации, и скорость топохимической реакции обычно представляют либо как изменение массы реагента либо через изменение степени превращения исходного вещества в единицу времени:
Величина скорости топохимической реакции определяется только величиной (развитостью, топологией) границы раздела. Именно это обстоятельство и определяет название реакций такого типа.
Предложены различные математические модели для описания кинетики таких реакций. Кинетические расчеты топохимических реакций довольно сложны.
Выводы
Наблюдается большое многообразие кинетических уравнений в случае сложных реакций.
Каждый из рассмотренных типов сложных реакций имеет свои характерные особенности с точки зрения кинетики.
