
- •Раздел 6. Химическая кинетика
- •Основные понятия
- •Скорость реакции
- •Кинетический закон действующих масс
- •Кинетические кривые
- •К инетические кривые могут иметь различный вид.
- •Частные случаи реакции второго порядка
- •Методы определения частных порядков реакций
- •Зависимость константы скорости от температуры
- •Методы определения величины энергии активации
- •Кинетика простых реакций в открытых системах
- •Кинетика сложных гомогенных реакций
- •Мономолекулярные обратимые реакции
- •Мономолекулярные параллельные реакции
- •Мономолекулярные последовательные реакции
- •Сопряженные реакции
- •Автокаталитические реакции
- •Стационарное и квазистационарное протекание реакций. Метод квазистационарных концентраций Боденштейна.
- •Теоретические представления химической кинетики
- •Теория активных столкновений
- •Теория активированного комплекса
- •Поверхность потенциальной энергии
- •Константа скорости реакции как функция термодинамических характеристик переходного состояния
- •Стерический фактор. Трансмиссионный коэффициент
- •Фотохимические реакции
- •Полный (общий, интегральный) квантовый выход фотохимчиеского процесса
- •Квантовый выход первичной фотохимической реакции
- •Основные понятия кинетики цепных реакций.
- •Неразветвленные цепные реакции (нцр)
- •Разветвленные цепные реакции (рцр)
- •Анализ модельного уравнения цепных реакций для определения предельных значений числа активных частиц и скоростей реакций
- •Основные понятия кинетики гетерогенных реакций
- •Кинетика гетерогенных процессов, контролируемых адсорбцией
Теория активированного комплекса
Суть этой теории состоит в том, что каждый элементарный акт химического превращения протекает через переходное состояние (активированный комплекс), который характеризуется частичным ослаблением отдельных связей в исходных молекулах и частичным образованием новых связей, характерных для продуктов реакции.
В этой теории анализируется движение ядер по поверхности потенциальной энергии системы реагирующих частиц с использованием либо классических либо квантовомеханических уравнений движения.
Одномерную кривую, характеризующую путь с наименьшей энергией, по которому происходит реакция, называют координатой реакции.
Сечение поверхности потенциальной энергии вдоль этой кривой дает профиль потенциальной энергии для реакции на котором имеется максимум. Все конфигурации ядер, соответствующие малой области вблизи этого максимума, называют активированным комплексом или переходным состоянием.
На большом расстоянии исходных реагентов атомов друг от друга потенциальная энергия системы равна сумме потенциальных энергий изолированных молекул АВ и D. Когда молекулы начинают сближаться электронные орбитали атомов в молекуле АВ начинают взаимодействовать, перекрываться с электронными орбиталями в молекуле D. При этом расстояние между А и В в молекуле АВ начинает увеличиваться, связь между А и В ослабевать, в то время, как связь между В и D, начинает усиливаться. Представим сказанное схемой:
![]()
![]()
![]()
Исходные реагенты активированный комплекс конечные продукты
![]()
В некоторый момент реакции энергия такой конфигурации, такой составной молекулы, называемой активированным комплексом, будет иметь максимальное значение. Пара реагирующих веществ сближена и искажена в такой степени, что малейшее искажение в дальнейшем ведет к образованию продуктов реакции. Эта критическая конфигурация называется также переходным состоянием.
Потенциальная энергия системы зависит от расстояния между атомами (А и В в начале превращения) и В и D в конце превращения и от угла, под которым атом D подходит к лини связи в молекуле АВ.
Поверхность потенциальной энергии
Эйринг и Поляни, используя законы квантовой механики построили поверхность потенциальной энергии для приведенной выше реакции .

![]()
Е
E

RBD
RAB
На рисунке жирная линия – это и есть координата реакции. Если изобразить величину потенциальной энергии как функцию координаты реакции, то она будет иметь следующий профиль
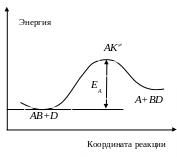
Для расчета констант скорости в ТАК используют следующие допущения:
молекулярная система движущаяся по поверхности потенциальной энергии в направлении продуктов реакции и достигшая вершины барьера, неизбежно превращается в продукты реакции.
элементарная реакция происходит адиабатически т.е. без перехода на другую поверхность потенциальной энергии
элементарную реакцию представляют как мономолекулярный распад активированного комплекса по схеме
реагенты ⇄ активир.комплекс продукты
Основной постулат ТАК : между реагентами и АК существует равновесие.
Основное уравнение ТАК – уравнение Эйринга:
![]()
![]()
постоянная
Больцмана, 1,381023
Дж/К;
постоянная
Больцмана, 1,381023
Дж/К;
![]()
постоянная Планка
=6,621034
Джс.
постоянная Планка
=6,621034
Джс.
![]()
константа равновесия
для реакции образования активированного
комплекса из исходных реагентов,
выраженная через молярные концентрации.
Знак
константа равновесия
для реакции образования активированного
комплекса из исходных реагентов,
выраженная через молярные концентрации.
Знак
![]() это символ активированного комплекса.
это символ активированного комплекса.
