
- •Раздел 6. Химическая кинетика
- •Основные понятия
- •Скорость реакции
- •Кинетический закон действующих масс
- •Кинетические кривые
- •К инетические кривые могут иметь различный вид.
- •Частные случаи реакции второго порядка
- •Методы определения частных порядков реакций
- •Зависимость константы скорости от температуры
- •Методы определения величины энергии активации
- •Кинетика простых реакций в открытых системах
- •Кинетика сложных гомогенных реакций
- •Мономолекулярные обратимые реакции
- •Мономолекулярные параллельные реакции
- •Мономолекулярные последовательные реакции
- •Сопряженные реакции
- •Автокаталитические реакции
- •Стационарное и квазистационарное протекание реакций. Метод квазистационарных концентраций Боденштейна.
- •Теоретические представления химической кинетики
- •Теория активных столкновений
- •Теория активированного комплекса
- •Поверхность потенциальной энергии
- •Константа скорости реакции как функция термодинамических характеристик переходного состояния
- •Стерический фактор. Трансмиссионный коэффициент
- •Фотохимические реакции
- •Полный (общий, интегральный) квантовый выход фотохимчиеского процесса
- •Квантовый выход первичной фотохимической реакции
- •Основные понятия кинетики цепных реакций.
- •Неразветвленные цепные реакции (нцр)
- •Разветвленные цепные реакции (рцр)
- •Анализ модельного уравнения цепных реакций для определения предельных значений числа активных частиц и скоростей реакций
- •Основные понятия кинетики гетерогенных реакций
- •Кинетика гетерогенных процессов, контролируемых адсорбцией
Теоретические представления химической кинетики
Основная задача теорий химической кинетики предложить способ расчета константы скорости элементарной реакции и ее зависимости от температуры, используя различные модельные представления о строении реагентов и пути реакции.
Рассмотрим два простейших теоретических подхода к трактовке элементарного акта химического превращения:
- теория активных столкновений (разработанная Алексеевым и Хиншельвудом) для бимолекулярных газовых реакций и основанная на молекулярно-кинетической теории газов
- теория активированного комплекса, разработанная на основе достижений квантовой химии и статистической термодинамики Эйрингом и Поляни.
Теория активных столкновений
В этой теории скорость бимолекулярной реакции связывают с числом столкновений реагирующих частиц в единице времени в единице объема.
Столкновения приводят к реакции если:
1. поступательная энергия относительного движения частиц превышает энергию активации
2. частицы правильно ориентированы в пространстве относительно друг друга.
Выражение для константы скорости бимолекулярной реакции по ТАС имеет вид:
![]()
Это уравнение ТраутцаЛьюиса.
В этом уравнении:
Р – стерический множитель, учитывающий необходимость правильной ориентации частиц в момент столкновения;
![]()
постоянная Авогадро;
постоянная Авогадро;
![]()
частота столкновений,
определяемая формулой
частота столкновений,
определяемая формулой
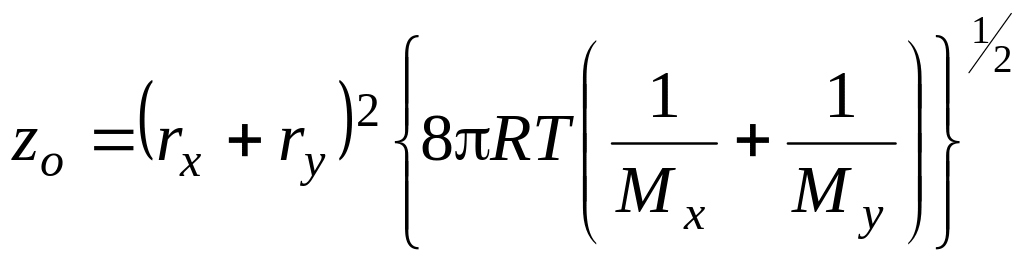
Это вероятность
столкновения двух заданных частиц ,
радиусами
![]() ,
мольными массами
,
мольными массами
![]() в единицу времени в единице объема.
в единицу времени в единице объема.
Величина
![]() называется сечением столкновения.
называется сечением столкновения.
Множитель
![]() представляет собой вероятность того,
что при столкновении энергия относительного
поступательного движения частиц
превысит энергию активации.
представляет собой вероятность того,
что при столкновении энергия относительного
поступательного движения частиц
превысит энергию активации.
В теории активных столкновений можно рассчитать величину предэкспоненциального множителя в уравнении Аррениуса. При этом скорость реакции считают равной числу соударений (можно вычислить физическими методами) и используют экспериментально определенную энергию активации.
Для многих реакций наблюдается хорошее совпадение скорости реакции рассчитанной по ТАС (с использованием экспериментальной энергии активации) с экспериментально определенной.
Но в реакциях, протекающих в растворах, ( даже для мономолекулярных реакций) между расчетными и экспериментальными величинами имеются большие расхождения. Чтобы привести теорию и эксперимент в соответствие вводят искусственно так называемый стерический фактор (или стерический множитель или фактор вероятности), который учитывает ориентацию молекул в пространстве в момент столкновения по отношению друг к другу. Стерический фактор определяется временем сближения молекул, полярностью связей внутри молекул и наличием нескомпенсированных электрических зарядов. Стерический фактор, как показано в теории активированного комплекса зависит от энтропии активации. С ростом энтропии активации увеличивается стерический фактор, а следовательно и вероятность образования активированного комплекса.
![]() Р
стерический фактор
Р
стерический фактор
Причем для мономолекулярных реакций его величина равна 105, а для бимолекулярных 103 – 106, то есть наблюдается очень большое различие в значениях.
Из предыдущих формул видно, то температурная зависимость константы скорости имеет вид:
![]()
![]() Согласно ТАС
предэкспоненциальный множитель слабо
зависит от температуры. Опытная или
аррениусовская энергия активации,
определяемая по уравнению
Согласно ТАС
предэкспоненциальный множитель слабо
зависит от температуры. Опытная или
аррениусовская энергия активации,
определяемая по уравнению
![]()
она связана с истинной энергией активации следующей формулой
![]()
