
- •Раздел 6. Химическая кинетика
- •Основные понятия
- •Скорость реакции
- •Кинетический закон действующих масс
- •Кинетические кривые
- •К инетические кривые могут иметь различный вид.
- •Частные случаи реакции второго порядка
- •Методы определения частных порядков реакций
- •Зависимость константы скорости от температуры
- •Методы определения величины энергии активации
- •Кинетика простых реакций в открытых системах
- •Кинетика сложных гомогенных реакций
- •Мономолекулярные обратимые реакции
- •Мономолекулярные параллельные реакции
- •Мономолекулярные последовательные реакции
- •Сопряженные реакции
- •Автокаталитические реакции
- •Стационарное и квазистационарное протекание реакций. Метод квазистационарных концентраций Боденштейна.
- •Теоретические представления химической кинетики
- •Теория активных столкновений
- •Теория активированного комплекса
- •Поверхность потенциальной энергии
- •Константа скорости реакции как функция термодинамических характеристик переходного состояния
- •Стерический фактор. Трансмиссионный коэффициент
- •Фотохимические реакции
- •Полный (общий, интегральный) квантовый выход фотохимчиеского процесса
- •Квантовый выход первичной фотохимической реакции
- •Основные понятия кинетики цепных реакций.
- •Неразветвленные цепные реакции (нцр)
- •Разветвленные цепные реакции (рцр)
- •Анализ модельного уравнения цепных реакций для определения предельных значений числа активных частиц и скоростей реакций
- •Основные понятия кинетики гетерогенных реакций
- •Кинетика гетерогенных процессов, контролируемых адсорбцией
Автокаталитические реакции
Реакция называется автокаталитической, если она ускоряется одним из продуктов реакции. Примером автокатализа является окисление щавелевой кислоты перманганатом. Тут катализирующим действием обладает продукт реакции ион двухвалентного марганца. Первой стадией реакции является взаимодействие перманганат-иона с ионом марганца (2+):
![]()
Эта стадия протекает медленно, то есть является лимитирующей.
Далее трехвалентный ион марганца реагирует с щавелевой кислотой с образованием двуокиси углерода и иона двухвалентного марганца:
![]()
Эта реакция протекает быстро.
В общем виде механизм автокаталитической реакции можно представить схемой:
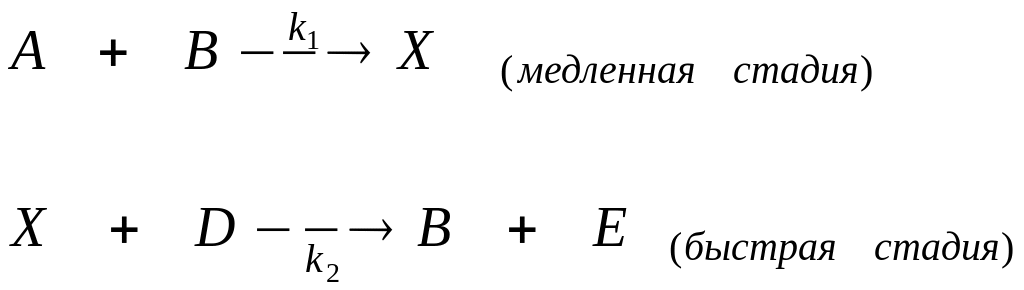
Так как скорость реакции определяется первой лимитирующей стадией, то можно записать, что общая скорость равна:
![]()
Р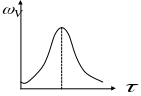 еакция
начинается с очень низкой скоростью,
но по мере накопления B
скорость реакции возрастает и достигает
максимума. Достигнув максимума скорость
реакции уменьшается за счет снижения
концентрации реагента А.
еакция
начинается с очень низкой скоростью,
но по мере накопления B
скорость реакции возрастает и достигает
максимума. Достигнув максимума скорость
реакции уменьшается за счет снижения
концентрации реагента А.
Одной из общих характеристик таких реакций, протекающих в закрытых системах является наличие максимума на кривой зависимости скорости реакции от времени и наличие индукционного периода.
Зависимость скорости автокаталитической реакции от времени
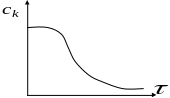
Зависимость концентрации исходного вещества от времени
Период времени, когда реакция не протекает, называется периодом индукции. Автокаталитические реакции рассматриваются не в разделе катализа, так как тут нарушается одно из основных признаков катализа - постоянство концентрации катализатора, ее неизменность к концу каталитического акта.
В присутствии некоторых веществ скорость реакции может не возрастать, а напротив,уменьшаеться. Такое явление получило название ингибирования, а вещества, замедляющие скорость реакции называются ингибиторами. Сущность явления ингибирования состоит в том, что игибитор вступает в химическое взаимодействие в реагентом или чаще вс промежуточными веществами с образованием устоячивых соединений, облажающих низкой реакционной способностью. Например, ингибиторы применяются для снижения деструкции полимерных материалов, протекающих под действием теплоты и УФ-излучения.
Рассмотрим в общем виде два случая:
1. когда вещество, являющееся продуктом реакции находится в следовых количествах изначально в системе:
2. когда этого вещества в начале нет, но оно постепенно накапливается в системе.
Первому случаю соответствует схема:
A B
Причем
![]() .
Это так называемый «метод затравки»,
так как количество продукта очень мало
:
.
Это так называемый «метод затравки»,
так как количество продукта очень мало
:
![]() .
.
Дифференциальное кинетическое уравнение будет иметь вид:
![]()
Второму случаю соответствует схема
![]() ,
,
Т.е. одна стадия является каталитической ( константа скорости ее k), а вторая некаталитической ( с константой скорости ko), причем очевидно, что ko<< k .
Кинетика каталитической реакции описывается уравнением
![]()
Некаталитической
стадии:
![]() .
.
Дифференциальное кинетическое уравнение всего процесса в этом случае будет иметь вид:
![]()
![]()
Или после преобразования
![]() .
.
Очевидно,
что
![]() .
.
Сравнивая
конечные дифференциальные уравнения
в обоих случаях приходим к выводу, что
они идентичны, причем и
![]() (затравка) и
(затравка) и
![]()
очень маленькие величины.
очень маленькие величины.
