- •Теоретичні основи процесу
- •Характеристика цільового продукту
- •1.2 Основні фізико-хімичні властивості карбаміду
- •1.3.Розчинність карбаміда
- •1.4. Розкладання карбаміду
- •1.5 Гігроскопічність і злежуванність карбаміду
- •1.6 Сфери застосування
- •1.6.1 Карбамід в сільському господарстві
- •1.6.2 Карбамід в промисловості
- •3.Опис загальної технологічної схеми процесу
- •3.1Синтез
- •2.2 Рецикл
- •2.3 Випарювання
- •2.4 Абсорбция
- •2.5 Десорбція и гідроліз
- •3.Індивідуальне завдання. Відділення випарки
- •3.1.Теоретичні основи
- •3.2. Опис стадії процесу і технологічної схеми
- •Висновок
- •Список літератури
3.Опис загальної технологічної схеми процесу
Технолоічний процес отримання карбаміда складається із слідуючих основних стадій:
- синтеза,
- рецикла,
- випарювання, грануляції,
- абсорбції, десорбції та гідроліза

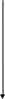


-
CO(NH2)
А

 бсорб
ція
бсорб
ція

конденсація
Десорбція

1
1400С,
98%
98 |
|
||||||||||
|
|
57% СО2 |
Рецикл 3 атм. |
|
NH3,CO2, конденсація |
|
В ипарка |
|
|||
145 атм. CO2 |
|
|
|||||||||
Мочевина 70%, ВАС вода
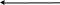


Рис.1. Загальна технологічна схема виробництва карбаміду

3.1Синтез
В умовах синтезу протікають процеси утворення карбамата амонія, карбаміда, розкладання карбамата амонія, відгонки надлишкового аміаку, а також утворення вуглеамонійних солей (ВАС).
Процес утворення карбамата амонія відбувається в результаті взаємодії СО2 і NH3 по реакції:
СО2 + 2NH3 = NH2-CO-О-NH4+159 кДж/моль
Реакція протікає в конденсаторі високого тиску (ВТ) при тиску в системі синтезу від 13,4 до 14,4 МПа и при температурі від 165 до 175 °С. Тепло, що виділяється при реакциії утворення карбамата амонія, використовується для отримання пару тиском від 0,32 до 0,46 МПа.
Процес утворення карбаміда із карбамата амонія протікає в колоні синтеза при температурі в верхній частині колони від 180 до 185 °С і тиску від 13,4 до 14,4 МПа, мольному співвідношенні в рідинній фазі NH3 : СО2 від 2,8 до 2,9 : 1 та часу протікання реакції 60 хвилин. При цих умовах протікає реакція дегідратації карбамата амонія.
NH2-CO-О-NH4 = CO(NH2)2 + Н2О - 28 кДж/моль
Реакція ендотермічна, необхідне тепло для протікання реакції створюєтся за рахунок процесу утворення карбамата амонія в колонні синтеза, при цьому в реакцію з надлишковим аміаком вступає двуокись вуглевода, що непрореагувала в конденсаторі ВТ. Ступінь конверсії СО2 в карбамід для данних умов процесу складає от 54 до 57%.
Розкладання карбамату і відгонка надлишкового аміаку відбувається в трубному просторі стріппера (стріппинг процес в потоці СО2) при тиску синтеза в умовах постійного контактування карбамідо-карбаматного розчину з двуокисю вуглевода. При цьому карбамідо-карбаматний розчин у
вигляді плівки стікає по трубкам стріппера вниз, назуcтріч противотоком подається двуокись вуглевода:
NH2-CO-О-NH4 = CО2+ NH3 - G
Температура карбамідо-карбаматного розчину унаслідок ендотермічності процесу і відносно низької температури СО2 знижається від (180 - 183) °С до (165 - 175) °С.
Необхідне тепло для протікання реакції розкладання створюється за рахунок конденсації насищенного водяного пару ВТ від 1,6 до 2,1 МПа в міжтрубному просторі стріппера.
Виделений при розкладанні карбамата амонія газоподібні аміак, двуокись вуглевода, пари води і інерти виходять потоком СО2 і направляються в конденсатор ВТ.
Реакційона суміш з масовою долею карбаміда 54,4 % після стріппера направляється у вузел рецикла для кінцевого розкладання карбамата амонія і відгонки надлишкового аміаку.
Із непрореагувавших в колоні синтеза газоподібного аміаку, двуокисі вуглевода і парів води при тиску синтеза і температури в скруббері ВТ від 160 до 165 °С утворюються вуглеамонійні солі (ВАС), при цьому протікають реакції:
NH3 + Н2О = NH4ОH + G
2NH4ОH + СО2 = (NH4)2СО3 + Н2О + G
NH4ОH + СО2 = NH4HCО3 + G
Реакції
екзотермічні,
тепло утворення
ВАС
постійно
відводиться
циркулюючим
конденсатом в холодильнику
.



 Синтез
140атм,1850С
Синтез
140атм,1850С