
- •Розділ 1. Характеристика вірусоподібних біополімерів та вірусів
- •Термінологія
- •1.3. Гіпотези походження і еволюція вірусів
- •1.4. Історичний нарис
- •1.5. Біополімери – збудники захворювань еукаріотичних організмів
- •Класифікація
- •Властивості
- •Патогенез
- •Дослідження пріонів дріжджів та інших міксоміцетів
- •1.7. Віруси
- •1.7.1. Характерні ознаки вірусів
- •1.7.2. Геометрична структура вірусів
- •1.7.3. Структура вірусного геному
- •1.7.4. Вірусні білки
- •1.7.5. Генетика вірусів та взаємодія вірусних геномів
- •Джерела формуванняя і поповнення генофонду вірусних популяцій
- •1.7.6. Репродукція вірусів
- •1.7.7. Стійкість вірусів поза клітиною
- •1.7.8. Особливості вірусних інфекцій
- •Тіпи вірусних інфекцій
- •1.7.9. Шляхи проникнення вірусу в організм людини і інших хребетних тварин
- •1.7. 10. Шляхи проникнення вірусу в рослини
- •1.7.11. Відношення комах до вірусів
- •1.7.12. Вірусні інфекції гідробіонтів
- •1.7.13. Загальні методи вивчення вірусів
- •1.7.14. Дія вірусів на інфіковану клітину
- •1.7.15. Ендогенні віруси
- •1.7.16. Мімівірус - недостаюча ланка між вірусами і бактеріями або принципово нова форма життя?
- •1.7.17. Номенклатура і класифікація вирусів
- •Ictv класифікація (1995)
- •Розподіл вірусів по родинах за класифікацією Балтімора
- •2. Система імунітету людини та її вплив на перебіг вірусної інфекції
- •2.1. Імунна система та її реакція на вірусну інфекцію
- •Механізми захисту організму ссавців від ураження вірусами
- •2.2. Теоретичні аспекти активної імунізації
- •2.3. Характеристика вакцинальних препаратів
- •2.4. Пасивна імунізація
- •2.5. Механизми захисту вірусів від імунної відповіді
- •2.6. Молекулярні засади раціональної терапії вірусних інфекцій
- •Засоби лікування вірусних хвороб
- •2.6.1. Противірусні препарати та механізми їх дії
- •2.6.2. Формування стійкості у вірусів до хімічних препаратів
- •Розділ 3. Принципи та методи лабораторної діагностики
- •Характеристика методів діагностики вірусних інфекцій
- •3.1. Виділення вірусів з організму та навколишнього середовища
- •Вилучення вірусів з організму людини та тварин
- •Зразки для вірусологічної діагностики
- •Виділення вірусів із об’єктів навколишнього середовища
- •3.2. Вірусоскопічні методи досліджень
- •3.3. Електронна та імунно-електронна мікроскопія
- •3.4. Вірусологічні методи
- •Методи вірусологічних досліджень на тваринах
- •3.5. Використання культури клітин у вірусології
- •Основні клітинні культури, що застосовуються для виділення вірусів
- •3.6. Індикація вірусів у живих системах
- •3.7. Титрування вірусів
- •3.8. Серологічні методи діагностики
- •3.8.2. Метод флуоресцюючих антитіл (мфа)
- •3.8.3. Реакція зв’язування комплементу (рзк)
- •3.8.4. Реакція нейтралізації (рн)
- •3.9. Реакція гемаглютинації (рга) та реакція гальмування гемаглютинації (ргга)
- •Умови гемаглютинації деяких вірусів
- •3.10. Реакція непрямої (пасивної) гемаглютинації (рнга або рпга)
- •3.11. Реакція гемадсорбції (рГадс) та реакція гальмування гемадсорбції (ргГадс)
- •3.12. Молекулярно-гібрідологічні методи
- •Полімеразна ланцюгова реакція
- •Характер реплікації віруса;
- •4.1.2. Герпетичрий гепатит
- •4.1.3. Цитомегаловірусна інфекція
- •Поява основних етапів інфікування цмв і впг
- •4.1.4. Епщтейн-Барр вірусна інфекція. (Інфекційний мононуклеоз)
- •Найбільш частим клінічним перебігом захворювання є ентерит і гастроентерит, вторинна лактазная недостатність.
- •4.4.1. Вірус гепатитк є
- •Розповсюдження генотипів у світі
- •4.5. Віруси, що містять одноланцюгову молекулу рнк негативній або подвійній полярності (наприклад, ортоміксовіруси, філовіруси).
- •4.5.1. Віруси грипу людини
- •Календар появи субтипів віруса грипа а за 100-річний період
- •4.6.1. Вірус імунодефіциту людини
- •Питання до індз
- •Литература
4.6.1. Вірус імунодефіциту людини
За оцінкою Об'єднаної програми ООН по ВІЛ/СНІД і Всесвітній організації охорони здоров'я (ВООЗ), з 1981 по 2006 р.р. від хвороб, пов'язаних з ВІЛ-інфекцією і СНІД померли 25 мільйонів чоловік. Таким чином пандемія ВІЛ-інфекції є однією з найбільш згубних епідемій в історії людства. Тільки у 2006 році ВІЛ -інфекція стала причиною смерті близько 2,9 мільйонів чоловік. До початку 2007 року у всьому світі близько 40 мільйонів чоловік (0,66 % населення Землі) були носіями ВІЛ. Дві третини із загального числа ВІЛ-інфікованих живуть в країнах Африки на південь від пустелі Сахари. У найбільш постраждалих від пандемії ВІЛ -інфекції і СНІД країнах епідемія перешкоджає економічному зростанню і збільшує бідність населення.
ВІЛ-инфекция (інфекція вірусом імунодефіциту людини) - повільно прогресуюче інфекційне захворювання, що виникає внаслідок зараження вірусом імунодефіциту людини, що пурхає імунну систему внаслідок чого організм стає високо сприйнятливий до опортуністичних інфекцій і пухлин, которие зрештою призводять до загибелі хворого.
Захворювання впервие било описано в 1981 р. в США серед гомосексуалістів. Нова хвороба маніфестувала пневмоцистной пневмонією і нерідко - саркомою Калоши, що било незвичайно, оскільки ці захворювання раніше зустрічалися майже виключно у хворих похилого віку з важкою імунодепресією.
Первинний стан імунної недостатнбості, що виникає у гомосексуалистів, пояснювали імунодепресивною дією сперми від великого числа партнерів або появою у них в крові аутоантитіл до лімфоцитів, або, можливо імунодепресивною дією амілонітриту, який використоввався гомосексуалістами для зниження тонусу мишц заднього проходу. Проте незабаром ці припущення відпали, оскільки хвороба ьула поширена не лише нелише серед пасивних гомосексуалістів, але і серед активних, у яких вищеперелічені фактори не могли мати місця і, крім того, все частіше стан імунодефіциту стали описувати у наркоманів, що не мають схильності до гомосексуалізму.
Важлмвмм етапом у встановленні інфекційної природи СНІД било виявление великого числа хворих серед мешканців з острова Гаїті африканського походження, у яких не відзначалося схильності до гомосексуалізму або вживання наркотиків і, крім того, серед них кількість хворих чоловіків і жінок була одинаковою, що суперечило американської статистиці, згідно якої у жителів США, хворих синдромом надбаного імунодефіциту, число чоловіків у багато разів леревищувало число жінок.
У період з 1981 по 1984 рік вийшло декілька робіт, що зв'язують небезпеку розвитку СНІД з анальним сексом або з впливом наркотиків. Паралельно велися роботи над гіпотезою про можливу інфекційну природу СНІД. Вірус імунодефіциту людини незалежно відкрили в 1983 році в двох лабораторіях:
- в Інституті Пастера у Франції під керівництвом Люка Монтанье (фр. Luc Montagnier).
- в Національному інституті раку в США під керівництвом Роберта Галло (англ. Robert C. Gallo).
Результати досліджень, в яких з тканин пацієнтів уперше вдалося виділити новий ретровірус, були опубліковані 20 травня 1983 в журналі Science . У цих статтях повідомлялося про виявлення нового вірусу, що належить до групи HTLV вірусів . Дослідники висували припущення, що виділені ними віруси можуть викликати СНІД.
4 травня 1984 р. дослідники повідомили про виділення вірусу, що носив на той момент назву HTLV, - III, з лімфоцитів 26 з 72 обстежених хворих СНІД і 18 з 21 хворих з ПРЕ-СНІД станом. Ні у кого з 115 здорових гетеросексуальних індивідів контрольної групи вірус виявити не вдалося. Дослідники відмітили, що малий відсоток виділення вірусу з крові хворих СНІД викликаний малою кількістю Т4 лімфоцитів, клітин, в яких, імовірно розмножується ВІЛ.
Крім того, учені повідомили про виявлення антитіл до вірусу, про ідентифікацію раніше описаних у інших вірусів і раніше невідомих антигенів HTLV - III і про спостереження розмноження вірусу в популяції лімфоцитів.
У 1986 р. було виявлено, що віруси, відкриті в 1983 французькими і американськими дослідниками, генетично ідентичні. Первинні назви вірусів були скасовані і запропонована одно загальна назва - ВІЛ.
У 2008 році Люк Монтанье і Франсуаза Барре-Синусси були удостоєні Нобелівською премиии в області фізіології і медицини "за відкриття вірусу імунодефіциту людини".
Біологія ВІЛ
Потрапляючи в організм людини, ВІЛ заражає CD4+ лімфоцити, макрофаги і деякі інші типи клітин. Проникнувши ж у вказані типи клітин, вірус починає активно в них розмножуватися. Це кінець кінцем призводить до руйнування і загибелі заражених клітин. Присутність ВІЛ з часом викликає порушення імунної системи із-за виборчого знищення ним імунокомпетентних клітин і пригнічення їх субпопуляції. Віруси, що вийшли з клітини, впроваджуються в нові, і цикл повторюється. Поступове число CD4+ лімфоцитів знижується настільки, що організм вже не може протистояти збудникам опортуністичних інфекцій, які не небезпечні або мало небезпечні для здорових людей з нормальною імунною системою.
Класифікація
Вірус імунодефіциту людини відносять до родини ретровірусів (Retroviridae), роду лентивірусів (Lentivirus). Назва Lentivirus походить від латинського слова lente - повільний. Така назва відбиває одну з особливостей вірусів цієї групи а саме - повільну і неоднакову швидкість розвитку інфекційного процесу в макроорганізмі. Для лентивірусів також характерний тривалий інкубаційний період. Вид віруса позначається як Human Immunodeficiency Virus (HIV).
У роді Lentivirus виділяють наступні види (за даними на 2008 рік) (табл.. )
Таблиця
Споріднені віруси
Абревіатура |
Англвйська назва |
Українська назва |
EIAV |
Equine infectious anemia virus |
Вірус інфекційної анемії коней |
OOP |
Ovine Progressive Pneumonia |
Вірус меді-вісна овець |
CAEV |
Caprine-ovine arthritis-encephalitis virus |
Вірус артриту-енцефіліту коз і овець |
BIV |
Bovine immunodeficiency virus |
Вірус імунодефіциту великої рогатої худоби |
FIV |
Feline immunodefitiency virus |
Вірус імунодефіциту кішок |
PLV |
Puma lentivirus |
Лентівірус пум |
SIV |
Simian immunedeficiency virus |
Вірус імунодефіциту мавп. Відомі декілька штамів цього вірусу. Кожен штам характерний для одного виду приматів : SIV - agm, SIV - cpz, SIV - mnd, SIV - mne, SIV - mac, SIV - sm, SIV - stm |
HIV-1 |
Human immunodeficiency virus-1 |
Вірус імунодефіциту людини |
HIV-2 |
Human immunodeficiency virus-2 |
Вірус імунодефіциту людини |
ВІЛ генетично і антигенно неоднорідний - описани ВІЛ-1 і ВІЛ-2. Батьківщиною вірусів обох типів вважають Африку. ВІЛ-1 є збудником пандемії СНІДУ, що охопила планету, а ВІЛ-2 зустрічається тільки в 15 країнах Західної Африки і в деяких країнах Європі і Америка, куди він був завезений.
Д ля
вірусу імунодефіциту людини характерна
висока частота генетичних змін, що
виникають в процесі самовідтворення.
Частота виникнення помилок у ВІЛ складає
10−3 - 10−4 помилок / (геном * цикл
реплікації) що на декілька порядків
більше аналогічної величини у эукариот.
Довжина генома ВІЛ складає приблизно
104 нуклеотидів. З цього виходить, що
практично кожен вірус хоч би на один
нуклеотид відрізняється від свого
попередника. У природі ВІЛ існує у
вигляді безлічі квази-видов, будучи при
цьому однією таксономічною одиницею.
В процесі дослідження ВІЛ все-таки були
виявлені різновиди, які значно відрізнялися
один від одного за декількома ознаками
зокрема різною структурою генома.
Різновиди ВІЛ позначаються арабськими
цифрами. На сьогодні відомі ВІЛ-1, ВІЛ-2,
ВІЛ-3, ВІЛ-4
ля
вірусу імунодефіциту людини характерна
висока частота генетичних змін, що
виникають в процесі самовідтворення.
Частота виникнення помилок у ВІЛ складає
10−3 - 10−4 помилок / (геном * цикл
реплікації) що на декілька порядків
більше аналогічної величини у эукариот.
Довжина генома ВІЛ складає приблизно
104 нуклеотидів. З цього виходить, що
практично кожен вірус хоч би на один
нуклеотид відрізняється від свого
попередника. У природі ВІЛ існує у
вигляді безлічі квази-видов, будучи при
цьому однією таксономічною одиницею.
В процесі дослідження ВІЛ все-таки були
виявлені різновиди, які значно відрізнялися
один від одного за декількома ознаками
зокрема різною структурою генома.
Різновиди ВІЛ позначаються арабськими
цифрами. На сьогодні відомі ВІЛ-1, ВІЛ-2,
ВІЛ-3, ВІЛ-4
У 1986 році групою американських дослідників від здорових людей в Сенегалі був виделен вірус, схожий з вірусом африканських зелених мартишек (рис. ); смроватки ВІЛ-інфікованих людей реагували з антигенами вірусу мартишек, але не давали реакції (або вони били слабкими) з антигенами ВІЛ.
Рис. 39. Африканська зелена мартишка
Передбачалося, що вірус міг бити попередником ВІЛ. Виделенний вірус бияків названий HTLV - 4.HTLV-4, подобно ВИЧ, инфицирует Т-хелпери, но не убивает их. Есть мнение, что непатогенний вирус HTLV-4 эволюционировал в безвредний вирус африканских зелених мартишек, которий превратился в патогенний ВИЧ-2 - предшественник ВИЧ-1.
Будова вібріона
Віріони ВІЛ мають вигляд сферичних часток (рис. ), діаметр яких складає близько 100-120 нанометрів. Це приблизно в 60 разів менше діаметру еритроцита.
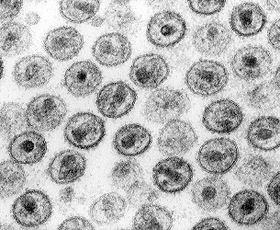
Рис. 40 . Зображення вірусів, отримане за допомогою трансмісійного електронного мікроскопа. Видно будова вірусу, усередині якого знаходиться конусоподібне ядро.
Капсид зрілого віріона має форму усіченого конуса. Іноді зустрічаються "багатоядерні" віріони що містять 2 або більше нуклеоидов.
До складу зрілих віріонів входить декілька тисяч білкових молекул різних типів.
Таблиця .
Назви і функції основних структурних білків ВІЛ-1
Скорочена назва |
Опис |
Функції |
gp41 (TM, transmembrane) |
Трансмембранний глікопротеїн масою 41 кДа
|
Розташовується в зовнішньому шарі ліпідної мембрани. Грає роль "якоря", що утримує молекули іншого білку, - gp120 |
gp120 (SU, surface) |
Глікопротеїн масою 120 кДа
|
Зовнішній білок віріона. Нековалентний пов'язаний з трансмембранним білком gp41. З однією молекулою gp41 пов'язано 3 - 5 молекул gp120. Здатний зв'язуватися з CD4 рецептором. Відіграє важливу роль в процесі проникнення вірусу в клітину. |
p24 (CA, capsid) |
Білок масою 24 кДа
|
Білок, що утворює оболонку нуклеоїда (капсиду) вірусу |
p17 (MA, matrix) |
Матриксный білок масою 17 кДа
|
Розташовується в зовнішньому шарі ліпідної мембрани. Грає роль "якоря", що утримує молекули іншого білку, - gp120 |
p7 (NC, nucleocapsid) |
Нуклеокапсидный білок масою 7 кДа |
Зовнішній білок віріона. Нековалентний пов'язаний з трансмембранним білком gp41. З однією молекулою gp41 пов'язано 3 - 5 молекул gp120. Здатний зв'язуватися з CD4 рецептором. Відіграє важливу роль в процесі проникнення вірусу в клітину. |
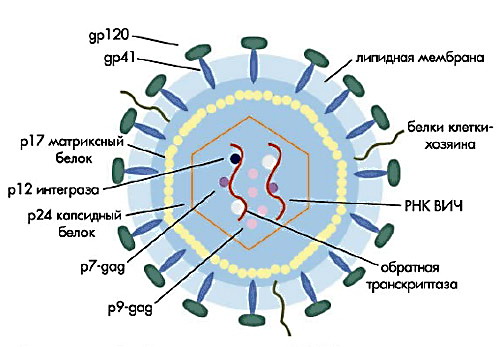
Рис.41. Структура ВІЛ
Усередині капсиду ВІЛ знаходиться белковонуклеиновый комплекс: дві нитки вірусної РНК, вірусні ферменти (зворотна транскриптаза, протеаза, інтеграза) і білок p7. З капсидом також асоційовані білки Nef і Vif (7-20 молекул Vif на віріон). Усередині віріона (і, найімовірніше за межами капсиду) виявлений білок Vpr[32]. Сам капсид утворений ~2,000 копії вірусного білку p24. Стехіометричне співвідношення p24 : gp120 у віріоні складає 60-100:1, а p24: Pol приблизно 10-20:1, Крім того, з капсидом ВІЛ-1 (але не ВІЛ-2) зв'язуються ~200 копій клітинного циклофилина А, який вірус запозичує у зараженої клітини.
Капсид ВІЛ оточений матриксной оболонкою, утвореною ~2,000 копії матриксного білка p17. Матриксная оболонка у свою чергу оточена двуслойной ліпідною мембраною, що є зовнішньою оболонкою вірусу. Вона утворена молекулами захопленими вірусом під час його брунькування з клітини, в якій він сформувався. У ліпідну мембрану вбудовані 72 гликопротеиновых комплексу, кожен з яких утворений трьома молекулами трансмембранного глікопротеїну (gp41 або TM), що служать "якорем" комплексу і трьома молекулами поверхневого глікопротеїну (gp120 або SU. За допомогою gp120 вірус приєднується до CD4 рецептору і корецептору, що знаходиться на поверхні мембрани клітин. gp41 і особливо gp120 інтенсивно вивчаються як цілі для розробки ліків і вакцини проти ВІЛ. У ліпідній мембрані вірусу також знаходяться мембранні білки клітин, у тому числі людські лейкоцитарні антигени (HLA) класів I, II і молекули адгезії.
Геном ВІЛ
Генетичний матеріал ВІЛ представлений двома не пов'язаними нитками позитивно-смислової (positive - sense, або (+)) РНК [34]. Геном ВІЛ-1 має довжину 9,000 нуклеотидів. Кінці генома представлені довгими кінцевими повторами (LTR) (рис. )які управляють продукцією нових вірусів і можуть активуватися і білками вірусу, і білками інфікованої клітини.
rev
rev tat
5-LTR - gag - pol - vif - vpr - tat - vpu - env - nef - LTR - 3
Рис. 14. Структура генома ВІЛ
9 генів ВІЛ-1 кодують, принаймні, 15 білків .
- pol - кодує ферменти: зворотну транскриптазу (RT), інтегразу (IN) і протеазу (PR).
- gag - кодує полипротеин Gag/p55, що розщеплюється вірусною протеазою (PR) до структурних білків p6, p7, p17, p24.
- env - кодує білок gp160 розщеплюваний клітинною эндопротеазой фурином на структурні білки gp41 і gp120.
- tat - ген-трансактіватор, змінює експресію вирусних генів;
- nef - пригнічує регуляцію реплікації вірусу;
- rev - змінює експресію структурних білків вірусу;
- vif - впливає на інтенсивність вірусного розмноження;
- vpu - (у ВІЛ-1) і vpx (у ВІЛ-2) можливо впливає на дозрівання і висвобождение вірусу з клітини;
- vpr - стимулює область промотора вірусу;
- LTR (long terminal repeat) - містить послідовності підстав, що повторюються, є промотором що регулює включення вірусної ДНК-копії генома в клітинну хромосому.
Ген rev зчитується в результаті зрушення рамки з двох ділянок генів tat і env; з ділянки гена env також транслюється білок, которий взаємодіючи з функціонально неактивним продуктом гена tat, утворює трансактивирующий білок.
У серцевині вірусу знаходяться белки-ферменти: зворотна транскриптаза, ендонуклеаза і протеаза.
Зовнішня гликолипидная оболонка віріона двошарова. Зовні оболонка має 72 виступа, образованних глікопротеїнами.
Цикл розвитку вірусу. До складу глікопротеїнів входять білки которие "дізнаються" клеточние рецептори і забезпечують проникнення вірусу в клітину-хазяїна шляхом эн-доцитоза або через плазматичну мембрану. Після проникнення вірусного генома в цитоплазму клітини інформація з вірусною РНК за допомогою зворотної транскриптази пе-реписивается на ДНК. Потім до одноцепочечной ДНК, що утворилася, добудовується вто-рая нитка ДНК, а РНК-матриця руйнується. Дволанцюжкова проміжна форма ДНК транспортується в ядро, де набуває кільцевої форми і інтегрує з ДНК клет-ки, перетворюючись на провірус
(рис. 15).
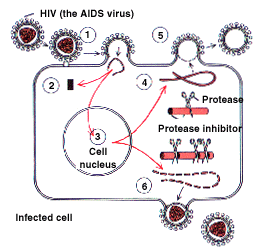 Рис.
42. Етапи взаємодії ВІЛ -
збудника СНІЛу (AIDS) з СD4
рецепторами клітинних мембран
Рис.
42. Етапи взаємодії ВІЛ -
збудника СНІЛу (AIDS) з СD4
рецепторами клітинних мембран
1. Зв'язування ВІЛ з рецептором CD4
2. РНК ВІЛ переписивается на ДНК за допомогою зворотної транскриптази з перетворенням на ДНК-провірус
3. Інтеграція провіруса за допомогою интегрази в ядро CD4 -клітині, синтез геномної РНК для нових віріонів
4. Трансляція вирусних білків і розщеплювання протеазою ви-русних поліпептидів
5. Зборка нових віріонів
6. Вихід нових віріонів з клітини-мішені
З моменту інтеграції починається стадія латентної інфекції, при цьому транс-крипции і трансляції з генів вірусу немає. Чинниками, що активують провірус, можуть виступать различние антигени, цитокини, собственние вирусние і гетерологічні трансактиватори та ін. Завершуючим етапом формування ВІЛ є зборка вирус-них часток і виход їх з разрушенних клітин. Вірусна інфекція в зараженій клітині може призводити також до утворення синцитиев (множественних об'єднань клітин). Певна частина вирусних глікопротеїнів отламивается від поверхні віріона і знаходиться у вільному стані в крові. Свободние вирусние гликопротеиди зберігають здатність связиваться з рецепторами неинфицированних Т-хелперів, перетворюючи їх на клітини-мішені. Такі клітини атакуються і знищуються специфічними противовирусними цитотоксичними Т-лімфоцитами.Вирус поражает основние клетки иммунной системи - моноцити и макрофаги, Т-хелпери и Т-индуктори, клетки Лангерганса, некоторие клони В-лимфоцитов, а также клетки ЦНС, содержащие на своей поверхности рецептори CD4.
Патогенез ВІЛ
Не є звичним патогенез СНІДУ : через 2-3 тижні після зараження відбувається гранічне, контрольоване організмом, розмноження вірусу, що призводить до утворення провіруса. Чутливість імуноцитів до вірусу різна: Т-хелпери руйнуються ш идио а макрофаги і моноцити не піддаються руйнуванню і є основними чинниками перенесення вірусу в различние органи і тканини, у тому числі - в клітини ЦНС, що і є головною причиною розвитку в організмі латентної інфекції. Через 3-6 місяців після інфікування в сироватці крові з'являються специфічні антитіла до зовнішніх і внутрішніх вирусних білків. Ці антитіла не мають нейтралізуючої вірус активності. Латентний період може тривати у 6 місяців до 6-10 років (в середньому 46 місяців у дорослих і 36 місяців у дітей). Взривоподібне розмноження відбувається внаслідок активації провіруса, що знаменує перехід вірусу з латентної стадії в клінічну (СНІД).
Насправді ж, приблизно у половини інфікованих ВІЛ вже через 2-4 тижні від зараження підвищується температура тіла тривалістю до 2 тижнів, збільшуються лімфатичні узли, печінка і селезінка. Нерідко виявляється ангіна. Що виникає при цьому симптомокомпклекс прийняте називать "моно-нуклеозоподібним синдромом". У крові у таких хворих виявляється досить виражена лімфопенія. Загальна тривалість цього синдрому - 2-4 тижні, услід за цим настає скритий період що триває багато років.
У іншої половини хворих первинної маніфестації хвороби за типом "мононук-леозного синдрому" не бивает, але все таки і у них на якомусь етапі скритого періоду по-являются отдельние клінічні симптоми. Особливо характерне збільшення заднешейних, надключичних локтевих і подмишечних груп лімфовузлів. На думку експертів ВООЗ, подозрительним на Віл-інфекцію слід рахувати збільшення більш ніж 1 лимфо-узла, більш ніж в одній групі (окрім пахових), що триває більше 1,5 місяців. Увеличенныие лімфатичні узли при пальпації хворобливі, рухливі, не спаяні з підшкірною клітковиною. З інших клінічних симптомів в цьому періоді хвороби можливий немотивированний субфебрилітет, підвищена стомлюваність і пітливість. У перифери-ческой крові у таких хворих виявляється лейкопенія, непостійне зниження Т4-лімфоцитів, тромбоцитопенія і постійно виявляються антитіла до ВІЛ. субфебрилітет, підвищена стомлюваність і пітливість. У періферічної крові у таких хворих виявляється лейкопенія, непостійне зниження Т4-лімфоцитів, тромбоцитопенія і постійно виявляються антитіла до ВІЛ. Цю стадію хвороби прийнято означати як синдром хронічної лімфаденопатії, так як проявляється він в основному збільшенням лімфатичних вузлів, має невизначено довгу течію, і доки неясно з якою частотою і в які конкретно терміни бо¬лезнь переходить в наступну стадію - ПРЕ-СПИД. Дуже характерни повторние ГРВІ, рецидивуючі бронхити, отити, пневмонії. На шкірі можливі прояви простого герпесу або грибкові ураження гнойничковие висипания, часто виникають упорние кандидозние стоматити і эзофагити. При дальнейшем прогрессировании болезни развивается клиника собственно СПИД, которая проявляется в основном тяжелими оппортунистическими инфекциями и различного рода новообразованиями
На тлі імунодефіциту розвиваються опортуністичні інфекції і неопла-стические процесси, що призводять до летального результату. Збудниками вторичних опортуністичних) інфекцій при СНІДІ є наступні организми:
одноклітинні паразити (Pneumocystis carinii pneumoni, токсоплазми, крип-
тоспорідії);
гриби (кандида, криптококкус, аспергіллюс);
бактерії (мікобактерії сальмонелли, кампілобактер, легіонелли
нокардії і актіноміцети);
віруси (цитомегаловіруси, Herpes simplex);
онкозахворювання (саркома Капоши, лімфоми).
Крім того, у зв'язку з різким зниженням реакцій цитотоксичности стає не-возможним пів¬ноценний иммунний контроль за утворенням атипових клітин, що призводить до підвищенної захворюваності хворих ВІЛ-інфекцією різними опухолями. Приблизно у третини дорослих хворих ВІЛ-інфекція проявляється саркомою Капоши. У деітей ця форма хвороби зустрічається значно рідше, але протікає часто в злоякісній рмі. При цьому характерні осередки ураження у вигляді безболісних пухлиноподібних утворень з бородавчастою поверхнею синюшно-червоного або темно-бурого кольору проявляються на голові, тулубі, слизистих оболонках порожнини рота і шлунково-кишкового тракту що абсолютно не характерне для типової саркоми Капоши прощо являється переважно на кінцівках і майже виключно у осіб похилого віку.Современними дослідженнями показано, що отдельние прояви хвороби мо¬гут виникати не за рахунок розвитку імунодефіцитного стану а у зв'язку з випрямляємо повреж¬дією самого вірусу иммунодефи¬цита, що дає, на органи і тканині.
Нейротропізм ВІЛ підтверджується не лише високою частотою поразки ЦНС, як у дітей так і у дорослих, хворих СНІД, але також і по¬стоянным виявленням са-мого вірусу в образ¬цах тканин мозку, в нервових стволах і непосред¬ственно в спинномоз-говой рідині. В окремих випадках ВІЛ визначається в клітинах ЦНС і відсутня в крові. Методом молекулярної гибридізації получени докази можливості реплікации і експресії вірусного генома безпосередньо в клітинах мозку хворих СНІД. За¬слугує бути отмеченним і той факт, що у більшості хворих СНІД інфікованими оказиваются тільки 1/10000 частина усього пулу лімфоцитів периферичної крові, тоді як в тканині мозку вражається кожна сота і навіть десята клітина. У багатоядерних велетенських клітинах мозку за допомогою електронної мікроскопії били виявлені частки ретровірусу, що відгалужуються із зовнішньої клітинної мембрани. Подібні вирусние частки били виявлені і в клітинах астроцитарной Наявні данние дозволяють вважати що ураження мозку у хворих ВіІЛ-інфекцією завжди виникає первинно за рахунок реплікації і експресії генома вірусу в нервних глиальних клітинах, що свідчить також про те що ВІЛ-споріднені поразки ЦНС можуть проходити і без змін із сторони імунної системи. Питання про ураження інших органів і систем при ВіІЛ -інфекції потребує додаткового вивчення. Проте по предварительним данним, поразка легенів, м'язів і. ін. органів якщо і зустрічається, то швидше за все виникає внаслідок цитопатичної дії вірусу на моноцитарно-макрофагальние.
Епідеміологія.
ВІЛ-інфекція - вірусне захворювання, що викликається вірусом імунодефіциту людини. Останньою стадією захворювання є СНІД.
Період від інфікування вірусом імунодефіциту людини до розвитку СНІД триває в середньому 9 - 11 років. Статистичні дані численних досліджень, проведених в різних країнах за період часу більше двох десятиліть, підтверджують цей висновок. Ці цифри справедливі лише для випадків, коли ВІЛ-інфекція не піддається ніякій терапії.
Зараження людини ВІЛ відбувається при попаданні вируссодержащего матеріалу безпосередньо в кров або на слизистие оболонки. Велика вірогідність зараження половимо шляхом і при б- і гетеросексуальних контактах з больними (носіями) причому інфікування жінок від чоловіків частіше, ніж чоловіків від жінок.
ВІЛ передається також через інфіковану кров (при переливанні крові і її препаратів), при повторному використанні інфікованого медичного інструментарію Найчастіше це відбувається у наркоманів при внутрішньовенному введенні наркотичних препаратів одними і тими ж шприцами і голками. Менш значимим являється вертикальний шлях передачі збудника, которий реалізується в організмі вагітної женщини, коли плід заражається в матці (трансплацентарний шлях). Ризик передачі ВІЛ дітям від серопозитивних матерів складає до 50%, залежить від стадії захворювання і збільшується при грудному вигодовуванні. Можливе контактне зараження дитини при пологах, а також через грудне молоко. Виявлени випадки зараження матерів від инфицированних грудних дітей при вигодовуванні грудьми. Оскільки ВІЛ знаходять також в слині і сечі і ці біологічні рідини можуть при поцілунках і укусах потрапити на слизистие оболонки здорового, не можна виключити також вірогідність зараження за допомогою цих чинників передачі.
Відомий уникальний випадок зараження ВІЛ літньої женщини, інфікованою слиною при поцілунках зі своїм чоловіком, инфицированним ВІЛ.
Таблица 5.
Ступінь ризику зараження ВІЛ при різних способах передачі
Шляхи передачі |
Ризик інфікування |
Статеві відносини |
|
Передача від жінки - чоловіку |
1 з 700 - 3000 |
Передача від чоловіка - жінці |
1 з 200 - 2000 |
Передача чоловіка - чоловіку |
1 з 10 - 1600 |
Феляція |
6 -8 % |
Медичні інструменти і матеріали |
|
Укол голкою |
1 из 200 |
Використання спільної голки |
1 из 150 |
Перелівания інфікованої крові |
95 из 100 |
Передача від матері немовляті |
|
Без лікування азідотімідіном |
1 в 3-5 случаях |
При лікуванні азідотімідіном |
<1 из 10 случаев |
Комбінована антіретровірусна терапія |
1 из 50 случаев |
Биологічні рідини людського організму (ВІЛ-інфікованого можуть бути небезпека при попаданні в кров реципієнта (таблиця ).
Таблиця
Число інфекційних часток ВІЛ в різних біологічних рідинах інфікованих ВІЛ лиц
Є факторами передачі |
Інфекційних одиниць в 1 мл біологічної рідини |
Не є факторами передачі |
Інфекційних одиниць в 1 мл біологічної рідини |
Грудне молоко |
< 1 |
Сльози |
< 1 |
Вагінальний секрет |
< 1 |
Слина |
< 1 |
Сім'яна рідина |
10-50 |
Піт |
< 1 |
Кров |
до 3000 |
|
|
Резистентність. ВІЛ нестійок в зовнішньому середовищі і при кип'яченні інактивується за 1 хвилину, гине під впливом хімічних агентів, допущенних для проведення дезинфекції.
Діагностика ВІЛ-інфекції в начальних стадіях хвороби до розвитку СНІДУ проводиться на підставі виявленyя специфічних вирусних антигенів або антитіл. Традиционним матеріалом для визначення антитіл до ВІЛ продовжує залишатися плазма або сиворотка крові. Найширше застосовується метод визначення загальних антитіл до вірусу - метод иммуноферментного аналізу (ІФА), хоча він дає велике число ложноположительних результатів. Антитіла виявляються у усіх больних і инфицированних ВІЛ вже через місяць від початку захворювання. У разі отримання позитивного результату постановка ІФА повторюється ще двічі (з тією ж сироваткою). При отриманні хоч би ще одного позитивного результату діагноста ВІЛ-інфекції триває більше специфичним методом иммуноблотинга (ІБ) дозволяючого виявить антитіла до окремих білок ретровірусу. Тільки після позитивного результату в ІБ можливе укладення про інфікованість особи ВІЛ. Цей метод дозволяє провести більше специализи¬рованное обстеження виявление антитіл до отдельним білок ВІЛ, що є білками сердцевини або поверхневої оболонки вірусу. Система иммуноблотинга більше специфічна, але в той же час вона менш чутлива. Прийнято вважати, що положительним результатом аналізу досліджуваної сиворотки крові при використанні иммуноблотинга є факт виявления анти¬тіл до вирусним білок gp120 або p41 (рис.43).
Зараження, тижні
Місяці
Роки
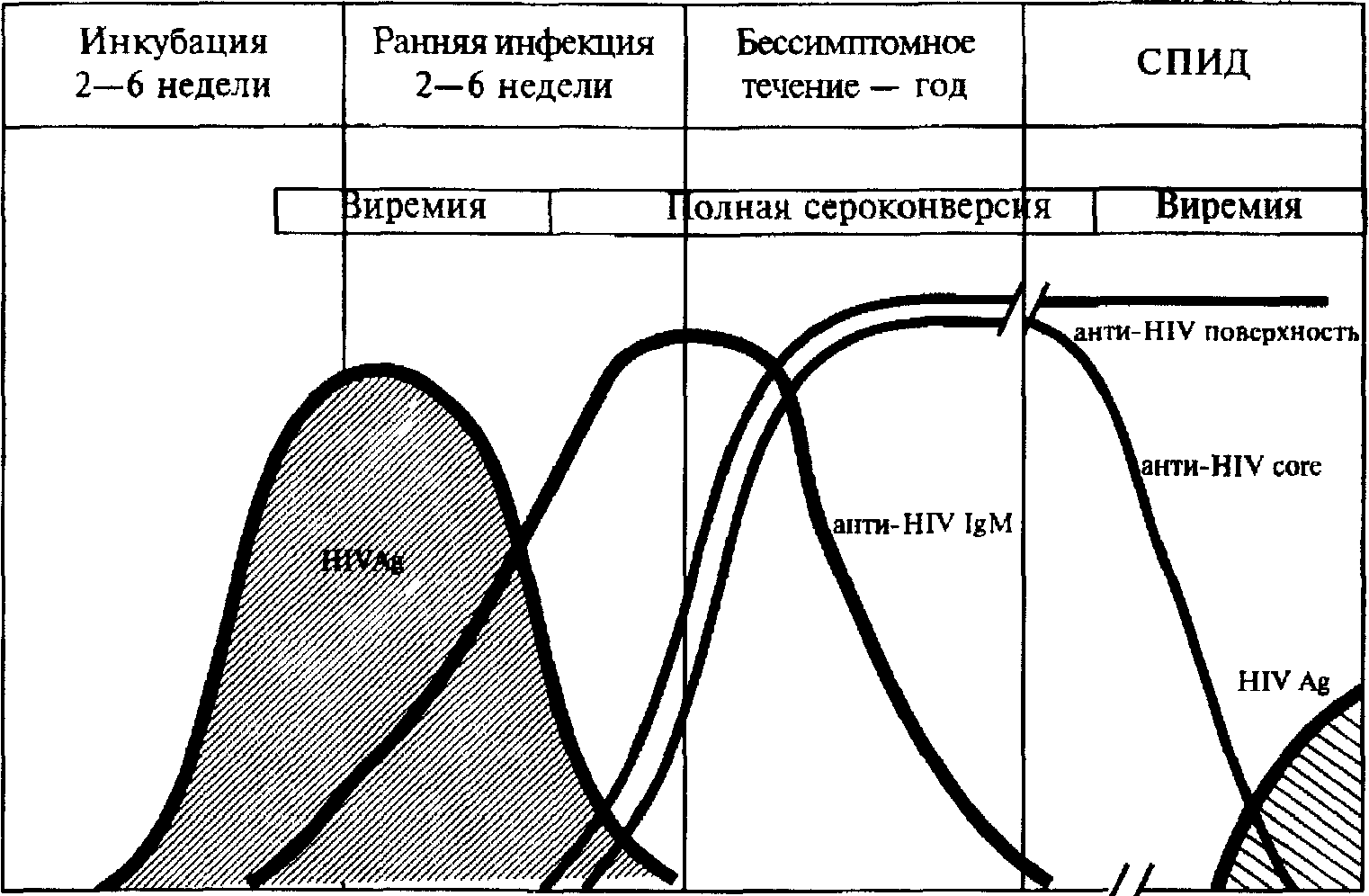
Рис. 43. Специфічні маркери ВІЛ-інфекції.
Лікування. Нині медицина не має у розпорядженні коштів, що дозволяють вилечить людину від ВІЛ-інфекції. Проте разработани схеми лікування, що дозволяють істотно затримати розвиток захворювання (на 3-6 років). На жаль набір специфічних противовирусних препаратів дуже обмежений (таблиця ).
Таьлица 6.
Мішени для антіретровірусних препаратів при ВІЛ-інфекції
Фази взаємодії віруса з клітиною |
Мішени |
Лікарські препарати |
1. Зв'язування віріона з мембраною клітини |
Рецептори gp120 ВІЛ і CD4 клітини |
Відсутні |
2.Ін'єкція капсиду ВІЛ в клітину |
Невідомі |
Відсутні |
3.Зворотна транскрипція з утворенням провірусної ДНК |
Транскриптаза |
Нуклеозидні і ненуклеозидні інгібітори зворотної транскриптази |
4.Інтеграція провірусної ДНК в ДНК клітини-мішені |
Інтеграза |
Відсутні |
5.Транскрипція вирусних поліпептидів в хромосомному наборі хазяїна |
|
Відсутні |
6.Трансляція і розтин вирусних поліпептидів (процесинг) на функціонуючі білки |
Протеаза |
Інгибитори протеази |
7.Зборка вірусів і виход з клітини |
|
Відсутні |
Протиретровірусним препаратом, дозволеним для клінічного застосування являється інгібітор транскриптази - азидотимідин (АЗТ. тимозид, ретровир, зидовудин). При розвитку резистентності вірусу або поганої переносимості АЗТ можуть застосовува-тися і інші інгібітори транскриптази (диданозин і зальцитабин), можливо у поєднанні з людським лейкоцитарним інтерфероном.
Лікування проводитися по чотирьох напрямках:
1) дія на вірус за допомогою противірусних препаратів;
2) імунокорекція і імуностимуляція;
3) імунозаміщення;
4) лікування опортуністичних інфекциій і онкологичних хвороб.
Прогноз при ВІЛ-інфекції несприятливий. Хоча деякі автори допускають, що латентний період при цьому захворюванні може тривати 10-11 років і довше, багато спостережень примушують відмовитися від цієї надії. Зокрема, було встановлено, що практично усі люди зареєстровані в 1985 році як інфіковані, але бессимптомние, до кінця 1991 року вже померли або були тяжкохворими. Проте, останнім часом з'явилися повідомлення про більше сприятливі прогнози, особливо у випадках зараження ВІЛ другого типу.
Профілактика. Противоэпидемический режим при ВИЧ-инфекции такой же, как и при гепатите В. Поскольку ВИЧ обычно заражаются представитель групп повышенного риска (наркомани, бисексуалы и др.), основным методом профилактики ВИЧ-инфекции является обучение населения правильному половому поведению (ограничению числа полових партнеров) и правилам безопасного секса (использованию презервативов).
В якості протиепідемічних заходів застосовується обстеження доно-ров крові, сперми, органів, виявлення джерел інфекції (обстеження іноземців, що приїжджають на термін більше 3 місяців, громадян, що повернулися з-за кордону, де вони пробули більше 1 місяця хворих венеричними захворюваннями, гомосексуалістів, наркоманів, повій), а також обстеження, проводимие за клінічними свідченнями і обстеження вагітних. Вірусоносії спеціальної ізоляції не потребують але больние СНІДОМ госпіталізуються у бокси інфекційної больници для запобігання їх зараженню іншими інфекціями.
Противірусні вакцини нині розробляються у ряді країн (США, Англія) і проходять випробування на мартишках і здорових людях-добровольцях. Проходить випробування субодинична вакцина з імуностимулюючими комплексами, рекомбінантние білки отримані від бактерій або культур клітин, синтетичні пептиди. Появи первих партій проти-воспидових вакцин можна чекати в 2005 - 2010 роках.
Оптимістичні прогнози щодо вакцин можуть бути передчасними, оскільки не враховують проблему мінливості ВІЛ.
4.7. Віруси, що містять двохланцюгову ДНК та мають у своєму життєвому циклі стадію синтезу ДНК на матриці РНК - ретроідні віруси (наприклад, гепаднавіруси - вірус гепатиту B). Hepadnaviridae, Caulimoviridae
4.7.1. Вірус гепатиту В.
Відкриттю гепатиту В (ВГВ) передувало виявление в 1965 році в крові авст-ралийского аборигена так званогоо австралійського антигена, що представляє собою, як пізніше було встановлено, поверхневі капсидні білки вірусу гепатиту В людини. Пізнішими дослідженнями були встановлені аналогичні віруси і у тварин (бабаків, земляних і лісових білок, кенгуру, чапель, пекінських качок, гримучих змій і ін.). У 1986 році ця група вірусів виделена в родину Hepadnaviridae.
Морфологія. Віріон ВГВ складно организованний, сферичний, за рахунок супер-капсидноз оболонки діаметром 42 нм. Капсид вірусу є икосаедр (рис. 44).
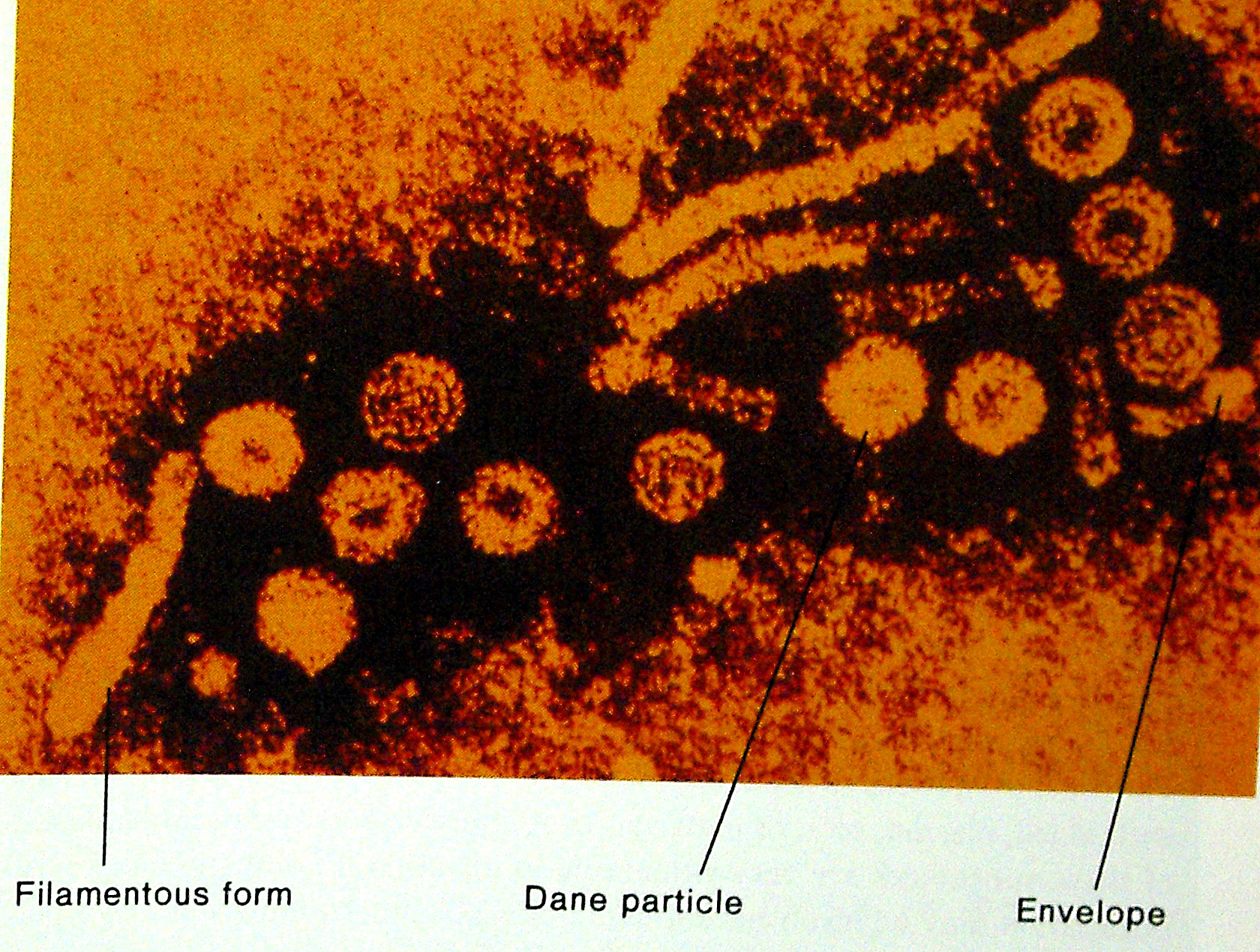
Рис. 44. Вірус гепатиту В (сферичної форми) і паличковидні агрегати, з HBs антигена
Геном вірусу, - дволанцюжкова молекула ДНК, одна з ниток якої замкнута в кільце. Повний ланцюг в кільці ДНК складається з 3200 нуклеотидів ("-" ланцюг) а "+" ланцюг складає 50-80% від "-" ланцюга. Кільцева структура генома підтримується завдяки з'єднанню основ двох ланцюгів на одному з кінців. Геном вірусу складається з четирех сильно генів, що перекриваються. У серцевині віріона розташовується ДНК-залежна ДНК-полімераза, яка виконує функції зворотної транскриптази.
Антигенна структура.. На різних стадіях інфекційного процесу в організмі зараженних ВГВ можуть бути виявлені 4 антигена вірусу (поверхнповерхневий антиген - Hbs, сердцевинний - HBc, антигени інфекційності - HBe і Hbx), антитіла до цих антигенів і вірусспецифічна ДНК. HBsAg знаходиться в зовнішній оболонці вірусу. HBs - Ag представляє собою антигенний комплекс, включаючий групоспецифіччну детермінанту "а" і дві взаємовиключні субтиповч детермчнанти "w" або "у" і "d" або "г" (субтипи ayw, аут, adw, adr). Украй рідко, як результат фенотипічного і генотипичного змішування, зустрічаються змішані субтипи, наприклад adyw або adyr.
HBsAg є поверхностний білок оболонки вірусу.
HBcAg є нуклеопротеїдом, знаходиться в серцевині віріона і виявляється тільки в пунктатах печінці.
HBeAg відщепляється від HBcAg, відіграє важливу роль в реплікації вірусу, виявляється в крові.
HBxAg недостатньо вивчений, припускають, що він впливає на трансформацію гепатоцитів в ракові клітини.
Цикл репродукції вчруса у клітині включає етап інтеграції вірусної ДНК до складу клітинного генома, проте слід мати зважати на те, що інтегрує з хромосомою не ДНК вірусу, що потрапив в клітину, а її копія,
Утворення вірусної ДНК-копії проходить за наступною схемою:
вирчонна ДНК достройка недостаючого ланцюга ДНК прогеномна РНК ДНК- ДНК+ формується дволанцюгова ДНК та відбувається інтеграція ДНК віруса в клітинную хромосому.
Епідеміологія. Вірусний гепатит В відноситься до антропонозних інфекцій: єдиним джерелом зараження є людина. При цьому основним резервуаром є "зіровие" вірусоносії; менше значення мають хпорі гострими і хронічними формами захворювання.
На території країн СНД число вірусоносіїв коливається в широкому діапазоні. Велике число носіїв реєструється в Середній Азії, Казахстані, Схвдному Сибіру, Молдові - близько 10-15%, в Москві приблизно,- 4-5%.
По данним ВООЗ у світі близько 500 млн чоловік є носіями вируса; щорічно 50 млн чоловік заражається ВГВ і близько 2 млн гине (причому, близько 100 тисяч чоловік в рік гине від блискавичної форми гепатиту і близько 300 тисяч - від карциноми печінки). До гіперепідемчних районів відносяться більшість экваториальних і тропічних країн вірусоносійство у населення яких досягає 80%. Страни Східної і Південної Європі відносяться до середньоендемічних районів з вірусоносійством 1 - 7% населення.
НВsАg - основнbй маркер інфекції - виявляється практично в усіх біологічних рідинах організму: в крові, сем'яній рідині, слині, сечі, жовчі, сльозах, грудному молоці, вагінальному секреті, лікворі, синовіальній рідині. Проте, реальну епідеміологічну опас-ность представляє лише кров, де концентрація вірусу значно више порогової.
Передача НВV -інфекції здійснюється виключно парентеральним шляхом: при реліванні інфікованої крові або її препаратів (плазма, еритроцитарна маса, альбумін, протеін, кріопреципітат, антитромбін та ін.), використанні погано стерилізованих шприців, голок різальних інструментів, а також при скаріфікаціях, татуюваннях, операційних втручаннях, лікуванні зубів, ендоскопічному дослідженні, дуоденальному зондуванні і інших маницуляціях, в ході которих порушується цілісність кожних покривів і слизистих оболонок. Для зараження вистачає 10-6 - 10-7 крові з вірусом. Можливі також статевий і вертикальний шляхи передачі. Инкубаційнний період від 2 до 6 діб.
Патогенез захворювання. У механізмі розвитку патологічного процесу при ге-патиті В можна виделить декілька провідних ланок патогенетичного ланцюга.
1. Зараження.
2. Фіксація вірусуна гепатоциті (адсорбція) і проникнення всередину клітини
3. Розмноження вірусів і виділення їх на поверхню гепатоциту, а також в кров.
4. Включення імунологічних реакцій, направленних на елімінацію збудника.
5. Ураження органів і систем за межами печінки
6. Формування імунітету, звільнення від збудника, виздоровлення.
Оскільки зараження при гепатиті В завжди відбувається парентеральним шляхом (через кров), можна вважати, що момент інфікування практично рівнозначний проникненню вірусу в кров; з потоком крові вірус відразу потрапляє в печінку.
Тропізм вірусу гепатиту В до тканини печінки зумовлений наявністю у складі HbsAg рецептора - поліпептиду з молекулярною масою 31 000 дальтон (РS1), що має альбумінозв'язуючу активність. Аналогічна зона поліальбуміну знаходиться і на мембрані гепатоцитів печінки людини і шимпанзе, чим по суті, і визначається тропізм вірусу гепатита В до печінки людини і шимпанзе.
При зараженні гепатоцита процес може розвиватися двома шляхами - реплика-тивному і інтеграційному. У першому випадку розвивається картина гострого гепатиту, а в другому - вірусоносійство.
Кінцевим підсумком реплікативної взаємодії являється зборка структур ко-ровського антигену (у ядрі) і зборка повного вірусу (у цитоплазмі) з подальшою пре-зентацією повного вірусу або його антигенів на мембрані або в структурі мембрани гепатоцитів.
Надалі печінка обов'язково включається в імунопатологічний процес. При цьому ураження гепатоцитів пов'язано з тим що у результаті вбудови вирусних антигенів в мембрану гепатоцитів і виходу вірусних антигенів у вільну циркуляцію відбувається включення ланцюга послідовних клітинних і гуморальних імунних реакцій, направленних зрештою на видалення з організму вірусу. Для елімінації збудика включаються клітинні, Т-клітин, природних кілерів, макрофагів. У ході цих реакцій відбувається руйнування інфі-кованих гепатоцитів, що супроводжується звільненням вірусних антигенів (НВсАg, НВеАg, НВsАg) що запускають систему антитілогенезу, внаслідок чого в крові накопичуються специфічні антитіла,
Таким чином, процес звільнення печінкової клітини від вірусу відбувається шляхом її загибелі за рахунок реакцій клітинного цитолізу.
HВsAg часто утворює сферичні або палочковидні агрегати, без аптигенних властивостей. У цитоплазмі зараженних клітин створюється підвищена кількість HBsAg, пов'язаного з ендоплазматичною мембраною і ендоплазматичною мережею. Антиген постійно циркулює в крові інфікованих осіб.
Одночасно з цим, специфічні антитіла, що накопичуються в крові, зв'язують антигени вірусу, утворюючи імунниі комплекси, що фагоцитуються макрофагами і виділяются бруньками. При цьому можуть виникати різні імунокомплексні поразки у вигляді гломерулонефриту, артеріїту, артралгій, кожних висипань та ін. В ході цих процесів у більшості хворих відбувається очищення організму від збудника і настає повне одуження.
Гепатит В у дорослих в хронічну форму переходить у 5-10% випадків, а у дітей - у 90%. У 50% випадків інфекція протікає инапарантно.
Резистентність. Вірус дуже стійкий в зовнішньому середовищі. У цільній крові і її препаратах зберігається роками. Вірус стійкий до ліофілізації, дії ефіру, ультрафіолетового опромінення, дії кислот та ін. Втрачає свою активність при авто-клавировании (120о, 5 хвилин) стерилізації сухим жаром (160о, 120 хвилин), обробці перекисом водню, хлораміном, формаліном.
Імунітет. У противірусному захисті організму працюють і гуморальний і клітинні системи імунітету. Гуморальний імунітет захищає гепатоцити від вірусів, а клітинний - звільняє організм від інфікуючих клітин. Для попередження гепатиту В у осіб що наражаються на особливу небезпеку зараження, вважається за необхідне застосування спе-цифічного імуноглобуліну, приготованого з крові осіб, з високим титром антитіл.
Особи з підвищеним ризиком зараження вводиться також рекомбінантна дріжджова вакцина. Новонвродженим від HBsAg -позитивних матерів одночасно з вакциною може вводитися в перші часи після народження специфічний імуноглобулін.
ВООЗ рекомендує тотальну вакцинацію населення і груп високого ризику в країнах, де вірусоносійство превишает 2%, а маркери ВГВ виявляють у 20% населення. У країнах з вірусоносійством 0,5% і інфікованістю населення 5-6% рекомендується вакцинація новорожденних, рожденних матерями-вірусоносіями і представників груп високого ризику. Імунітет після вакцинації зберігається більше 5-12 років.
M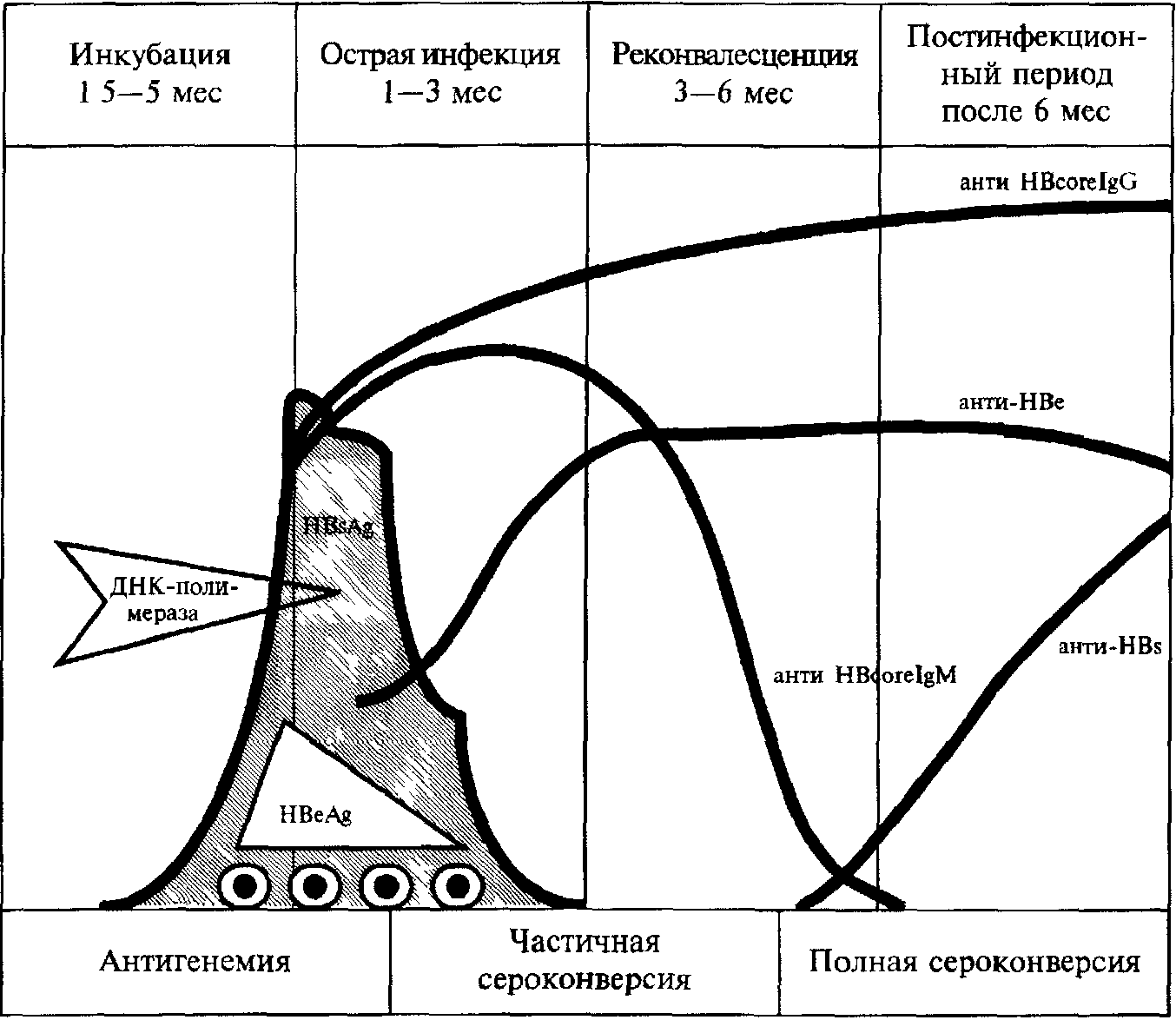 етоди
лабораторнох
діагностики
основани на визначенні в сиворотке
крові антигенів вірусу гепатиту В
(НВsAg, НВеАg) і антитіл до
них (рис.
3, таблиця. 454.
етоди
лабораторнох
діагностики
основани на визначенні в сиворотке
крові антигенів вірусу гепатиту В
(НВsAg, НВеАg) і антитіл до
них (рис.
3, таблиця. 454.
Рис 45. Специфічніе маркери гепатиту В
Виявлення вирусних антигенів у фекаліях, крові і матеріалі біопсії печінки проводять за допомогою антитіл, помічених флюоресцеином.
Більше чутливий метод - виявлення ДНК ВГВ в зразках.
Серологічні дослідження включають визначення антигенів і антитіл за допомогою методів ІФА
Таблиця 2
Серологичні маркери при диагностиці HBV – інфекції
Клиническая форма
|
Маркери інфекції |
||||
HbsAg
|
HBeAg |
anti-HBc |
anti-HBe |
anti-HBs |
|
Гострий ГВ. Розпал хвороби |
+ |
+ |
IgM |
- |
- |
Гострий ГВ. Реконвалесценція. |
- |
- |
IgG, IgM |
- |
+ |
Хронічний ГВ. Активний проце |
+ |
+ |
IgG |
- |
-(+) |
Хронічний ГВ. Ремйсія. |
+ |
- |
IgG |
+ |
-(+) |
«Коровське окно» при гострому ГВ. |
- |
|
IgМ |
|
- |
Хронічне носійство з низькою реплікацією вірусу |
-, , + |
- |
IgG |
|
- |
Поствакцинальна реакція |
- |
- |
- |
- |
+ |
На наявність "свіжої" інфекції вказиваютб високі титри НВsAg і IgM до НВsAg і НВcAg. У хворих з гепатитом, що клінічно проявляється, титр НВsAg спочатку росте, а потім (у міру розвитку імунних реакцій) знижується. Антитіла до НВsAg можна виявить тільки через нескоько тижнів що пояснюється їх активним зв'язуванням в імунні комплекси. Впродовж цього періоду, т.з. "вікна" можна виявити лише антитіла до НВсAg.
Виявлення НВеAg у пацієнтів з явними ознаками хронічного гепатиту вказує на активацію процесу і подібні особи представляють високу епідемічну небезпеку.
Тестові питання
Роком народження врусології вважається
1865 рік
1892 рік
1948 РІК
Д.І. Івановський довів, що
Віруси мають один тип нуклеїнової кислоти
Віруси здатні до розмноження половим шляхом
Віруси мають розміри значно менші за розміри бактерій та здатні до розмноження виключно у тканинах організму
Вірусна частка, на її кінцевій стадіі утворення, має назву
віріон
вірус
віроїд
вірусоїд
Оболонка вірусу, що побудована з ідентичних субодиниць, має назву
капсид
нуклеокапсид
суперкапсид
мембрана
Терміном “віріон” позначається
Нуклеїнова кислота віруса в інтегрованому з геномом клітини стані
Заключна форма розвитку вірусу, яку він має виходячи із клітини
Зовніщня оболонка вірусу з антигенними комплексами
Віроїди – це
Дуже маленькі білкові молекули, що входять ло складу оболонок складних вірусів
Збудники особливо небезпечних хвороб нільських крокодилів
Одноланцюгові, кільцева РНК, не здаатна до трансляції, є збудником багатьох хвороб рослин
Пріони є збудниками
гострих респіраторних захворювань корів
губчастих енцефалопатій людини та тварин
хвороб кишково-щлункового тракту людини
Пріони інактивуються
Ультрафіолетовим опроміненням на протязі 15 хвилин
хлораміном на протязв 5 хвилин
Автоклавуванням при 136 градусах на протязі 18 хвилин /
2% розчином питної соди
Пріонові інфекції
Стимулюють утворення антитіл
Порушують функції клітинних мембран
Індукують продукцію інтерферону
Пріонові інфекції НЕ передаються
Повітряно-крапельним шляхом
Аліментарним шляхом
Трансфузіонним шляхом
Комахами
Виникнення губчастих енцефалопатій НЕ пов’язано з
Мутацією гену PrP
Поглинанням пріонових білків з їжею
Трансдукцією за допомогою вірусів
Віруси НЕ мають власних
Систем біосинтезу білків та виробництва енергії
Ферментів
Двонитчастих РНК
Метілювання вірусних геномів забезпечує
Початок транскрипції
Захист від клітинних рестриктаз
Позначає кінцеву ділянку транскріпції
Віроїди розмножуються
Автокатилізом
Поділом навпіл
Шляхом спороутворення
Пріони являють собою
Нуклеопротеїд
Глікопротеїд
Ланцюг з амінокислотних залишків
Пріони є збудниками
гострих респіраторних захворювань корів
губчастих енцефалопатій людини та тварин
хвороб кишково-щлункового тракту людини
Пріони інактивуються
Ультрафіолетовим опроміненням на протязі 15 хвилин
хлораміном на протязв 5 хвилин
Автоклавуванням при 136 градусах на протязі 18 хвилин /
2% розчином питної соди
Пріонові інфекції
Стимулюють утворення антитіл
Порушують функції клітинних мембран
Індукують продукцію інтерферону
Пріонові інфекції НЕ передаються
Повітряно-крапельним шляхом
Аліментарним шляхом
Трансфузіонним шляхом
Комахами
Виникнення губчастих енцефалопатій НЕ пов’язано з
Мутацією гену PrP
Поглинанням пріонових білків з їжею
Трансдукцією за допомогою вірусів
Віроїди розмножуються
Автокатилізом
Поділом навпіл
Шляхом спороутворення
Одноланцюгові, некодуючі послідовності РНК, що викликають захворювання рослин, мають назву
віроїди
віруси-сателіти
віруси
віріони
Віроїди у клітинах розмножуються
автокаталізом та з використанням ферментніи систем клітин
за допомогою ферментів клітин
абіогенним синтезом
поділом навпіл
брунькуванням
Віруси НЕ мають власних
Систем біосинтезу білків та виробництва енергії
Ферментів
Двонитчастих РНК
Метілювання вірусних геномів забезпечує
Початок транскрипції
Захист від клітинних рестриктаз
Позначає кінцеву ділянку транскріпції
Капсид з ув'язненою в ньому нуклеїновою кислотою віруса – геномом має назву
нуклеокапсид
суперкапсид
капсид
нуклеоїд
Пріонові інфекції НЕ передаються
повітряно-крапельним шляхом
половим шляхом
аліментарним шляхом
ентеральним шляхом
вертикальним шляхом
Пріони інактивуються
2 % розчином питної соди
автоклавуванням при 120 градусах протягом 1,5 годин
96 % етанолом
ультрафіолетовим опроміненням протягом 15 хвилин
розчином хлораміну
Виникнення губчастих енцефалопатій НЕ пов’язано з
трансдукцією пріонів за допомогою вірусів
хворобами вірусного походження
вакуолізацією нейронів
поглинанням пріонових білків з їжею
N- мутацією гена Pr
Пріонові білки відрізняються від нормальних клітинних білків
амінокислотною послідовністю
зменшеним відсотком α-спиральних структур
збільшеним відсотком β-складчастих структур
нечутливістю до дії протеаз
здатністю вікликати імунну відповідю в ураженому організмі
Віроїди розмножуються
Автокатилізом
Поділом навпіл
Шляхом спороутворення
Пріони являють собою
Нуклеопротеїд
Глікопротеїд
Ланцюг з амінокислотних залишків
Пріони є збудниками
гострих респіраторних захворювань корів
губчастих енцефалопатій людини та тварин
хвороб кишково-щлункового тракту людини
Збудники губчастих енцефалопатій являють собою
білок
глікопротеїд
нуклеопротеїд
ланцюг із ліпопротеінів
Терміном “віріон” позначається
N- заключна форма розвитку вірусу, яку він набуває виходячи із клітини
зовнішня оболонка вірусу з антигенними комплексами
нуклеїнова кислота вірусу в стані, інтегрованому з геномом клітини
цитоплазматична нуклеїнова кислота
Лабораторна прижиттєва діагностика губчастих енцефалопатій проводиться за допомогою
тесту на новонароджених мишах
імуно-ферментного аналізу
мікроскопії зрізів головного мозку
полімеразної ланцюгової реакцією
Д.І. Івановський експериментально встановив основні властивості вірусів, такі як
ультрамікроскопічні розміри
здатність до розмноження
репродукцію виключно у живиж організмах
здатність до росту на синтетичних середовищах
мінливість вірусів у процесі культивування
Едвардом Дженером була запропонована і впроваджена дієва вакцина проти
натуральної віспи
сказу
грипу
герпесу
Вакцина та вакцинація проти сказу була запропонована
Луі Пастером
Едвардом Дженером
Ілією Мечниковим
Джоном Ридом
У вірусів відсутні власні
системи біосинтезу білків
системи виробництва енергії
ферменти
дволанцюгові РНК.
сполуки, відмінні від білків та нуклеїнових кислот
До простих, мінімальних вірусів відносяться
вірус гепатиту А
вірус поліоміеліту
вірус мозаїчної хвороби тютюну
вірус грипу птахів
вірус грипу людини
вірус простого герпесу
Віруси, що міcтять дволанцюгову ДНК, за класифікацією Балтімора відносяться до типу
N- I
II
III
IV
Віруси, що містять одноланцюгову ДНК, за класифікацією Балтімора відносяться до типу
ІІ
І
III
IV
Віруси, що містять двохланцюгову РНК, за класифікацією Балтімора відносяться до типу
ІІІ
І
V
IV
Віруси, що містять одноланцюгову (+) РНК, за класифікацією Балтімора відносяться до типу
IV
І
V
ІІІ
Віруси, що містять одноланцюгову (-) РНК, за класифікацією Балтімора відносяться до типу
V
І
ІІ
VІ
Віруси, що містять двохланцюгову ДНК та реплікуються через стадію одноланцюгової РНК, за класифікацією Балтімора відносяться до типу
VІІ
І
ІІ
VІ
Subviral Agents (підвірусні агенти) – це
- віруси - сателіти
віроїди
пріони
фрагменти вірусних геномів
Віруси що містять одноланцюгову молекулу РНК та мають у своєму життєвому циклі стадію синтезу ДНК на матриці РНК – стадію зворотної транскрипції, за класифікацією Балтімора відносяться до типу
VІ
ІІ
ІІІ
VІ
До типу І за класифікацією Балтімора відносяться слідуючі віруси родин
Herpesviridae
Poxviridae
Adenoviridae
Papovaviridae
Papillomaviridae
Coronaviridae
До типу V за класифікацією Балтімора відносяться слідуючі віруси родин
Paramyxoviridae
Rhabdoviridae
Orthomyxoviridae
Papillomaviridae
Coronaviridae
До типу VII за класифікацією Балтімора відносяться слідуючі віруси родин
Hepadnaviridae
Rhabdoviridae
Orthomyxoviridae
Papillomaviridae
Зовнішня (суперкапсидна) оболонка вірусів складається з
білків клітинного походження
білків вірусного походження
глікопротеїдів
ліпопротеїдів
нуклеопротеїдів
Можливість абіогенного синтезу полімерів
була практично доказана
є гіпотезою
теоретично не можлива
практично не встановлена
Молекули РНК, здатні до каталітичної активності, отримали назву
рибозими
РНК-ази
риболази
рибози
Недоліками гіпотези абіогенного синтезу РНК є необхідність у продуктах, утворення яких у безклітинному середовищі не доказано, а саме
залишків фосфорної кислоти
рибози
вільних нуклеотидів
тіміну
РНК-полімерази
Утворення вірусів, згідно сучасних поглядів, можливе
як біогенним, так і абіогенним шляхом
за рахунок гранічного пристосування клітин до паразитизму
з клітинних органел, які мають власні геноми
за рахунок занесення з інших планет
В.М. Жданов вважав віруси «переносниками передового досвіду в біосфері» на підставі
можливості індукувати перенесення і рекомбінацію клітинного генетичного матеріалу
високої мутаційної мінливості вірусів
здатності вірусів до розмноження в організмах різних видів
наявності у вірусів фрагментованих геномів
До біологічних властивостей пріонових білків відносяться
відсутність екліпс-фази
тривалий інкубаційний період (від місяців до десятків років)
хронічна прогресуюча патологія (повільна інфекція)
відсутність запальних реакцій
відсутність гену, якій кодує синтез пріонового білку
До біологічних властивостей пріонових білків відносяться
нечутливість до дії інтерферону
не викликають імунної відповіді
відсутність патогенної дії на клітини in vitro
хронічна прогресуюча патологія (повільна інфекція);
зміна кола хазяїв при пасивуванні
наявність вірусів – переносників пріонових білків
До біологічних властивостей пріонових білків відносяться
відсутність антигенності
розмноження автокаталітичним шляхом
відтворення як в клітині, так і в штучній, безклітинній системі автокаталітичним шляхом
реплікація до титрів 100000 -100000000000 в мозку
зміна кола хазяїв при пасивуванні
стійкість до високих доз ультрафіолетового опромінення
Віруси відмінні від клітинніх форм за слідуючими ознаками
індукують у уражених клітинах синтез інтерферону
ростуть і розмножуються на мінімальному середовищі
здатні до бінарного поділу
чутливі до дії антибактеріальних препаратів
Геном вірусів ізольований від зовнішнього середовища
білковою оболонкою
ліпідною мембраною
гліколіпідами
нуклеопротеїдами
До вірусів з кубічною (ікосаедричною) симетрією відносяться
Iridovirus
Herpesvirus
Adenovirus
Picornaviridae
Papallomavirus
Rhabdovirus
До вірусів з спіральним (паличковидним) типом симетрії відноситься
вірус мозаїчної хвороби тютюну
вірус генітального герпесу
N- вірус імунодефіциту людини
вірус Т2
Мутаційна мінливість вірусів може бути обумовлена
змінами нуклеотидних послідовностей у геномі під час транскрипції
помилками під час трансляції.
системами репарації клітини
рекомбінацією між вірусними геномами поза клітиною
Внутрішніми джерелами формування генофондів вірусних популяцій НЕ є
включення у геном вірусу генетичного матеріалу клітини
рекомбінації між вірусними геномами, що знаходяться у одній клітині.
мутації
робота систем репарації ДНК
У вірусів відсутні власні
системи біосинтезу білків та виробництва енергії
ферменти
дволанцюгові РНК.
сполуки, відмінних від білків та нуклеїнових кислот
Мінливість вірусів грипу людини забезпечується, головним чином
рекомбінаціями між вірусами грипу різних типів
здобуттям вірусами ознак клітини-господаря
помилками під час трансляції вірусних білків
транслокацією генів у геномі вірусу
За допомогою бактеріофагів відбувається явище
трансдукції
трансформації
кон’югації
рестрикції
Метилювання вірусних геномів забезпечує
захист від клітинних рестриктаз
визначає для рибосоми початок трансляції
позначає кінцеву ділянку транскрипції
позначає початок транскрипції
Запрограмований зсув рамки зчитування під час транскрипції іРНК з вірусних ДНК геномів забезпечує
збільшення кількості трансльованих білків вірусного походження
мутації вірусів
послідовний синтез вірусних складових
інтеграцію вірусних та клітинних геномів
Зміна властивостей клітини (організму) під впливом явища трансдукції має назву
конверсія
трансфекція
розбудова
перевтілення
Явище трансдукції забезпечується участю
помірних бактеріофагів
ферментів цитолізу
віроїдів
вірулентних бактеріофагів
Явище трансдукції, під час якого переносятся завжди одні і тиж самі ділянки клітинного геному, має назву
специфічна трансдукція
послідовна трансдукція
неспецифічна трансдукція
банальна трансдукція
Мутаційна мінливість у представників родини ретровірусів (зокрема, ВІЛ) зумовлена головним чином
помилками зворотної транскриптази під час синтезу ДНК
включенням у геном вірусів фрагментів клітинного геному
системами репарації клітини-господаря
генетичною рекомбінацією між представниками різних родин вірусів
В ході специфічної трансдукції бактеріофаг лямбда забезпечує перенос слідуючих генів кишкової палички
gal, bio
pro, tir
lac, trp
exe, doc
РНК вірусів, яка є інформаційною, позначається як
N- «+»
«-»
«:»
«х»
Транскрипція геномів РНК вірусів відбувається за допомогою
РНК - залежних РНК полімераз
РНК - залежних ДНК полімераз
ДНК - залежних РНК полімераз
ДНК - залежних ДНК полімераз
Геном ДНК-вмісних вірусів може бути
N- дволанцюговим
N- одноланцюговим
лінійним
кільцевим
фрагментованим
Перевагою кільцевої структури ДНК вірусів перед лінійною є
стійкість молекули до дії клітинних нуклеаз
компактність упаковки
легкість реплікації
стійкість до дії противірусних препаратів
Присутність інвертованих нуклеотидних послідовностей на кінцях молекул ДНК вірусів забезпечує
здатність молекули замикатися у кільце
стійкість до нуклеаз
чутливість до інтерферону
відмінність вірусів один від одного
Геном РНК вірусів може бути
одноланцюговим
дволанцюговим
лінійним
кільцевим
фрагментованим
цілком складатися з нетранслюючих нуклеотидних послідовностей
Назву «неструктурні білки вірусів» мають білки, що
виявляються в зараженій клітині під час вірусної інфекції
не входять до складу віріону
забезпечують внутрішньоклітинну репродукцію вірусів на різних етапах
забезпечують реплікацію вірусних геномів
забезпечують захіст вірусного геному від зовнішнього середовища
Білки суперкапсидів вірусів представлені
глікопротеідами
нуклеопротеідами
ліпопротеідами
гліколіпідами
фосфопротеїнами
Глікопротеіди на поверхні суперкапсиду складних вірусів беруть участь у
адсорбції вірусів на поверхні клітини
транспорті віруса у клітину
реплікації віруса
виході вірусу з ураженої клітини
Глікопротеіди вірусів використовують у практиці для отримання
противірусних вакцин
сироваток
противірусних лікарських препаратів
протипаразитарних препаратів
Ліпіди у складних вірусів виявляються лише у складі
ліпопротеідної оболонки
запасних поживних речовин вірусів
вірусних ферментів
вірусних ліпаз
Популяційну структуру вірусів і характер процесів визначають слідуючі фактори
велика чисельність популяції
швидка зміна поколінь (в порівнянні з життєвим циклом організмів-господарів)
гаплоїдність та безстатевий спосіб розмноження
мала місткість геномів та відсутність генів, що повторюються
безперервність в динаміці епідемічного процесу
Фактори, що спричиняють зміни вірусних геномів
мутації
рекомбінації
включення в геном генетичного матеріалу клітини-хозяїна
потік генів
репарація геномів
Мутації забезпечують у вірусів
появу генів з новими функціями
перерозподіл генетичного матеріалу
утворення популяцій, поєднуючих властивості вихідних (батьківських) форм
утворення в популяціях однакових за генотипом форм
Антигенний дрейф у вірусів грипу (зміни структури поверхневих антигенів) обумовлюють
точкові мутації генів гемаглютиніну і нейрамінідази
точкові мутації гену гемаглютиніну
точкові мутації гену нейрамінідази
рекомбінації між фрагментами геному
Фермент, який утворює ланцюг ДНК на матриці РНК має назву
РНК-залежна ДНК-полімераза
зворотна транскриптаза
ревертаза
ДНК-полімераза
РНК- транскриптаза
Явище, при якому інфікування одним вірусом клітини повністю блокує можливість реплікації вірусу іншого виду в межах цієї клітини, має назву
гетерологічна інтерференція
гомологічна інтерференція
сімбіотична інтерференція
конверсія
При гомологічній інтерференції реплікація віруса з дефектним геномом можлива при
сумісному зараженні з нормальним вірусом
роботі системи репарації клітини
за допомогою клітинних полімераз
за допомогою зворотної транскрипції
Геном вірусів включає:
структурні гени
регуляторні гени
некодуючі ділянки (сайти)
ділянка attP, що забезпечує інтеграцію вірусного геному в хромосому клітини-хазяїна
ділянки cos - липкі кінцеві ділянки лінійних вірусних хромосом, що забезпечують замикання лінійної хромосоми в кільцеву форму
гени, що кодують рРНК і тРНК
РНК-геномні віруси, окрім ……….розмножуються в цитоплазмі
вірусу грипу і ретровірусів
параміксовірусів
вірусів сказу
вірусів поліоміеліту
Усі ДНК-вмісні віруси, окрім ………., розмножуються в ядрі
вірусу віспи
аденовірусів
вірусів герпесу
вірусів гепатиту В
Віруси, здатні викликати вірогенію (лізогенію), відносяться до групи
помірних
вірулентних
дефектних
незалежних
В основі неспецифічної адсорбції лежить механізм
Ван-дер-Ваальсових сил
закону Авогадро
закону Ньютона
теорії Ломоносова – Лавуазьє
В основі механізму специфічної адсорбції лежить
взаємодія між рецепторами вірусу та клітини
взаємодія між протилежними електричними зарядами
взаємодія між іРНК та рібосомою
взаємодія білків з нуклеїновими кислотами
На ефективність адсорбції вірусу на клітинній мембрані впливає
N- концентрація вірусів
температура
стан клітини
наявність в середовищі електролітів (катіонів) і вільних амінокислот-кофакторів
тканинна специфічність
У рецептосомі (при рецепторному піноцетозі) відбувається взаємодія
поверхневих білків віріонів з ліпідами стінки вакуолі
поверхневих ліпідів віріонів з ліпідами стінки
поверхневих білків віріонів з білками стінки
нуклеопротеідів віріонів з ліпідами стінки
Злиття поверхневих білків віріонів з ліпідами стінки вакуолі призводить до
виходу внутрішнього компонента вірусів в цитоплазму
інактивації віруса
реплікації віруса
депротеінізації віріону
Взаємодія вірусної і клітинної мембран відбувається в більшості випадків при наступних значеннях рН
при низьких (5,0 - 5,5)
при низьких (2,5 – 3,5)
при середніх (6,0 – 6,5)
при високих (8,0 – 9,0)
Інфікування вірусами бактерій реалізується. . . . . . . . . . шляхом
трансфузійним
аліментарним
повітряно-краплинним
статевим
Інформація, записана у вірусному геномі, у різних вірусів може реалізуватися шляхом
перемикання клітини на синтез вірусспецифічних молекул
утворенням коротких інформаційних РНК для індивідуальних білків
використанням вірусом власних геномів як інформаційних РНК
посттрансляційного нарізання білків
трансляції амінокислотної послідовності в нуклеотидну послідовність
Компоненти вірусу синтезуються в клітині
окремо
в одному місті
одночасно
залежно один від одного
Експресія вірусних геномів регулюється на рівні
транскрипції
трансляції
процесінгу
посттрансляційної репарації
Реплікація вірусів з двох ланцюговим (дл) ДНК геномом іде шляхом
(дл) ДНК – іРНК – Білок
(дл) ДНК –(ол) ДНК – іРНК – Білок
(дл) ДНК – рРНК - Білок
(дл) ДНК – тРНК – Білок
Реплікація вірусів з одноланцюговим (ол) ДНК геномом іде шляхом
(ол) ДНК – (дл) ДНК – іРНК – Білок
(ол) ДНК – іРНК – Білок
(ол) ДНК – рРНК - Білок
(ол) ДНК – тРНК – Білок
Реплікація вірусів з дволанцюговими (дл) РНК геномом іде шляхом
(дл) РНК – РНК/ДНК – ДНК/ДНК - іРНК – Білок
(дл) РНК - іРНК – Білок
(дл) РНК–(ол) ДНК - іРНК – Білок
(дл) РНК - тРНК – Білок
Реплікація вірусів з (+)РНК геномом іде шляхом
(+)РНК - Білок
(+)РНК – (-)РНК - Білок
(+)РНК – ДНК - Білок
(+)РНК – (-)РНК – Білок
Реплікація вірусів з (-)РНК геномом іде шляхом
(-)РНК – (+РНК) - Білок
(-)РНК – (+)РНК – ДНК - Білок
(-)РНК – ДНК - Білок
(-)РНК – ДНК – іРНК – Білок
Лімітуючим фактором у формуванні зрілих вірусних часток є
кількість та функціональна активність матриксного білку
ферментативна активність вірусних білків
активність вірусних лігаз
активність клітинних лігаз
Віруси рослин можуть переходити з інфікованої клітини в незаражену
через плазмодесми
шляхом «брунькування»
шляхом «вибуху»
за допомогою формування вакуолі у клітині
Віруси герпесу та респіраторно-синцитіальні віруси можуть проникати в незаражену клітину з інфікованої
через плазмодесми
шляхом «брунькування»
шляхом «вибуху»
за допомогою формування вакуолі у клітині
Вірус, що передається від одного покоління клітин до іншого в ході клітинного поділу в формі латентного вірусного геному, називається
провірусом або, у разі вірусів бактерій, профагом
віроідом
віріоном
вірогеном
Короткий (1 - 3 дні) інкубаційний період буває звичайно в тих випадках, коли вірус розмножується в клітинах
близьких до вхідних воріт інфекції
нервової системи
епітелію
лімфатичної системи
Повітряно-крапельним шляхом можуть передаватися віруси родин
Orthomyxoviridae
Hepadnaviridae
Retroviridae
Poxviridae
Аліментарним шляхом можуть передаватися віруси родин
Picornaviridae
Paramyxoviridae
Retroviridae
Hepadnavirida
Сатевим шляхом можуть передаватися віруси родин
Hepadnaviridae
Paramyxoviridae
Picornaviridae
Orthomyxoviridae
Ентеральним (трансфузійним) шляхом можуть передаватися віруси родин
Retroviridae
Orthomyxoviridae
Picornaviridae
Paramyxoviridae
Вертикальним шляхом можуть передаватися віруси родин
Retroviridae
Picornaviridae
Paramyxoviridae
Orthomyxoviridae
Для доказу того, що захворювання викликається певним вірусом, необхідно виконати так звані постулати
Ріверса
Коха
Пастера
Мечникова
Для доказу того, що захворювання викликається певним вірусом, необхідно виконати так звані постулати Ріверса
Виділити вірус з організму хворого
Культивувати вірус в організмі або в клітинах експеріментальної тварини
Довести фільтрованість інфекційного агента (щоб виключити бактерії)
Відтворити подібне захворювання у представника даного або близького виду
Повторно виділити той самий вірус
Синтез інтерферонів може бути реакцією клітини на
інфікування вірусом
етапом клітинної трансформації
проміжною данкою в процесах дихання
етапом біосинтезу ферментів
Індукторами інтерферону можуть бути
N- РНК віруси
ДНК віруси
бактеріальні ендотоксини
синтетичні полімери
лектини рослин
Метод виявлення специфічних включень в ураженій клітині має назву
вірусоскопічний
серологічний
вірусологічний
молекулярно-гібрідологічний
Найголовнішою перевагою перещеплюваних культур перед первинними є
потенційне безсмерття
гетероплоїдний каріотип
більш висока чутливість до одних і тих самих вірусів
чутливість до більш широкого кола вірусів
Реакція гемаглютинації
проводиться у полістиролових планшетах при безпосередньому контакті вірусних антигенів з еритроцитами
проводиться у дослідах на лабораторних тваринах
проводиться на культурах клітин, заражених гемаглютинуючими вірусами
проводиться на курячих ембріонах
Реакція нейтралізації і гальмування гемадсорбції застосовується для
виявлення вірусних часток безпосередньо у досліджуваному матеріалі за допомогою специфічної сироватки
визначення виду вірусу та його титру за допомогою відомої специфічної сироватки у культурі клітин
визначення вмісту противірусних антитіл у досліджуваній сироватці за відомою титру вірусу у культурі клітин
визначення титру антитіл безпосередньо у досліджуваній сироватці за допомогою стандартного діагностикуму з відомим титром вірусу
Патологічні мітози класифікують за
морфологічними ознаками дегенеративних змін у моношарі клітин
характером пошкоджень клітинних структур
механізмом виникнення патології мітозу
морфологічними ознаками та цитофізіологічними механізмами їх виникнення
Використання курячих ембріонів для культивування вірусів забезпечує
cтерильність середовища для культивування, наочність змін, що виникають, під дією вірусів
можливість диференціювати віруси птахів від вірусів тварин
можливість культивувати виключно віруси курей
можливість диференціювати віруси пташиного грипу від вірусів грипу людини
Реакція гемадсорбції – це
здатність клітин, інфікованих вірусом, адсорбувати на своїй поверхні еритроцити
здатність клітин, інфікованих вірусом, адсорбувати лейкоцити
здатність клітин, інфікованих вірусом, адсорбувати тромбоцити
здатність клітин, інфікованих вірусом, адсорбувати білок-гемоглобін
Титрування виділених вірусів проводять з метою
кількісного визначення вмісту вірусних часток в одиниці об’єму досліджуваного матеріалу
визначення видової приналежності вірусу
виділення вірусів
дослідження морфології вірусів
Імуно-ферментний аналіз (ІФА) – імунологічна реакції між
антигенами вірусу і гомологічними антитілами
антигенами різних вірусів
антитілами різних класів
білками вірусів
Реакція гемаглютинації – феномен зклеювання
еритроцитів
лейкоцитів
лімфоцитів
тромбоцитів
Реакція гальмування гемаглютинації (РГГ) – серологічна реакція, що застосовується для
ідентифікації вірусів
визначення рівня патогенності вірусів
титрування вірусів
визначення хімічного складу вірусів
До серологічного методу діагностики вірусних захворювань, зокрема, відноситься метод
імуно-ферментного аналізу
реакції гемаглютинації
полімеразної ланцюгової реакції
вірусоскопії
Метод виділення вірусів на іонних сорбентах грунтується на
наявності електричного заряду у вірусних часток
виявленні окремих амінокислот, білків вірусів
нуклеотидній послідовності вірусних геномів
ферментативних властивостях вірусних білків
Обробка вірусів із суперкапсидними оболонками (складних вірусів) хлороформом або ефіром призводить до
руйнування вірусів
концентрації вірусів
підвищенню рівня патогенності вірусів
фрагментації вірусних геномів
Вірусоскопічний метод полягае у
виявленні специфічних включень у ураженій клітині
виявленні специфічних клінічних ознак захворювання
виявленні специфічних для данного віруса нуклеотидних послідовностей
виявленні противірусних антитіл
Використання курячих ембріонів для культивування вірусів забезпечує
cтерильність середовища для культивування, наочність змін, що виникають під дією вірусів
можливість диференціювати віруси птахів від вірусів тварин
можливість культивувати виключно віруси курей
можливість диференціювати віруси пташиного грипу від вірусів грипу людини
Реакція гемадсорбції – це
здатність клітин, інфікованих вірусом, адсорбувати на своїй поверхні еритроцити
здатність клітин, інфікованих вірусом, адсорбувати лейкоцити
здатність клітин, інфікованих вірусом, адсорбувати білок-гемоглобін
Титрування виділених вірусів проводять з метою
кількісного визначення вмісту вірусних часток в одиниці об’єму досліджуваного матеріалу
визначення видової приналежності вірусу
виділення вірусів
дослідження морфології вірусів
Ростові середовища для культивування клітинних культур містять
амінокислоти, вітаміни, мінеральні солі, вуглеводи
амінокислоти, вітаміни, сироватку крові ссавців
амінокислоти, вітаміни, вуглеводи, сироватку крові ссавців
вітаміни, мінеральні солі, вуглеводи, сироватку крові ссавців.
Назвіть основні ознаки, які є характерними для патогенезу грипу
повітряно-краплинний шлях передачі
висока контагіозність
вірусемія
розвиток інтоксикацій
наявність вторинної бактеріальної інфекції
аліментарний шлях передачі
Основним неспецифічним фактором захисту організму від вірусів грипу є
інтерферон
вакцинація
антибіотики
активність Т-лімфоцитів
До обов’язкових хімічних компонентів вірусів грипу належать
білки
вуглеводи
нуклеїнова кислота
ліпіди
вітаміни
Найбільш енергетично вигідною структурою при кубічній симетрії вірусної частки є
ікосаедр
октаедр
тетраедр
додекаедр
Вірус грипу належить до родини
Orthomyxoviridae
Picornaviridae
Togaviridae
Retroviridae
Вірус імунодефіциту людини належить до родини
Retroviridae
Rhabdoviridae
Paramyxoviridae
Filoviridae
Вірус Ебола належить до родини
Filoviridae
Picornaviridae
Togaviridae
Retroviridae
Вірус простого герпесу належить до родини
Herpesviridae
Filoviridae
Poxviridae
Herpesviridae
Вірус гепатиту В належить до родини:
Hepadnaviridae
Filoviridae
Poxviridae
Herpesviridae
Які з поданих хвороб є пріонової етіології?
хвороба Крейтцфельда-Якоба
синдром Тернера-Шерешевського
скрепі
куру
коклюш
Основним лабораторним методом виділення і культивування вірусів простого герпесу є
зараженням хоріон-алантоїсної оболонки курячого ембріону
зараженням первинних клітинних культур
зараженням перещеплюваних клітинних культур
зараженням лвбораторних тварин
Вірус гепатиту С відноситься до родини
Flaviviridae
Picornaviridae
Reoviridae
Retroviridae
Заміна типів гемаглютиніну і нейрамінідази (шифт) у вірусів грипу відбувається внаслідок
рекомбінації між фрагментами вірусних геномів
інверсії
точкових мутацій генів гемаглютиніну і нейрамінідази
делецій великих ділянок геному
