
- •Курс лекцій
- •Тема 1. Предмет і значення фізичної хімії
- •Основні визначення і поняття
- •2. Методи фізико-хімічного дослідження
- •3. Основні розділи фізичної хімії
- •Тема 2. Основи хімічної термодинаміки
- •1. Сутність законів термодинаміки. Термодинамічна система і навколишнє середовище
- •2. Термодинамічні процеси. Внутрішня енергія, ентальпія
- •3. Формулювання першого закону термодинаміки. Закон Гесса
- •4. Другий закон термодинаміки. Ентропія. Термодинамічні потенціали. Третій закон термодинаміки.
- •Тема 3. Фазові рівноваги
- •1. Основні поняття і класифікація. Правило фаз Гіббса
- •Класифікація систем
- •3.2 Застосування правила фаз Гіббса до однокомпонентних систем. Загальний принцип побудови діаграм
- •Діаграма стану води
- •Системи з необмеженою розчинністю компонентів у рідкому і взаємною нерозчинністю у твердому стані
- •3.3 Термічний аналіз
- •Тема 4. Електрохімія
- •Електропровідність розчинів
- •2. Гальванічний елемент
- •3. Електроліз, практичне застосування
- •Тема 5. Кінетика хімічних процесів і каталіз
- •Формальна кінетика
- •Молекулярна кінетика
- •Кінетика гетерогенних процесів
- •Масопередача в деяких конкретних процесах
- •Кінетика кристалізації
- •Каталіз
Системи з необмеженою розчинністю компонентів у рідкому і взаємною нерозчинністю у твердому стані
Прикладами систем такого типу є сплави Pb – As, Cd – Bi, Au – Si. Типова діаграма для таких систем представлена на рисунку (3.2), на якому по осі ординат відкладається температура, а на осі абсцис – склад системи.
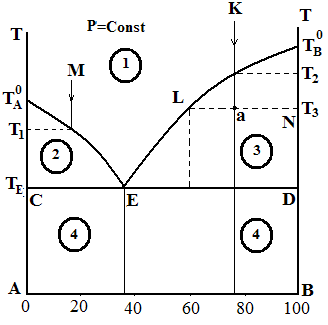
Рисунок 3.2 – Діаграма стану двохкомпонентної металевої системи
Точки Т0А і Т0В відповідають температурам кристалізації (плавлення) чистих компонентів А и В. При цих температурах система інваріантна (С = 1 – 2 + 1 = 0 ).
При температурах вище Т0А і Т0В чисті компоненти знаходяться в розплаві (С =1 –1+1=1), при температурах нижче Т0А і Т0В – у твердому стані (С=1–1+1=1). Якщо до компоненту А додавати компонент В, то температури початку кристалізації компонента А з розплаву будуть нижче Т0А. Аналогічно, додавання компонента А до компоненту В приводить до зниження температури початку кристалізації компонента В з розплаву. Фігуративні точки, що лежать на кривих Т0АЕ і Т0ВЕ, відповідають двофазним системам (кристали чистих компонентів А чи В і насичений розплав). Ці системи є моноваріантними (С=2–2+1=1),тобто кожній температурі відповідає певний склад насиченого розплаву. Криву Т0АЕТ0В називають лінією ліквідусу (від латинського liquor – рідина). Вище лінії ліквідусу система знаходиться в рідкому стані (С=2–1+1=2) у вигляді ненасиченого розплаву. Система двоваріантна, тобто можна незалежно змінювати і температуру і склад.
При охолодженні систем заданих складів (точки М и К) кристалізується компонент А (при температурі Т1) і В (при температурі Т2), що викликає підвищення концентрації іншого компонента, що не кристалізується. Тому фігуративні точки М и К переміщаються по лініях Т0АЕ і Т0ВЕ до точки Е (див. напрямок стрілок). Коли температура кристалізації стане дорівнювати ТЕ, розплав насичується у відношенні обох компонентів, кристалізуються одночасно і А і В і число рівноважних фаз збільшується до трьох, а число ступенів свободи зменшується до нуля.
Температуру, при якій кристалізуються одночасно обидва компоненти, називають евтектичною температурою. Лінію СD, що відповідає евтектичній температурі, називають солідус (від латинського solid – твердий). В точці Е в рівновазі знаходяться одночасно три фази: кристали обох компонентів та розплав (С=2–3+1=0), система інваріантна. Зміна будь-якого параметра призводить до втрати хоча би однієї фази. Ця точка зветься точкою евтектики, їй відповідають певні координати на діаграмі – евтектичний склад та евтектична температура ТЕ.
Лінії ліквідусу і солідусу поділяють діаграму на кілька областей: 1 – не-насичений розплав компонентів А і В; 2 – розплав компонентів А і В і криста-ли компонента А; 3 – розплав компонентів А і В і кристали компонента В; 4 – кристали компонентів А і В – механічна суміш двох фаз.
Розглянемо, які зміни будуть відбуватися в системі при зміні параметрів, що визначають її стан. Простежимо за переміщенням фігуративної точки К під час охолоджування. При початковій температурі система являє собою ненасичений розплав, що містить 75 % В та 25 % А. При охолодженні до температури Т3 стан системи визначається точкою а. Система стане рівноважною, коли в ній виділиться певна маса кристалів В. Для визначення складу рівноважних фаз через точку а проводять ізотерму до перетинання з лініями, що обмежують дану область (точки L, N). Склад рівноважного сплаву визначається точкою L (тому що вона лежить на лінії ліквідусу), склад твердої фази – точкою N. Відбувається відносна зміна мас рідких і твердих фаз, яку можна обчислити за правилом важеля: відношення мас рівноважних фаз обернено пропорційно відношенню відрізків, що відрізаються на ізотермі ординатою загального складу системи:
![]() , (3.27)
, (3.27)
де mp та mкр – маси розплаву та кристалів відповідно; aN та aL довжини відрізків ізотерми NL.
