
- •Курс лекцій
- •Тема 1. Предмет і значення фізичної хімії
- •Основні визначення і поняття
- •2. Методи фізико-хімічного дослідження
- •3. Основні розділи фізичної хімії
- •Тема 2. Основи хімічної термодинаміки
- •1. Сутність законів термодинаміки. Термодинамічна система і навколишнє середовище
- •2. Термодинамічні процеси. Внутрішня енергія, ентальпія
- •3. Формулювання першого закону термодинаміки. Закон Гесса
- •4. Другий закон термодинаміки. Ентропія. Термодинамічні потенціали. Третій закон термодинаміки.
- •Тема 3. Фазові рівноваги
- •1. Основні поняття і класифікація. Правило фаз Гіббса
- •Класифікація систем
- •3.2 Застосування правила фаз Гіббса до однокомпонентних систем. Загальний принцип побудови діаграм
- •Діаграма стану води
- •Системи з необмеженою розчинністю компонентів у рідкому і взаємною нерозчинністю у твердому стані
- •3.3 Термічний аналіз
- •Тема 4. Електрохімія
- •Електропровідність розчинів
- •2. Гальванічний елемент
- •3. Електроліз, практичне застосування
- •Тема 5. Кінетика хімічних процесів і каталіз
- •Формальна кінетика
- •Молекулярна кінетика
- •Кінетика гетерогенних процесів
- •Масопередача в деяких конкретних процесах
- •Кінетика кристалізації
- •Каталіз
Молекулярна кінетика
Предметом молекулярної кінетики є вивчення і пояснення механізму хімічних реакцій. Головні напрямки розвитку молекулярної кінетики пов’язані з вивченням закономірностей протікання елементарного акту.
Елементарним хімічним актом зветься одиничний акт взаємодії або перетворення частинок (молекул, радикалів, іонів, атомів), у результаті якого утворюються нові частинки продуктів реакції або проміжних сполук.
У процесі елементарного хімічного акту відбувається зміна розташування ядер атомів і електронної густини в частинках, у результаті чого рвуться старі і
виникають нові хімічні зв’язки.
Особливості кожного елементарного акту визначаються числом молекул, що беруть участь у ньому, їхньою будовою і характером реакційних центрів. Прийнято вважати, що тривалість елементарного акту визначається часом, протягом якого починається і завершується перебудова молекулярних орбіталей в молекулах, що реагують , (≈ 10–12 ÷ 10–13 секунд).
Одним із перших напрямків у розвитку теорії елементарних реакцій є теорія активних зіткнень. Початок розвитку даної теорії покладено С. Арреніусом. Він висловив ідею про те, що елементарна хімічна реакція відбувається через утворення активних молекул. Сутність теорії розглянемо на прикладі односторонньої реакції другого порядку, що відбувається в розчині при сталому об’ємі:
А + В → продукти реакції.
Швидкість цієї реакції υ = kCACB.
Арреніус припустив, що реакція відбувається за схемою двох стадійного послідовного процесу
А +В → A* + В* → продукти реакції.
На першій стадії (високошвидкісній) молекули А и В стикаються з іншими молекулами і переходять у енергетично збуджений стан А* і В*. Швидкість реакції на другій стадії відносно невелика і лімітує загальну швидкість процесу. Концентрації активних молекул малі, тобто СА>>С*А, і СВ>>С*В. На стадії активності встановлюється рівновага, що визначається константою рівноваги K*С:
![]() (5.3)
(5.3)
Швидкість другої стадії виражається через концентрації активних молекул
![]() (5.4)
(5.4)
Із (5.3) і (6.4) випливає
![]() (5.5)
(5.5)
Оскільки υ = kCAСВ, то kCAСВ = k*K*CCACB і k = k*KC, або
![]() (5.6)
(5.6)
Диференціюванням (5.6) і з урахуванням рівняння ізохори
![]() (5.7)
(5.7)
одержуємо
![]() (5.8)
(5.8)
де ΔН* – теплота процесу активації; Е – ефективна енергія активації.
Енергією активації (або енергетичним бар’єром) Eа називають надлишок енергії в порівнянні із середньою енергією речовин, що реагують, який необхідно мати молекулам для того, щоб зіткнення були результативними.
Енергія активації залежить від природи речовин , що реагують, але не залежить від температури.
Експериментально енергію активації можна визначити, будуючи графік залежності логарифма константи швидкості реакції від зворотної абсолютної температури.
Кінетика гетерогенних процесів
Гетерогенними називаються реакції, які відбуваються між речовинами, що знаходяться в різних дотичних фазах. Такі реакції надзвичайно поширені в
природі і техніці.
Усі хімічні реакції, що відбуваються під час виробництва металів і сплавів, а також під час їх термічної і механічної обробки, є гетерогенними.
Можна навести багато прикладів гетерогенних реакцій, які мають значення в металургійному виробництві:
горіння твердого і рідкого палива;
відновлення твердих окислів газами чи вуглецем;
розподіл речовин між рідкими фазами (метал – шлак, метал – штейн);
процеси розчинення і виділення газів з металу і шлаку;
процеси розчинення твердих тіл у рідинах (наприклад, футеровки сталеплавильних печей у шлаках);
кристалізація рідин (наприклад, твердіння сталевих злитків);
поліморфні перетворення у твердих металах і сплавах.
Відмінною рисою всіх гетерогенних процесів є їхня складність і багатостадійність. Звичайно гетерогенна реакція складається, щонайменше, із трьох стадій.
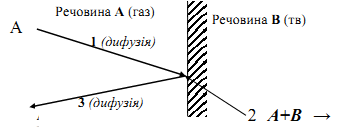
Рисунок 6.11 Три послідовні стадії гетерогенної реакції на прикладі взаємодії газу А з твердою речовиною В
1 – підхід молекул газу до поверхні розподілу; 2 – хімічна взаємодія; 3 – відведення продукту реакції від поверхні розподілу.
Перша стадія являє собою перенесення реагуючих речовин до поверхні
розподілу фаз (до реакційної зони).
Другою стадією є власно гетерогенна хімічна реакція (наприклад, окислювання фосфору, розчиненого в рідкій сталі, киснем що продувається через неї або відновлення оксидів металів воднем).
Нарешті, третя стадія полягає у відводі продуктів реакції з реакційної зони. Оскільки швидкості процесів у всіх стадіях пропорційні величині поверхні, то швидкість гетерогенних реакцій повинні залежати від відношення між величинами поверхні розподілу фаз і об’єму. Стадією, що визначає швидкість всього процесу (контролюючою стадією), є найбільш повільна. Процеси переносу реагуючих речовин, що здійснюються на першій і третій стадіях, називаються масопередачею.
