
- •Курс лекцій
- •Тема 1. Предмет і значення фізичної хімії
- •Основні визначення і поняття
- •2. Методи фізико-хімічного дослідження
- •3. Основні розділи фізичної хімії
- •Тема 2. Основи хімічної термодинаміки
- •1. Сутність законів термодинаміки. Термодинамічна система і навколишнє середовище
- •2. Термодинамічні процеси. Внутрішня енергія, ентальпія
- •3. Формулювання першого закону термодинаміки. Закон Гесса
- •4. Другий закон термодинаміки. Ентропія. Термодинамічні потенціали. Третій закон термодинаміки.
- •Тема 3. Фазові рівноваги
- •1. Основні поняття і класифікація. Правило фаз Гіббса
- •Класифікація систем
- •3.2 Застосування правила фаз Гіббса до однокомпонентних систем. Загальний принцип побудови діаграм
- •Діаграма стану води
- •Системи з необмеженою розчинністю компонентів у рідкому і взаємною нерозчинністю у твердому стані
- •3.3 Термічний аналіз
- •Тема 4. Електрохімія
- •Електропровідність розчинів
- •2. Гальванічний елемент
- •3. Електроліз, практичне застосування
- •Тема 5. Кінетика хімічних процесів і каталіз
- •Формальна кінетика
- •Молекулярна кінетика
- •Кінетика гетерогенних процесів
- •Масопередача в деяких конкретних процесах
- •Кінетика кристалізації
- •Каталіз
3. Електроліз, практичне застосування
Електролізом звуться хімічні перетворення в електрохімічному ланцюзі при пропущенні через нього електричного струму від зовнішнього джерела струму.
Шляхом електролізу можна провести процеси, самодовільне протікання яких, відповідно до законів термодинаміки, неможливо. Наприклад, розкладання НСl на елементи супроводжується зростанням енергії Гіббса і не може протікати самодовільно, однак під дією електричного струму цей процес легко здійснюється.
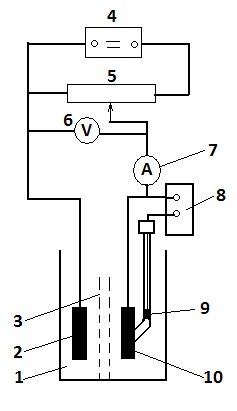
Рисунок 4.2 – Схема електролізера:
1– ячейка для електролізу; 2 – допоміжний електрод; 3 – пориста перегородка; 4 – джерело струму; 5 – реостат; 6 – вольтметр; 7 – амперметр; 8 – потенціометр; 9 – електрод порівняння; 10 – робочий електрод
Для проведення електролізу застосовують установку, що представлена на рис. 4.2. В ячейку 1, розділену на два відділення пористою перегородкою 3, що виключає перемішування розчину, але не перешкоджаючої дифузії іонів, поміщають платинові електроди 10 і 2. Один з них катод, інший – анод. Від джерела струму 4 подають напругу, що регулюють за допомогою реостату 5. Напруга на електродах вимірюють вольтметром 6, а струм – амперметром 7 (міллі- чи мікроамперметром). Потенціали електродів 2 та 10 вимірюють за допомогою потенціометра 8 відносно електрода порівняння 9. У якості останнього використовують каломельний чи хлорсрібний електрод. Електрод 10, на якому відбувається електрохімічна реакція, називають робочим електродом. Другий електрод 4 називають допоміжним. Змінюючи полярність, можна зробити робочий електрод катодом чи анодом.
Напруга U, подавана на електроди, розподіляється між потенціалом анода φА і потенціалом катода φК , тому
U = φА – φК (4.4)
Найменшу напругу, при якої стає можливим електроліз, називають напругою розкладу.
При електролізі на негативно зарядженому електроді (катоді) відбуваються процеси відновлення, наприклад Мz+ + ze– → M0. На позитивно зарядженому електроді (аноді) проходять реакції окислення, характер яких залежить від того, чи здатний розчинятися (окислюватися) металевий анод у конкретних умовах електролізу чи він знаходиться в інертному стані.
Процеси, що відбуваються при електролізі, можна розбити на три групи:
1) електроліз, що супроводжується механічним розкладанням електроліту. Наприклад, при електролізі розчину соляної кислоти з використанням інертного анода йде її розкладання:
катодна реакція 2H++2e– → Н2
анодна реакція 2С1– → Cl2 + 2e–
загальна реакція 2НС1 → Н2 + Сl2;
2) електроліз, що не супроводжується хімічними перетвореннями. Наприклад, при катодному осадженні міді з використанням мідного анода, коли катодний і анодний вихід за струмом однакові;
3) електроліз, у якому беруть участь компоненти електроліту і розчинник. Прикладом може служити електроліз водяних розчинів кисневмісних кислот (наприклад, H2SО4), при якому відбувається розкладання води:
катодна реакція 2H+ + 2e– → Н2
анодна реакція Н2О → 0,5 О2 +2Н+ +2е–
загальна реакція H2O → Н2 + 0,5 О2.
Електроліз є практично єдиним способом виробництва найважливіших металів (Al, Mg). Істотне значення має електроліз розчину NaCl з одержанням хлору, водню і лугу, а також електролітичний спосіб виробництва KMnO4, NaClO, органічних фторпохідних і багатьох інших речовин. Дуже важливим є процес електролітичного рафінування металів (електроліз з розчинним анодом). Електролітичне нанесення металевих покриттів (хромування, нікелювання й ін.) має велике значення для захисту металів від корозії.
