
- •NaCl Natrii chloridum.
- •KCl Kalii chloridum
- •NaBr Natrii bromidum.
- •KBr Kalii bromidum
- •NaI Natrii iodidum
- •Ki Kalii iodidum
- •Количественное определение:
- •Natrii thiosulfas.
- •Natrii hydrocarbonas NaHco3
- •Natrii tеtraborаs seu Borax (бура)
- •Protаrgolum seu Argentum proteinicum
- •Collargolum seu Argentum colloidale
- •Solutio Formaldehydi seu Formalinum
- •Hexamethylentetraminum seu Urotropinum seu Methenaminum
- •Глюкоза
- •Димедрол
- •Calcii gluconas
- •2. Метод нейтрализации.
- •Natrii citras pro injectionibus
- •Natrii hydrocitras pro injectionibus
- •Acidum glutaminicum
- •Acidum aminocapronicum
- •Ephedrini hydrochloridum
- •Резорцин – Resorcinum
- •Acidum benzoicum
- •Acidum salicylicum
- •Natrii benzoas
- •Салицилат натрия – Natrii salicylas
- •Acidum acetylsalicylicum (Aspirinum)
- •Стрептоцид – Streptocidum
- •Норсульфазол –Norsulfazolum seu Sulfathiazolum
- •Phthalazolum-фталазол
- •Anaesthesinum. Aethyliiaminobenzoas
- •Natrii para-aminosalicylas
- •Furacilinum
- •Antipyrinum
- •Analginum.
- •Butadionum
- •Pilocarpini hydrochloridum
- •Dibazolum
- •1. Никотиновой кислоты и никотината аммония не более эталона.
- •Оксиметилпиридиновые витамины ( витамины группы в6)
Natrii tеtraborаs seu Borax (бура)
Na2B4O7*10H2O
Получение:
1.Отчисткой природного минерала тинкала.
2.Обработка горячего раствора борной кислоты или борокальцита раствором корбоната натрия.
CaB4O7+Na2CO3=>Na2B4O7+CaCO3↓
4H3BO3+Na2CO3=>Na2B4O7+CO2↑+6H2O
Свойства Бесцветные, прозрачные,легко выветривающиеся кристаллы или белый кристаллический порошок горько-соленого вкуса. При нагревании плавится в своей кристаллизационной воде. Растворим в воде, очень легко растворим в кипящей воде, практически
нерастворим в спирте, растворим в глицерине с образование раствора кислой реакций среды, водные растворы имеют щелочную реакцию среды.

Подлинность
1.Получение борноэтилового эфира
В выпарительную чашку помешают сухой порошок ( если раствор то выпаривают)+ спирт+H2SO4 конц.
Смесь горит пламенем с зелёной каймой.
2. С куркумовой бумагой – см. борная кислота.
3. На катион натрия – см. хлорид натрия.
Испытание на чистоту.
-не долно быть карбонатов
- не более эталона хлоридов, сульфатов, солей железа и тяжелых металлов, мышьяка.
Количественное определение-метод нейтрализаций (ацидиметрия)
ТНП растворяют в воде, добавляют индикатор м/ор и титруют раствором соляной кислоты с концентрацией 0,1 моль/л до розовато-оранжевого окрашивания раствора.
Na2B4O7 + 2HCl + 5H2O = 4H3BO3 + 2NaCl
Содержание Na2B4O7 99,5-103%
Применение.Антисептическое средство. Несовместим с веществами кислотного характера.
Хранение.В хорошо укупоренной таре.
Элементы 11 группы периодической системы
Magnesii sulfas = Sal amarum = Sal anglicarum MgSO4*7H2O
Получение
Из магнезита MgCO3
MgCO3+H2SO4=>MgSO4+H2O+CO2↑
Полученный раствор выпаривают и очищают многократной перекристаллизацией из воды.
Свойства.Бесцветные призматические кристаллы, выветривающиеся на воздухе,горько-соленого вкуса. Очень легко растворим в воде.практически нерастворим в спирте. Водные разбавленные растворы имеют слабо-кислую реакцию среды, а концентрированные - нейтральные.
Подлинность:
1.На Mg2+ Реактив – гидрофосфат натрия в присутствии аммиачного буфера
Образуется белый мелкокристаллический осадок, растворимый в кислотах.
MgSO4+Na2HPO4+NH4OH=>MgNH4PO4↓+Na2SO4+H2O
2.На SO42+ - раствор BaCl2
MgSO4 + BaCl2 = BaSO4 +MgCl2
Испытание на чистоту:
- не должен быть превышен предел кислотности и щелочности
- водный раствор должен быть бесцветным и прозрачным
- не более эталона мышьяка, солей тяжелых металлов, марганца(для приготовления инъекционных растворов - не д.б. марганца) и хлоридов
Количественное определение-метод трилонометрии.
ТНП помещают в мерную колбу и растворяют в точном объеме воды. Пипеткой берут разведение, прибавляют аммиачный буфер и индикатор кристаллический хром чёрный спец (эриохром чёрный) Титруют раствором трилона-Б с концентрацией 0,05 моль/л до перехода красной окраски в синию.

Если MgSO4 находится в растворе, то в условиях аптеки можно определить методом рефрактометрии.
Применение
1.Внутрь как слабительное средство, желчегонное средство.
2.В виде инъекций как спазмoлитик .
3.Как успокаивающие (снотворное и наркотическое в больших дозах, побочное-угнетение дыхательного центра и антидот при отравлении солями Ca, солями Ba.
4.В виде инъекционных растворов применяется (20-25%).
.Хранение.В хорошо укупоренной таре.
Calcii chloridum CaCl2*6H2O
Получение
Наиболее распространённый минерал кальция является карбонат(мел,известняк,мрамор)
Для получения медицинского CaCl2 используют мрамор, т.к наиболее чистый.
CaCO3+2HCl=>CaCl2+H2O+CO2↑
Т.к мрамору сопутствует железо(II), то для его удаления обрабатывают Cl2, а затем известковой водой. Фильтруют, выпаривают ,затем очищают многократной перекристаллизацией из воды.
2FeСl2+3Cl2=>2FeCl3
FeCl3+Ca(OH)2=>CaCl2+Fe(OH)3
Свойства
Полупрозрачные призматические кристаллы или белый кристаллический порошок без запаха, горько- соленого вкуса. Препарат очень гигроскопичен: во влажном воздухе растворяется (поэтому в виде твердой ЛФ использовать нельзя)
При нагреваний до 200С0 постепенно теряет кристаллизационную воду.
CaCl2*6H2O=>CaCl2*2H2O= CaCl2
Безводный CaCl2 можно использовать как средство для сушки газов и жидкости (кроме спирта)
Растворимость: легко в воде с образованием раствора нейтральной реакции среды(при этом происходит сильное охлаждение раствора), легко в 95% спирте.
Подлинность
1.На Ca2+
1)Крупинка соли внесенного в пламя окрашивает его в красный цвет.
2)Реактив
(NH4)2C2O4
оксалат аммония
Препарат растворяют в воде и прибавляют реактив. Образуется белый мелко кристаллический осадок, растворимый в HCl и HNO3
CaCl2+ (NH4)2C2O4 = CaC2O4( белый мелкокрист. осадок) +2NH4Cl
2.На Cl- см. натрия хлорид.
Испытание на чистоту:
-раствор препарата должен быть бесцветным и прозрачным
- не должен быть превышен предел кислотности и щелочности
- не должно быть растворимых солей бария, железа, алюминия,цинка и фосфатов
- не более эталона сульфатов, солей тяжелых металлов, мышьяка и магния.
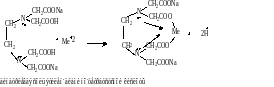
Количественное определение
1.По ГФ-трилонометрия
ТНП (взвешивают в бюксе) помещают в мерную колбу и растворяют в точном объеме воды. Пипеткой берут разведение и переносят в колбу для титрования, добавляют аммиачный буфер и индикатор-кислотный хром темно синий.
! Кислотный хром чёрный специальный брать нельзя т.к неточно фиксируется точка эквивалентности. Титруют раствором трилона Б до перехода красной окраски раствора в темно синюю. Хлорида кальция в препарате должно быть не менее 98%.
NB.В условиях аптеки можно методом трилонометрии навеску берут пипеткой. Если растворы маленькой концентрации, то этот метод более экономичен.
Внутриаптечные методы
1)Аргентометрия по Мору
Титруют раствором AgNO3 по индикатору K2CrO4 до появления оранжево-желтой окраски осадка.
CaCl2+2AgNO3=>Ca(NO3)2+2AgCl↓
2AgNO3+K2CrO4=>Ag2CrO4↓+2KNO3
2)Аргентометрия по Фаянсу
Титруют раствором AgNO3, индикатор - бромфеноловый синий(ПДИ) в присутствии уксусной кислоты до появления сиреневого осадка.
CaCl2+2AgNO3=>Ca(NO3)2+2AgCl↓
4.Метод меркуриметрии (Hg(NO3)2) и меркурометрии (Hg2(NO3)2)
Титруют солями Hg в присутствии азотной кислоты по индикатору ДФК до сине-феолетогого окрашивания.
CaCl2+ Hg(NO3)2=>Ca(HgCl4)+Ca(NO3)2
CaCl2+ Hg2(NO3)2=>Hg2Cl2↓+Ca(NO3)2
5.Если растворы CaCl2 концентрации 3% и выше, то определяют методом рефрактометрии.
Применение. Источник ионов кальция( при недостатке, как кровеостанавливающее средство), антиаллергическое средство, антидот при отравлении солями магния (фармакологические антогонисты)
Хранение.В небольших, хорошо укупоренных стеклянных банках с пробками, залитыми парафином, в сухом месте.
Zinci sulfas ZnSO4*7H2O
Получение:
Чаще всего получают действием H2SO4 на металлический Zn или на ZnO
Zn+H2SO4=>ZnSO4+H2↑
ZnO+H2SO4=>ZnSO4+H2O
(ZnCO3+H2SO4=>ZnSO4+H2O+CO2)
Полученный раствор выпаривают и очищают многократной перекристаллизацией из воды.
Свойства:
Беcцветные прозрачные кристаллы или белый кристаллический порошок без запаха. В сухом воздухе выветривается. Легко растворим в воде с образованием растворов кислой среды. Практически нерастворим в спирте. Медленно растворим в глицерине.
Подлинность:
1.На Zn2+
1)Реактив Na2S (по ГФ,в условиях аптеки нельзя))
Препарат растворяют в воде и прибавляют реактив, образуется белый осадок, нерастворимый в уксусной и растворимый в HCl (проверяют на растворимость только в этой кислоте,т.к. и сульфиды и кислота хлористоводородная проявляют свойства восстановителя и никакие побочные реакции невозможны)
ZnSO4+Na2S=>ZnS↓+Na2SO4
ZnS↓+2HCl=>ZnCl2+H2S↑
Zn2+ в отличии от других катионов тяжелых металлов с Na2S образует белый осадок, а другие металлы будут давать черный осадок.
2)Ферроцианид K=гексацианоферрат (II) калия
С реактивом препарат образует белый студенистый осадок, нерастворимый в HCl, растворимый в избытке щелочи
3ZnSO4+2K4[Fe(CN)6)]=>K2Zn3[Fe(CN)6]2↓+3K2SO4
2.На SO42- - с BaCl2 (см. выше)
Испытание на чистоту:
- не должен быть превышен предел кислотности,
- хлоридов и мышьяка не более эталона
- не должно быть нитратов, солей алюминия, железа, меди, магния и кальция.
Количественное определение-Метод трилонометрии
ТНП помещают в мерную колбу и растворяют в точном объеме воды. Пипеткой берут разведение и помещают в колбу для титрования, прибавляют аммиачный буфер и титруют раствором трилона-Б с концентрацией 0,05 моль/л до перехода красного окрашивания в синее. В фармакопейном методе используют индикатор кристаллический хром черный спец (эриохром черный)
В внутриаптечном методе используют кристаллический хром темно-синий
Содержание ZnSO4 в препорате (99,5%-101%)

Применение. Антисептическое средство в виде глазных капель, антисептическое и вяжущее средство в гинекологической практике. Очень редко может назначаться внутрь как рвотное средство. Несовместим с веществами щелочного характера.
Хранение. сп.Б В хорошо укупоренной таре.
Элементы 1 группы периодической системы
Argenti nitras AgNO3 (уст. ляпис)
Получение:
Растворением серебряного сплава в разбавленной HNO3 (сплав состоит из Ag и Cu)
3Ag+4HNO3=>3AgNO3+NO+2H2O
3Cu+8HNO3=>3Cu(NO3)2+2NO+4H2O
Полученный раствор выпаривают и нагревают при t=201
AgNO3-устойчив,Cu(NO3)2-разлагается
2Cu(NO3)2=>2CuO↓+4NO2+O2
Полученный плав растворяют в воде, фильтруют, фильтрат выпаривают и кристаллизуют.
Получение ведут в темноте, т.к.на свету нитрат серебра разлагается с выделением металлического серебра 2AgNO3 =2Ag+2NO2+O2
Свойства:
Бесцветные прозрачные кристаллы в виде пластинок или белых цилиндрических палочек, без запаха. Очень легко растворим в воде с образованием раствора с pH=7,нерастворим в органических растворителях. При хранении на свету кристаллы темнеют.
2AgNO3=>2Ag↓+2NO2+O2
Подлинность:
1.На Ag+
1)Реактив HCl (или её соли в присутствии разб.HNO3).Образуется белый творожистый осадок, растворимый в аммиаке, нерастворимый в HNO3
AgNO3+HCl=>AgCl↓+HNO3
AgNO3+NaCl=>AgCl↓+NaNO3
AgCl↓+2NH4OH=>[Ag(NH3)2]Cl+2H2O при добавлении раствора азотной кислоты комплекс разрушается:
[Ag(NH3)2]Cl+2HNO3=> AgCl↓+2NH4NO3
2)Реакция “серебряного зеркала”
Препарат растворяют в воде и прибавляют аммиак до растворения образовавшегося осадка, прибавляют формальдегид и нагревают. По стенкам пробирки выделяется Ag
2Ag NO3+2NH4OH=>Ag2O↓+2NH4NO3+H2O
Ag2O↓+4NH4OH=>2[Ag(NH3)2]OH+3H2O
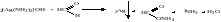
2.На NO3 -
1)ДФА в концентрированной H2SO4
При добавленииреактива к кристаллам нитрата серебра наблюдают синее окрашивание.
В реакции с раствором синее окрашивание быстро исчезает
Испытание начистоту:
- не должен быть превышен предел кислотности
- раствор должен быть бесцветным и прозрачным
- не должно быть солей меди, висмута, свинца ( солей тяжелых металлов)
Количественное определение-Метод осаждения по Фольгарду (роданометрия = тиоцианометрия)
ТНП растворяют в воде и прибавляют индикатор - железоаммонийные квасцы и титруют раствором тиоцианата аммония до красного окрашивания раствора.
AgNO3+NH4SCN=>AgSCN↓+NH4NO3
3NH4SCN+FeNH4(SO4)2=>Fe(SCN)3(кроваво-красное окр.)+2(NH4)2SO4
Применение.Антисептическое, вяжущее и прижигающее средство.Применяют наружно, иногда внутрь.
Хранение.Сп.А В хорошо укупоренных банках с притертой пробкой, в защищенном от света месте. ВРД 0,03 ВСД 0,1
