
- •NaCl Natrii chloridum.
- •KCl Kalii chloridum
- •NaBr Natrii bromidum.
- •KBr Kalii bromidum
- •NaI Natrii iodidum
- •Ki Kalii iodidum
- •Количественное определение:
- •Natrii thiosulfas.
- •Natrii hydrocarbonas NaHco3
- •Natrii tеtraborаs seu Borax (бура)
- •Protаrgolum seu Argentum proteinicum
- •Collargolum seu Argentum colloidale
- •Solutio Formaldehydi seu Formalinum
- •Hexamethylentetraminum seu Urotropinum seu Methenaminum
- •Глюкоза
- •Димедрол
- •Calcii gluconas
- •2. Метод нейтрализации.
- •Natrii citras pro injectionibus
- •Natrii hydrocitras pro injectionibus
- •Acidum glutaminicum
- •Acidum aminocapronicum
- •Ephedrini hydrochloridum
- •Резорцин – Resorcinum
- •Acidum benzoicum
- •Acidum salicylicum
- •Natrii benzoas
- •Салицилат натрия – Natrii salicylas
- •Acidum acetylsalicylicum (Aspirinum)
- •Стрептоцид – Streptocidum
- •Норсульфазол –Norsulfazolum seu Sulfathiazolum
- •Phthalazolum-фталазол
- •Anaesthesinum. Aethyliiaminobenzoas
- •Natrii para-aminosalicylas
- •Furacilinum
- •Antipyrinum
- •Analginum.
- •Butadionum
- •Pilocarpini hydrochloridum
- •Dibazolum
- •1. Никотиновой кислоты и никотината аммония не более эталона.
- •Оксиметилпиридиновые витамины ( витамины группы в6)
Ki Kalii iodidum
Получение.
Бромиды и йодиды получают одинаково. Железные стружки смешивают с водой и приливают избыток йода. Тщательно перемешивают, а затем прибавляют поташ К2CO3. Р-р фильтруют, фильтрат выпаривают.
4 I2+3Fe=>Fe3I8 (FeI2*2FeI3)
Fe3I8+4К2CO3+4H2O=>8КI+Fe(OH)2+2Fe(OH)3+4CO2
Свойства. Бесцветные или белые кубические кристаллы или белый мелкокристаллический порошок без запаха, солено-горького вкуса. Во влахном воздухе сыреет. Очень легко растворим в воде, растворим в глицерине, мало растворим в спирте. Реакция водных растворов нейтральная
Подлинность.
На катион калия.
1) Крупинка соли, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет.
2) Виннокаменая к-та в присутствии ацетата Na или гидротартрат Na.
COOH COOK
HCOH + KBr = HBr + HCOH
HCOH HCOH
COOH COOH (белый кристаллический осадок, растворимый в кислотах)
CH3COONa+HCl=>CH3COOH+NaCl
COONa COOK
HCOH + KBr = NaBr + HCOH
HCOH HCOH
COOH COOH (белый кристаллический осадок, растворимый в кислотах
3)Определение йодидов..
Препарат р-ют в воде, подкисляют HNO3 и + р-р AgNO3. Обр. жёлтый ос. Нерастворимый в HNO3 и NH4OH.
КI+AgNO3=>AgI+ КNO3
AgI+ HNO3=>не растворяется
AgI+ NH4OH=>не растворяется
.I- – сильный в-ль, поэтому его обнаруживают со слабым окислителем – NaNO2 ( нитрит натрия) илиFeCl3( хлорид железа(III)
Препарат растворяют в воде, подкисляют раствором HCl (H2SO4) и добавляют раствор слабого ок-ля и хлороформ. Встряхивают, хлороформенный слой окрашивается в розовый или фиолетовый цвет..
2FeCl3+2KI===>I2+2FeCl2+2KCl
2NaNO2+2KI+4HCl===>I2+2KCl+2NO+2NaCl+2H2O
Испытание на чистоту
1. Не должен быть превышен предел кислотности и шелочности
2.не долно быть карбонатов, йодатов, цианидов,нитратов и растворимых солей бария.
3. не более эталона сульфатов, солей железа, тяжелых металлов и мышьяка.
Количественное определение.
Аргентометрия по Фаянсу (с поверхностнодействующим индикатором).
ТНП, предварительно высушенную(100 С -4 ч.), растворяют в воде, добавляют раствор уксусной к-ты и инд. эозинат натрия(поверхностнодействующий индикатор=ПДИ). Титруют р-ром AgNO3 до :
1)Появления розового осадка
2)Коагуляции осадка (просветление р-ра над осадком).
КI+ AgNO3=>AgI+КNO3
К ind(эозинат натрия)=>К+ind(роз.)

ВАК.
1)Метод меркуриметрии:
ТНП пипеткой помещают в колбу для титрования, подкисляют раствором HNO3 и титруют р-ром Hg(NO3)2 с конц. 0,1 моль/л, без индикатора, до оброзования красно-оранжевого цвета осадка.
4КI+ Hg(NO3)2=>К2(HgI4)+КNO3
(.) К2(HgI4)+ Hg(NO3)2=>2HgI2+2КNO3
(.) 2КI+ Hg(NO3)2=>HgI2+2КNO3
2)Метод меркурометрии.
ТНП пипеткой помещают в колбу для титрования, подкисляют раствором HNO3, добавляют индикатор дифенилкарбазон и титруют раствором онитрата закисной ртути до фиолетовой окраски раствора.
2КI+Hg2(NO3)2=>Hg2I2+2КNO3
Применение. При недостатке йода в организме, при некоторых воспалительных процессах, в глазной практике для лечениякатаракты, глаукомы,кровоизлияниях в сетчатку.(калия йодид более стоек, чем натрия йодид).
Хранение. В хорошо укупоренных банках оранжевого стекла в темном месте.
Solutio Iodi 5% spirituosa = Tinctura Iodi 5%
Состав:
Йода кристаллического – 50,0
Калия йодида – 20,0
Воды и спирта поровну до 1 литра.
Свойства. Прозрачная жидкость красно-бурого цвета с характерным запахом. Смешивается во всех соотношениях с водой и спиртом.
Подлинность.
К 10 мл. воды + 1 кап. р-ра йода и + крахмал => синее окрашивание
Испытание на чистоту.
Т.к. р-р устойчив готовится из чистых в-в, то испытание не проводится.
Количественное определение.
Определение йода и йодидов проходит в одном р-ре.
а)Опредиление йода.
ТНП пипеткой помещают в склянку с притёртой пробкой и титруют р-ром Na2S2O3 до обесцвечивания ( титрование ведут без крахмала, т.к. этот р-р будет использован для определения йодидов и крахмал мешает их титрованию).
I2+Na2S2O3===>2NaI+Na2S4O6 (тетратионат натрия).
б)Определение KI.
Р-р после титрования йода подкисляют CH3COOH, доб. индикатор эозинат натрия(ПДИ) и титруют р-ром AgNO3 до:
- роз. окраски ос.
- коагуляции ос.
KI+ AgNO3=>AgI+KNO3
NaI+ AgNO3=>AgI+NaNO3
% KI=(VAgNO3*K-VNa2S2O3*K)*TAgNO3/KI*100/навеска.
Применение. Антисептическое средство наружно, внутрь- в виде капель в молоке для профилактики атеросклероза.
Хранение. Сп.Б. В склянках оранжевого стекла, в защищенном от света месте. В.Р.Д.20 капель В.С.Д.60капель.
Элементы VI группы периодической системы
AQUAE PURIFICATA(ВОДА ОЧИЩЕНАЯ):
Получение:
Существует несколько способов очистки:
1)дистиляция в асептических условиях:
2)ионный обмен: воду пропускают через специальные смолы-иониты. 3)обратное амотическое давление: Под действием осмотического давления природная вода, оставляя все примеси проходит через полупроницаемые мембраны в виде чистого растворителя.
Испытание на чистоту:
Не должно быть: хлоридов, сульфатов, СО2 , Са2+, тяжёлых металлов, вост. в-ва. ; NH3 не более эталона .сухой остаток после выпаривания не д.б. более 0,001 %. Микробиологическая чистота. Должна соответствовать требованиям на питьевую воду, т.е. не более 100 микроорганизмов в 1 мл, при отсутствии бактерий кишечной палочки и золотого стафилокока.
. Хранят не более 3-х суток.
AQUAE PRO INJECTIONITUS
Получение:
Вода очищенная не пригодная для инъекции, так как она может содержать природные вещества – погибшие микроорганизмы и продукты их жизнедеятельности или распада.Поэтому вода для инъекций должна быть пирогенной. С этой целью свежеперегнанную воду очищенную кипятят в течение 30 минут по ГФ. В настоящее время используют пирогенные электрические перегонные аппараты. Пирогенные вещества нелетучие и не перегоняются с водяным паром. Они могут попасть в дистиллят с капельками воды при бурном образовании пара. Поэтому в аппаратах должен быть встроен брызгоулавливатель.
Вода годна к употреблению не более 24 часов.
Внутриаптечный контроль воды очищенной и воды для иньекции:
Вода очищенная и вода для инъекций ежедневно подвергаются качесвтенному анализу: на отсутствие хлоридов, сульфатов и кальция.
Вода, предназначенная для изготовления стерильных растворов, кроме указанных выше испытаний должна быть проверена на отсутствие востанавливающих веществ солей амония и углерода диоксида. Ежеквартально вода очищенная должна направляется в территориальную КАЛ для полного химического контроля.
Контроль в бактериологической лаборатории:
один раз в квартал – на отсутствие пирогенных веществ.
два раза в квартал – на отсутствие бактерий.
SOLUTIO HYDROGENII PEROXYDI DILUTA (раствор пероксида водорода):
Получение:
электролитический способ. При электролизе концентрированной серной кислоты выделяется надсерная кислота.
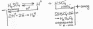
Надсерная (пероксодисерная) кислота устойчива только при очень низких температурах.
При более высоких температурах она подвергается гидролизу с образованием пероксида водорода.
H2S2O8 + 2H2O -> 2H2SO4 + H2O2
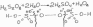
Путем перегонки в вакууме получают раствор перекиси водорода концентрированной или пергидроль (30%). Сведения о концентрированном растворе в ГФ Х в разделе "Реактивы".
Фармакопейный 3% раствор получают путем разведения пергидроля в соотношении 1:10.
Состав: пергидроля 10 г.; антифебрина (бензоата натрия) 0,05 г.; воды до 100 мл.
Приготовление:
В части воды растворяют пергидроль, а в другой части при нагревании растворяют антифебрин, его охлаждают и прибавляют к раствору пергидроля и перемешивают.
Описание: Бесцветная прозрачная жидкость со слабым специфическим запахом. Устойчива в кислой среде, в щелочной - разлагается. H2O2 проявляет окислительно-восстановительную двойственность, поэтому несовместима с веществами-восстановителями и окислителями, разлагается при контакте с солями тяжелых металлов.
Подлинность:
Реакция образования надхромовой( пероксодихромовой ) кислоты
Препарат подкисляют раствором серной кислоты, прибавляют эфир и по каплям р-р дихромата калия. Эфирный слой окрашивается в синий цвет, а окраска водного слоя быстро переходит из синей в зелёную.
K2CrО7 + H2SO4-> H2Cr2O7 + K2SO4
Дихромовая кислота
H2Cr2O7 + H2O2 ->H2Cr2O3 +H2O
Надхромовая кислота
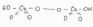
При стоянии синяя окраска переходит в зелёную, Cr+6 переходит в Cr+3:
H2Cr2O8 + 3H2SO4 -> Cr2(SO4)3 + 4H2O + 2O2 ^
Испытание на чистоту
1. Не должен быть превышен предел кислотности.
2. Сухой остаток после выпаривания не более 0,05%
