
- •NaCl Natrii chloridum.
- •KCl Kalii chloridum
- •NaBr Natrii bromidum.
- •KBr Kalii bromidum
- •NaI Natrii iodidum
- •Ki Kalii iodidum
- •Количественное определение:
- •Natrii thiosulfas.
- •Natrii hydrocarbonas NaHco3
- •Natrii tеtraborаs seu Borax (бура)
- •Protаrgolum seu Argentum proteinicum
- •Collargolum seu Argentum colloidale
- •Solutio Formaldehydi seu Formalinum
- •Hexamethylentetraminum seu Urotropinum seu Methenaminum
- •Глюкоза
- •Димедрол
- •Calcii gluconas
- •2. Метод нейтрализации.
- •Natrii citras pro injectionibus
- •Natrii hydrocitras pro injectionibus
- •Acidum glutaminicum
- •Acidum aminocapronicum
- •Ephedrini hydrochloridum
- •Резорцин – Resorcinum
- •Acidum benzoicum
- •Acidum salicylicum
- •Natrii benzoas
- •Салицилат натрия – Natrii salicylas
- •Acidum acetylsalicylicum (Aspirinum)
- •Стрептоцид – Streptocidum
- •Норсульфазол –Norsulfazolum seu Sulfathiazolum
- •Phthalazolum-фталазол
- •Anaesthesinum. Aethyliiaminobenzoas
- •Natrii para-aminosalicylas
- •Furacilinum
- •Antipyrinum
- •Analginum.
- •Butadionum
- •Pilocarpini hydrochloridum
- •Dibazolum
- •1. Никотиновой кислоты и никотината аммония не более эталона.
- •Оксиметилпиридиновые витамины ( витамины группы в6)
Calcii gluconas
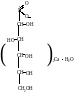
Получение
Соль произв. глюконовой кислоты, которая получается окислением глюкозы. Для того что бы процесс шел в нужном напровлении проводят электролиз раствора глюкозы в присутствии CaCO3 и CaBr2

Свойства. Белый зернистый или кристаллический порошок без запаха и вкуса. Медленно растворим в воде, легко расторим в кипящей воде, практически нерастворим в спирте и эфире.
Подлинность.
1. На Са2+.
а)Крупинка соли внесена в бесцветное пламя, окрашивает его в кирпично-красный
б)оксалат NH4
препарат растворяет в горячей воде, охлаждают и добавляют оксалат аммония. Образуется белый мелкокристаллический осадок, растворимый в азотной и соляной кислоте и не растворимый в уксусной кислоте.
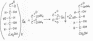
2.На глюконат
Препарат растворяют в воде и добавляют раствор FeCI3 образуется раствор светло-зеленого цвета.
Испытание на чистоту
-по мутности полученный раствор не должен превышать эталон№3
-раствор должен быть нейтральной реакции среды.
-не д.б. декстрина сахарозы
- хлоридов,сульфатов и тяжелых металлов не более эталона
Количественное определение
Метод трилонометрии.
ТНП растворяют в воде , прибавляют аммиачный буфер , индикатор кислотный хром темно-синий, титруют трилоном Б с концентрацией 0,05 моль/л до перехода красной окраски раствора в синюю.
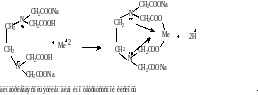
Растворы кальция глюконата в условиях аптеки определяют рефрактометрически.
Применение. Источник ионов кальция, антиаллергическое средство.
Хранение. В хорошо укупоренной таре.
Acidum ascorbinicum (гамма лактон 2,3 дегидро-L-гулоновой кислоты)
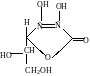
Аскорбиновая кислота обладает кислотными свойствами за счет водорода в OH группе в 3-м положении : за счет ОН группы в 2м и 3м положении обладает свойством сильного восстановителя . Эти свойства используют в химическом анализе.
| о |
С -- ОН = C = О
|| | + 2Н+
С -- ОН С = О
| |
енольная кетонная
(в-ль) (ок-ль)
Для того что бы раствор акорбиной кислоты в процессе хранения или стерилизации не окислялся, добавляют стабилизатор - гидросульфит Na – NaHSO3
Свойства.Белый кристаллический порошок без запаха кислого вкуса. Легко растворим в воде, растворим в спирте, практически не растворим в эфире и хлороформе.
Подлинность
Реакции основаны на сильных восcтановительных свойствах аскорбиновой кислоты.
1. К раствору препарата прибавляют р-р Ag NO3. Образуется осадок черного цвета (серебро)
| |
С -- ОН C = O
|| +2Ag NO3 = | + 2HNO3 + 2 Ag
С -- ОН C = O
| |
2. К раствору препарата прибавляют раствор FeCI3 и раствор K3 [Fe(CN)6] образуется осадок синего цвета
| |
C - OH C = O
|| + 2FeCI3 = | + 2FeCI2 + 2HCI
C - OH C = O
| |
3FeCI2 + 2K3 [Fe(CN)6] = Fe3 [ Fe(CN)6]2 + 6KCI
син.
3. К раствору препарата прибавляют раствор Феллинга, образуется коричнего-красный осадок
| |
C – OH C = O
|| + 2Cu(OH)2 = Сu2O + | + H2O
C – OH C = O
| |
Испытание на чистоту
- не должен быть превышен предел кислотности
- раствор должен быть прозрачным и бесцветным
-хлоридов, сульфатов и солей тяжелых металлов не более эталона.
Количественное определение
1. Метод йодатометрии-по ГФ
Точную навеску препарата растворяют в воде в мерной колбе,берут разведение пипеткой, помещают в колбу для титрования ,подкисляют HCI добавляют 1% KI. Полученный раствор титруют раствором йодата калия с концентрацией 0,1 моль/л до появления синей окраски раствора. Индикатор- крахмал.
| + KIO3 = | + KI +3H2O
C-OH C=O
3 || 3 |
C-OH C=O fаскорбиновой кислоты=1/2
| |
KIО3 + 5KI + 6HCI = 3I2 + 6KCI + 3H2O
2C+ - 2e- 2C+2 в-ль 1/2
2. ВАК
1. Йодометрия.
Точную навеску препарата помещают в колбу для титрования, добавляют крахмал и титруют раствором I2 до синей окраски
! при титровании инъекционных растворов аскорбиновой кислоты надо помнить,что там присутствует стабилизатор NaHSO3 , который также реагирует с I2 для его нейтрализации добавляют раствор формальдегида.
| |
C-OH C=O
|| + I2 = || + 2HI
C-OH C=O
| |
О ОН
// /
C + Na – O - S – OH = H - C – O – S – ONa
/ \ // / //
H H О Н O
