
- •131003 Бурение нефтяных и газовых скважин
- •131018 Разработка и эксплуатация нефтяных и газовых месторождений
- •131003 Бурение нефтяных и газовых скважин
- •Практическая работа n 1
- •Методические указания
- •Содержание работы
- •Практическая работа № 2
- •Методические указания
- •Содержание работы
- •Практическая работа n 3
- •Методические указания
- •1.Глубинные (интрузивные) горные породы
- •2.Излившиеся (эффузивные) горные породы
- •3.Обломочные рыхлые горные породы.
- •4. Обломочные сцементированные горные породы
- •5. Хемогенные горные породы
- •6. Органогенные горные породы
- •7. Метаморфические горные породы зернистые (массивные)
- •Содержание работы
- •Практическая работа № 4
- •Методические указания
- •Содержание работы Порядок построения структурной карты.
- •План расположения скважин
- •Практическая работа № 5
- •Методические указания
- •Содержание работы
- •Исходные, видимые значения параметров элементов залегания слоя, полученные при расчистке одной точки наблюдения:
- •1. Азимут падения 230 градусов; 2. Азимут падения 140 градусов;
- •Практическая работа № 6
- •Методические указания
- •Содержание работы
- •Практическая работа № 7.
- •Содержание работы
- •Практическая работа № 8.
- •Методические указания
- •Содержание работы
- •Практическая работа № 9.
- •Методические указания
- •Содержание работы
- •Практическая работа № 10.
- •Методические указания
- •Содержание работы
- •Пример оформления профиля
- •Практическая работа № 11
- •Методические указания
- •Содержание работы
- •Практическая работа № 12.
- •Методические указания
- •Содержание работы
- •Перечень рекомендуемой литературы и Интернет-ресурсов
Содержание работы
Используя данные таблицы 6.2 вычислите погрешность химического анализа подземной воды, определите ее класс, группу и наименование. Определите вид жесткости подземной воды. Запишите состав воды в виде формулы солевого состава. При решении задачи используйте приложения 1-3.
Таблица 6.2
Данные химических анализов подземных вод
Вариант |
Т, оС |
рН |
Содержание ионов, мг/л |
|||||
НСО3- |
SО42- |
Сl- |
Na+ |
Ca2+ |
Mg2+ |
|||
А |
15 |
5,7 |
293 |
101 |
152 |
218 |
4 |
17 |
0. |
18 |
6 |
408 |
183 |
6245 |
3438 |
499 |
166 |
|
|
23 |
8 |
649 |
231 |
722 |
468 |
34 |
140 |
|
|
32 |
5,1 |
264 |
4846 |
5395 |
131 |
3825 |
767 |
|
|
60 |
7,3 |
992 |
667 |
762 |
736 |
301 |
58 |
|
|
45 |
7,5 |
358 |
110 |
559 |
231 |
224 |
22 |
|
|
85 |
3,1 |
- |
6310 |
1018 |
212 |
1117 |
1204 |
|
|
53 |
4,8 |
1950 |
170 |
210 |
330 |
260 |
180 |
|
|
21 |
5,8 |
930 |
76 |
24 |
93 |
194 |
45 |
|
|
39 |
6,2 |
2330 |
110 |
90 |
490 |
370 |
50 |
|
|
48 |
7 |
3380 |
3400 |
2880 |
4730 |
- |
40 |
Пример решения (вариант А)
Проводят пересчет данных анализа из мг/л в мг-экв/л, используя пересчетные коэффициенты (приложения 6). Результаты записывают в третий и седьмой столбцы табл. 3. Например, содержание в воде гидрокарбонат-иона равно: 293 * 0,0164 = 4,8 мг-экв/л, где 293 мг/л — содержание гидрокарбонат-иона по условию задачи; 0,0164 —пересчетньтй коэффициент для гидрокарбонат-иона.
Для определения погрешности результатов анализа отдельно суммируют содержание анионов и катионов, выраженное в мг-экв форме. Относительная погрешность анализа в нашем случае равна:
х = [|(11,2—11,1|)/(11,2 + 11,1)]*100≈ 0,45%.
3
Анионы |
Содержание |
Катионы |
Содержание |
||||
мг/л |
мг-экв/л |
%-экв |
мг/л |
мг-экв/л |
%-экв |
||
НСО3- |
293 |
4,8 |
43 |
Na+
|
218 |
9,5 |
86 |
SO42- |
101 |
2,1 |
19 |
Ca2+
|
4 |
0,2 |
1 |
Cl- |
152 |
4,3 |
38 |
Mg2+
|
17 |
1,4 |
13 |
Итого |
546 |
11,2 |
100 |
Итого |
239 |
11,1 |
100 |
Затем выражают химический состав воды в %-экв форме, приняв суммы анионов и катионов за 100 % каждую, полученные результаты записывают в четвертый и восьмой столбцы табл. 3.
В связи с тем, что при анализе воды сухой остаток не определялся, вычисляют его приближенно. При выпаривании все негазообразные вещества, кроме гидрокарбонат-иона, переходят в сухой остаток. Гидрокарбонат-ион распадается по уравнению: 2НСО3- СО32- + С02 + Н2О. При этом в виде диоксида углерода и паров воды теряется около 0,5 его массы, точно 0,508. Экспериментально определенный сухой остаток всегда больше вычисленного (с учетом 0,5 НСО3), иногда на 5...12 %. Учитывая это, общую минерализацию (сухой остаток) приближенно вычисляют по формуле:
М =(1,05...1,12)(0,5НСО3- + SО42- + Сl- + Nа+ + Са2+ + Мg2+). (3)
По данным варианта А, М ≈ 1,1(0,5* 293 + 101 +152 + 218 + 4 + 17) ≈ 638 мг/л.
По классификации Щукарева (приложение 7) вода называется хлоридно-гидрокарбонатная натриевая и относится к 26-му классу, группе А.
Далее составляют формулу солевого состава. Формула составляется в виде дроби, в числителе которой записывают анионный состав воды (%-экв) в убывающем порядке, а в знаменателе — катионный. Перед дробью записывают содержание газов и специфических элементов, если они имеются в воде, и общую минерализацию М.
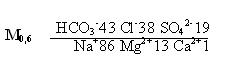
После этого определяют общую жесткость воды как сумму катионов кальция и магния, выраженных в мг-экв/л: 0,2 +1,4 = 1,6 мг-экв/л. С привлечением данных приложения 5, вода данного варианта классифицируется как мягкая.
Вывод: таким образом, название воды: гидрокарбонатно-хлоридно-натриевая, проанализированная вода является пресной, холодной, мягкой, кислой, относится к 26 классу вод и группе А (по Щукареву).
