
- •Протеиды. Хромопротеиды. Опишите структуру гема, приведите формулу.
- •Пентозы и пентозаны. Строение, свойства, содержание в растениях.
- •Ферменты, их активаторы и ингибиторы. Приведите примеры.
- •Физические и химические свойства белков. Полноценный белок.
- •Пектиновые вещества, структура, свойства, использование в пищевой промышленности.
- •Общая характеристика и классификация липидов. Жиры, строение, свойства и распространение в природе.
- •Написать структурные формулы и назвать дипептиды, получаемые из следующих аминокислот: а) гистидина и цистеина, б)триптофана и лизина, в) изолейцина и цистеина, г) серина и глутамина
- •Химические и физические свойства крахмала, гликогена и целлюлозы. Указать черты сходства и различия в строении и свойствах.
- •Витамины. Классификация. Провитамины, антивитамины и антогонисты витаминов.
- •Вторичная структура белка. Типы связей, обеспечивающие ее стабильность. Какие формы этой структуры наиболее распространены в нативных белках?
- •Напишите схему превращения d –глюкопиранозы и d-манопиранозы при мутаротации.
- •Характеристика ферментов класса оксидоредуктаз.
- •Нуклеиновые кислоты. Охарактеризуйте пуриновые и пиримидиновые основания, входящие в состав нуклеиновых кислот.
- •Каротины и каротиноиды. Строение и биологическая роль, содержание в растениях.
- •Ферменты класса оксидоредуктаз. Оксидазы, полифенолоксидазы.
- •Белки. Амфотерные свойства белков. Приведите уравнения, характеризующие амфотерность белков, аминокислот. Иэт белков.
- •Мутаротация углеводов
Физические и химические свойства белков. Полноценный белок.
Белки играют ключевую роль почти во всех биологических процессах. Все ферменты, катализаторы химических реакций в биологических системах, являются белками. Основной структурной единицей белков являются аминокислоты.

Белки представляют собой биополимеры α – аминокислот сочень высокой молекулярной массой (от 5000 до нескольких миллионов).
По составу белки делятся на протеины и протеиды. Протеины – это простые белки, состоящие только из остатков аминокислот.
Протеиды – более сложные белковые образования, в состав которых, кроме белковых веществ, входят еще и остатки небелковых соединений.
Все белки содержат углерод, водород, кислород и азот. Большинство белков содержат, кроме того, серу, а иногда еще и фосфор.
Структура белков очень сложна. Это могут быть просто полипептидные цепи, полипептидные цепи, свернутые в спираль (как у РНК),спирали свернутые в клубок, т.е. белки могут быть первичной, вторичной, третичной и четвертичной структур.
При денатурации (термической и химической - под воздействием кислот, щелочей и солей тяжелых металлов) происходит разрушение третичной и четвертичной структур белка и переход во вторичную и первичную структуру.
Белки построены
по типу полипептидов, так как содержат
повторяющуюся группировку, которая
называется пептидной:
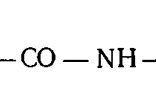
При полном кислотном и ферментативном гидролизе белков образуются аминокислоты, молекулы которых являются «кирпичами» в сложном здании молекулы белка:
Постепенный гидролитический распад белков можно выразить схемой:
Белок Пентоны Полипептиды Аминокислоты
Белки в большинстве случаев почти не имеют свободных карбоксильных групп и аминогрупп. По мере гидролиза белка количество тех и других нарастает, причем число освобождающихся карбоксильных групп равно числу освобождающихся аминогрупп.
При растворении в воде белки образуют не истинные, а коллоидные растворы.
Подобно аминокислотам, белки содержат кислые и основные (амино-) группы, а потому большинство белков обладает амфотерными свойствами и дает соли и с основаниями, и с кислотами. Однако существуют белки, у которых заметно преобладание или кислых или основных свойств. Это объясняется двухосновностью кислот или наличием двух аминогрупп.
Большинство белков обладает амфотерными свойствами и дает соли и с основаниями, и с кислотами:

В присутствии кислот белки несут положительный заряд и при электрофорезе передвигаются к катоду. В присутствии щелочей белки несут отрицательный заряд и передвигаются к аноду. При определенном рН в растворе будет содержаться минимальное количество катионов и анионов белка. При этом значении рН передвижения белка в условиях электрофореза не происходит.
Такая реакция среды, при которой в растворе белка содержится минимальное количество катионов и анионов, называется изоэлектрической точкой (ИЭТ).
Большинство белков животного происхождения имеет изоэлектрическую точку при слабокислой реакции (рН 5-6), но для щелочных белков (гистоны, протамины) ИЭТ находится в щелочной области (рН > 7).
Изоэлектрическая точка является важной характеристикой данного белка.
Существуют также качественные реакции на белки.
Наличие аминокислот с бензольным циклом в составе определяется по желтой окраске с оранжевым кольцом при нагревании белков с концентрированной азотной кислотой и аммиаком.
Наличие свободных гидроксогрупп определяется фиолетовой окраской белка со свежеприготовленным гидроксидом меди (II).
Полноценный белок – белок, содержащий практически все наиболее важные α – аминокислоты L-ряда (их около 20).
