- •Протеиды. Хромопротеиды. Опишите структуру гема, приведите формулу.
- •Пентозы и пентозаны. Строение, свойства, содержание в растениях.
- •Ферменты, их активаторы и ингибиторы. Приведите примеры.
- •Физические и химические свойства белков. Полноценный белок.
- •Пектиновые вещества, структура, свойства, использование в пищевой промышленности.
- •Общая характеристика и классификация липидов. Жиры, строение, свойства и распространение в природе.
- •Написать структурные формулы и назвать дипептиды, получаемые из следующих аминокислот: а) гистидина и цистеина, б)триптофана и лизина, в) изолейцина и цистеина, г) серина и глутамина
- •Химические и физические свойства крахмала, гликогена и целлюлозы. Указать черты сходства и различия в строении и свойствах.
- •Витамины. Классификация. Провитамины, антивитамины и антогонисты витаминов.
- •Вторичная структура белка. Типы связей, обеспечивающие ее стабильность. Какие формы этой структуры наиболее распространены в нативных белках?
- •Напишите схему превращения d –глюкопиранозы и d-манопиранозы при мутаротации.
- •Характеристика ферментов класса оксидоредуктаз.
- •Нуклеиновые кислоты. Охарактеризуйте пуриновые и пиримидиновые основания, входящие в состав нуклеиновых кислот.
- •Каротины и каротиноиды. Строение и биологическая роль, содержание в растениях.
- •Ферменты класса оксидоредуктаз. Оксидазы, полифенолоксидазы.
- •Белки. Амфотерные свойства белков. Приведите уравнения, характеризующие амфотерность белков, аминокислот. Иэт белков.
- •Мутаротация углеводов
Биохимия. Контрольная работа 1
Варианты 10, 21,28, 40, 42, 47.
Содержание
Протеиды. Хромопротеиды. Опишите структуру гема, приведите формулу. 2
Пентозы и пентозаны. Строение, свойства, содержание в растениях. 4
Ферменты, их активаторы и ингибиторы. Приведите примеры. 7
Физические и химические свойства белков. Полноценный белок. 10
Пектиновые вещества, структура, свойства, использование в пищевой промышленности. 13
Общая характеристика и классификация липидов. Жиры, строение, свойства и распространение в природе. 14
Написать структурные формулы и назвать дипептиды, получаемые из следующих аминокислот: а) гистидина и цистеина, б)триптофана и лизина, в) изолейцина и цистеина, г) серина и глутамина 17
Химические и физические свойства крахмала, гликогена и целлюлозы. Указать черты сходства и различия в строении и свойствах. 19
Витамины. Классификация. Провитамины, антивитамины и антогонисты витаминов. 22
Вторичная структура белка. Типы связей, обеспечивающие ее стабильность. Какие формы этой структуры наиболее распространены в нативных белках? 25
Напишите схему превращения D –глюкопиранозы и D-манопиранозы при мутаротации. 34
Характеристика ферментов класса оксидоредуктаз. 36
Нуклеиновые кислоты. Охарактеризуйте пуриновые и пиримидиновые основания, входящие в состав нуклеиновых кислот. 38
Каротины и каротиноиды. Строение и биологическая роль, содержание в растениях. 41
Ферменты класса оксидоредуктаз. Оксидазы, полифенолоксидазы. 42
Белки. Амфотерные свойства белков. Приведите уравнения, характеризующие амфотерность белков, аминокислот. ИЭТ белков. 45
Мутаротация углеводов 47
Протеиды. Хромопротеиды. Опишите структуру гема, приведите формулу.
Белки играют ключевую роль почти во всех биологических процессах. Все ферменты, катализаторы химических реакций в биологических системах, являются белками. Основной структурной единицей белков являются аминокислоты.
По составу белки делятся на протеины и протеиды. Протеины – это простые белки, состоящие только из остатков аминокислот.
Протеиды – более сложные белковые образования, в состав которых, кроме белковых веществ, входят еще и остатки небелковых соединений.
Сложные белки (нуклеопротеиды, липопротеиды, гликопротеины, гемопротеиды, флавопротеиды, металлопротеиды) при гидролизе дают не только аминокислоты, но также и другие органические и неорганические соединения; в некоторых случаях эти соединения называют простетической группой.
Гликопротеины могут содержать нейтральные сахара: галактозу, маннозу и фруктозу, а также аминосахара: N- ацетилглюкозамин, сиаловые и уроновые кислоты.
Липопротеиды содержат триацилглицерины, холестерин и фосфолипиды.
В состав металлоферментов входит либо ион металла, как таковой, либо в виде такого комплексного соединения, как гем.
Примерами могут служить миоглобин, гемоглобин. Гемоглобин, содержащийся в эритроцитах, выполняет функцию переносчика кислорода кровью. Миоглобин облегчает перенос кислорода в мышцах и обеспечивает его накопление в этой ткани.
Особое место среди протеидов занимают нуклеопротеиды. В состав этих белков кроме. аминокислот, входят нуклеиновые кислоты.
Например, ДНК – дезоксирибонуклеиновая кислота. АТФ – аденозинтрифосфат – нуклеотид, состоящий из остатков аденина, рибозы и трифосфата. Активная форма АТФ – это обычно комплекс АТФ с Mg2+ или Mn2+.
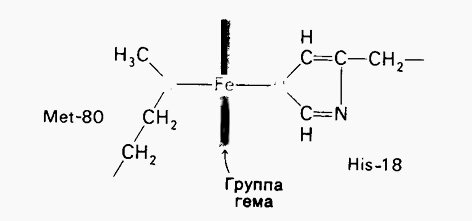
Цитохром –белковый переносчик электронов. Состоит из одной 104-членной полипептидной цепи иприсоединенной к ней ковалентно группы гема.
Способность миоглобина и гемоглобина связывать кислород обусловлена наличием в них неполипептидного компонента, а именно гемма. Гем определяет также красный цвет этих белков. Поэтому их еще называют хромопротеидами («Хромос» - имеющий цвет ). Вообще очень многие белки содержат прочносвязанные специфические неполипептидные компоненты, необходимые для проявления биологической активности. Такие компоненты получили название простетических групп. Белок, лишенный своей простетической группы, называют апопротеином.
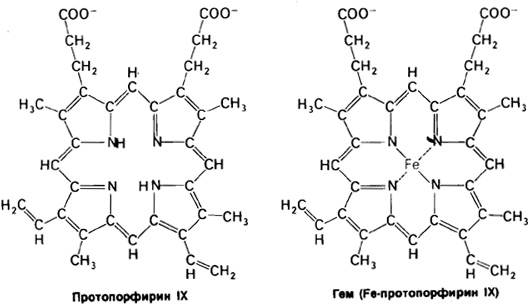
Гем состоит из органической части и атома железа. Органическая часть – протопорфирин – образована из четырех пирольных групп. Четыре пиррола соединяются метиленовыми мостиками, образуя тетрапирольное кольцо. К нему присоединены четыре метильные, 2 винильные и 2 пропионатные боковые цепи. Возможны 15 вариантов пространственного расположения этих заместителей. В биологических системах присутствует только один из изомеров, называемый протопорфирин IX.
Хлорофилл представляет собою магнийпорфирин, тогда как гем – является железопорфирином.
Атом железа в геме присоединен к 4 атомам азота в центре протопорфиринового кольца.
Железо может давать еще дополнительные связи – по обе стороны плоскости гемма. Эти направления связей обозначают как пятое или шестое координационные положения. Атом железа в гемме может быть в ферроформе (+2) или ферриформе (+3). Соответствующие формы гемоглобина называют феррогемоглобин или ферригемоглобин. Ферригемоглобин называется также метгемоглобином. Только феррогемоглобин (+2) способен связывать кислород.
Если миоглобин состоит из одной полипептидной цепи, то гемоглобин – из четырех. Эти четыре цепи удерживаются вместе нековалентными связями. Каждая цепь содержит один гемм, и, таким образом, в молекуле гемоглобина имеется четыре участка связывания кислорода.
Атом железа гемовой группы в цитохроме С связан с метиониновой и гистидиновой боковой цепью: