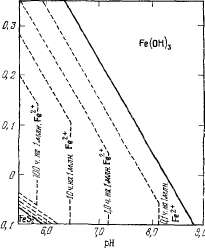
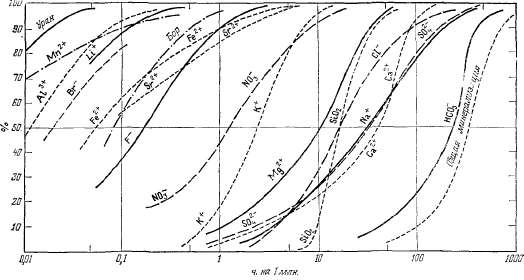
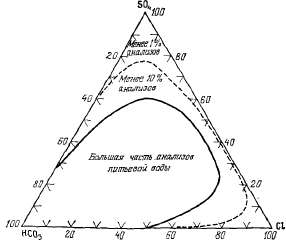
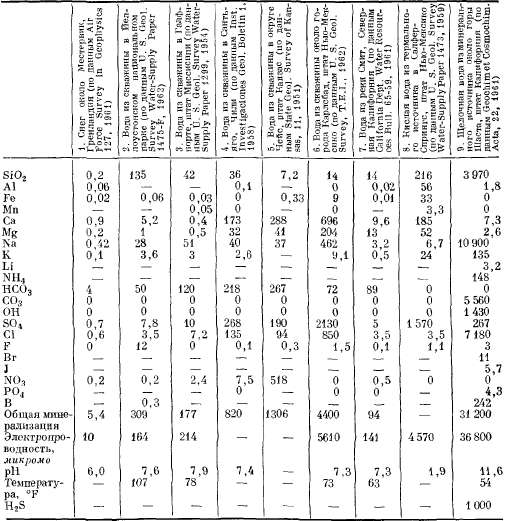
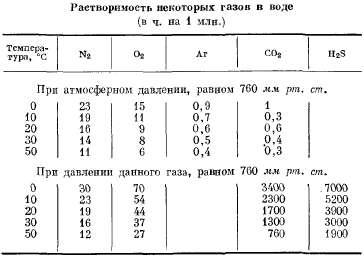
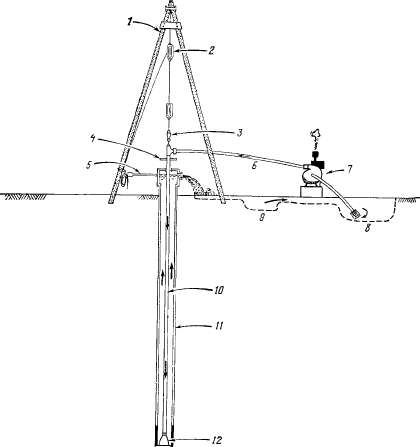
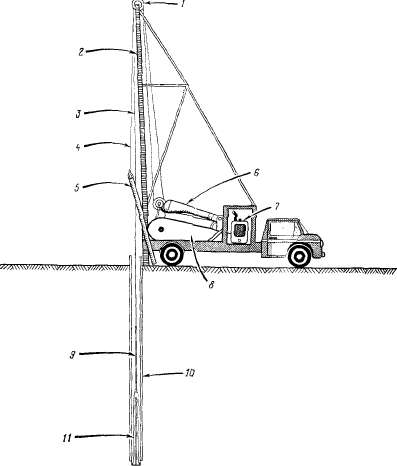
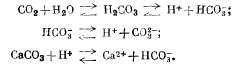Введение
Еще
царь Соломон заметил, что «все
реки текут в море, но море не
переполняется», хотя «реки текут
постоянно» (Ветхий завет, Екклезиаст,
I, 7). В настоящее время причина
этого явления известна даже
школьнику, поэтому мы часто
забываем, что роль испарения и
атмосферных осадков в круговороте
воды не так уж очевидна. Значение
этих факторов не было достаточно
ясным вплоть до наших дней.
Происхождение и движение подземных
вод представлялись древним еще
большей загадкой.
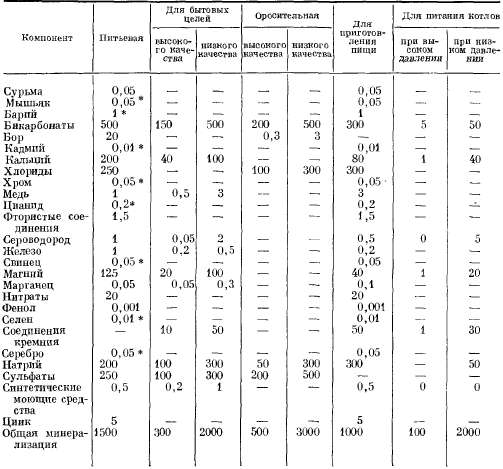
В
настоящее время мы рассматриваем
непрерывное перемещение атмосферных,
поверхностных и подземных вод
как сложную взаимосвязанную
систему, называемую круговоротом
воды в природе, или гидрологическим
циклом (рис. 2.1). Гидрогеолога
интересуют главным образом
подземные воды. Однако, прежде
чем составить точную картину
подземной составляющей
гидрологического цикла, необходимо
понять круговорот воды в целом.
Вода испаряется с поверхности
огромных водоемов — океанов и
туда же возвращается, но этот
процесс не так прост, поскольку
не вся вода в нем участвует. При
внутреннем круговороте вода
испаряется с поверхности материков
и возвращается на землю в виде
атмосферных осадков, чтобы снова
испариться, и т. д. При общем
круговороте вода испаряется с
поверхности океана и образует
облака, которые перемещаются в
глубь континента, водяные пары в
них конденсируются и выпадают на
землю в виде осадков. Затем вода
по рекам и под землей стекает в
океан. В гидрологическом цикле
участвует и небольшое количество
магматической воды, но часть воды
постоянно исключается из круговорота
— это вода, которая входит в
структуру минералов осадочных
отложений. Данные геологических
исследований свидетельствуют о
том, что объем воды в океане почти
не изменился за последние 500 млн.
лет, поэтому общее количество
воды, участвующее в гидрологическом
цикле, также должно оставаться
приблизительно постоянным.
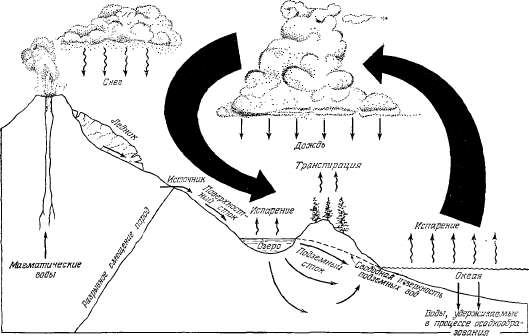
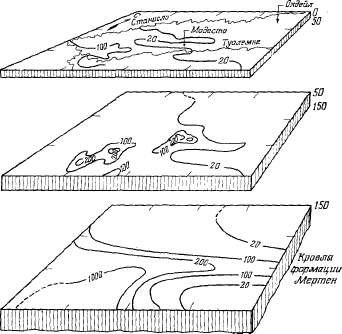
Рис.
2.1. Круговорот воды в природе.
|
|
|
|
Фреатофиты
Многие
растения пустыни экономно расходуют
влагу. Растения эти, называемые
ксерофитами, имеют неглубокую,
но разветвленную корневую систему.
Некоторые же растения пустыни
размещаются вдоль водотоков и на
площадях распространения
относительно неглубоко залегающих
грунтовых вод. Эти растения,
фреатофиты, обладают глубоко
проникающими корнями, достигающими
уровня грунтовых вод. Фреатофиты
распространены и в районах влажного
климата. В настоящее время
экологическая классификация
фреатофитов разработана
недостаточно.
Некоторые
фреатофиты плохо переносят
засоление и, следовательно, могут
служить индикаторами пресных вод
в аридных и полуаридных областях.
Ясень, ольха, ива, тополь, осина —
также фреатофиты. Эти деревья
обычно растут там, где поверхность
грунтовых вод находится на глубине
менее 30 футов.
Значение
фреатофитов в аридных районах
очень велико, поскольку они
потребляют огромное количество
воды. Многие из них приносят мало
пользы или вообще бесполезны,
поэтому вода, поглощаемая ими,
теряется напрасно. Исключение
составляет люцерна (Medicago sativa),
широко распространенный фреатофит,
имеющая большое хозяйственное
значение. Объем воды, бесполезно
расходуемый фреатофитами на
Западе США, составляет около 25
млн. акрофутов, или 30 млрд. кубических
метров в год. Общее количество
воды, бесполезно потребляемое
фреатофитами в аридных и полуаридных
областях земного шара, во много
раз превышает эту величину.
Количество
воды, потребляемое фреатофитами,
зависит от вида растения, плотности
растительного покрова, климатических
и гидрологических факторов. Из
климатических факторов солнечный
свет, температура и влажность
наиболее важны. При отсутствии
солнечного света или снижении
температуры ниже 40° F транспирация
у некоторых растений почти
прекращается. Другие растения
испаряют влагу в небольшом
количестве ночью, но прекращают
транспирировать при падении
средненедельной температуры
воздуха ниже 65° F. При повышении
относительной влажности транспирация
уменьшается.
Из
гидрологических факторов, влияющих
на потребление воды фреатофитами,
важнейшие — глубина до воды и
качество воды. Потребление воды
многими растениями обратно
пропорционально глубине до
поверхности грунтовых вод. Так,
потребление воды некоторыми
растениями может удвоиться при
повышении уровня воды, например
с глубины 140 см до 70 см. Качество
воды влияет на размер транспирации
в зависимости от вида растения.
По мере роста минерализации воды
большинство растений снижает
потребление воды. Однако некоторые
растения, например солянки, хорошо
развиваются, если вода имеет
минерализацию в несколько тысяч
частей на миллион.
Транспирационные
потери точно определяют в больших
вегетационных сосудах, поступление
воды в которые измеряется. К
сожалению, транспи-рацшо больших
деревьев нельзя измерить с их
помощью, так как для последних
требуются вегетационные сосуды
огромных размеров.
Если
водоносная среда в зоне поверхности
грунтовых вод обладает однородным
составом, транспирацию можно
изучать с помощью наблюдений за
изменениями уровня воды в неглубоких
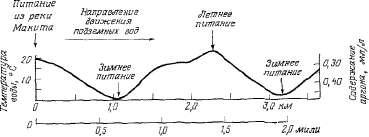
колодцах. На рис. 2.2 показан ночной
подъем уровня грунтовых вод,
вызванный восполнением их в период
отсутствия транспирации. Поскольку
колебания уровня воды незначительны
по сравнению с общей энергией
движения воды и мощностью одно
родного
водоносного слоя, максимальная
скорость подъема уровня воды,
отраженная на графике, близка к
скорости движения воды, постоянно
поступающей в район водоотбора.
Таким образом, объем потребляемой
воды приблизительно равен
произведению максимальной скорости
подъема уровня воды и общей площади
открытого порового пространства
водоносного слоя. На графике (рис.
2.2) видно, что скорость восстановления
уровня грунтовых вод равна 1,5
мм/час, а величина = 0,2 мм/час.
Скорость восстановления
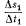 уровня
Vtp
с учетом устойчивой
уровня
Vtp
с учетом устойчивой
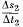 тенденции
в изменении запасов подземных
вод
тенденции
в изменении запасов подземных
вод
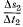 ,
вызванном транспирацией, может
быть представлена как
,
вызванном транспирацией, может
быть представлена как
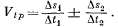 (2.1)
(2.1)
В
условиях, показанных на рис. 2.2,
Vtp
= 1,5 + 0,2 = 1,7 мм/час.
Количество
воды q, проходящее через единицу
площади, получают умножением
величины Vtp
на величину Ne
(площадь пор единицы поперечного
сечения в зоне около поверхности
грунтовых вод), равную 0,15:
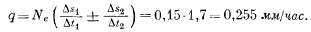
Если
растительность однородна по всей
площади А = 40000 м2
(рис. 2.2), то потребление воды
растениями равно Q = qA = 0,000255 м/час·40
000 м2
= 10,2 м3/час
= 2690 галл/час.
В
случае неоднородности растительности
надо сделать поправку на изменчивость
плотности растительного покрова
и разнообразие его состава.
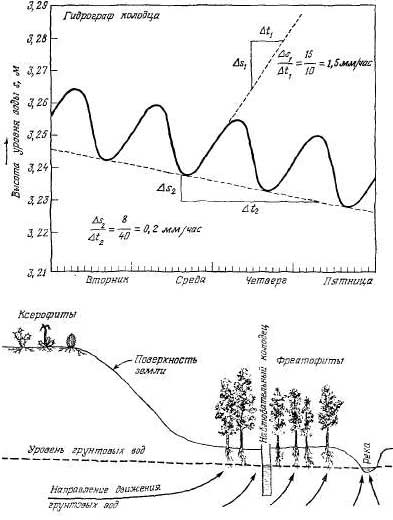
Рис.
2.2. Суточные колебания уровня
грунтовых вод в наблюдательном
колодце, вызванные транспирацией
фреатофитов.
Количество
воды, потребляемое растениями
при большой плотности растительного
покрова, изменяется от менее 1
фута в субарктических областях
до более 7,5 фута за год в жарких
засушливых районах. Как показали
измерения, наибольшее количество
воды испаряет тамариск (Tamarix
gallica), произрастающий в Европе и
Азии. Обширные наблюдения,
проведенные в штате Аризона,
показали, что тамариск расходует
270 см воды за год при глубине
залегания поверхности грунтовых
вод 123 см. В табл. 2.1 приведены
типичные величины транспирации
различных фреатофитов.
Существует
несколько способов сохранения
подземных вод, потребляемых
бесполезной растительностью. При
неглубоком залегании грунтовых
вод их уровень понижают с помощью
скважин вертикального дренажа,
в результате чего большинство
трав и кустарников-фреатофитов
погибает. Дренажная вода может
быть использована для какой-либо
цели. Некоторые растения уничтожаются
гербицидами, выжиганием и
механической расчисткой. При
успешном проведении этих мероприятий
очищенную площадь можно засадить
полезными фреатофитами, такими,
как люцерна. Однако темп роста
некоторых вредных растений
настолько велик, что очистка
территории от них представляет
большую трудность. Например,
экземпляр тамариска дает более
500 тыс. семян ежегодно. Многие из
этих семян быстро прорастают и в
течение менее чем пяти лет дают
джунглиподобную поросль. По
берегам реки Пекос в период
1912—1952 гг. тамариск разрастался
со средней интенсивностью 3 км2
в год.
Таблица 2.1 Количество воды,
потребляемое густорастущими
фреатофитами
Название
фреатофита
|
Климат
|
Глубина
до воды, см
|
Годовое
потребление воды, см
|
Тамариск
(Tamarix gallica)
|
Теплый
сухой
|
123
|
270
|
Теплый
сухой
|
213
|
224
|
Кустарниковая,
заросль из Sacrobatus vermiculatus
|
Холодный
сухой
|
50
|
66
|
Ива
(Salix)
|
Теплый
сухой
|
61
|
134
|
Тополь
(Populus)
|
Теплый
сухой
|
220
|
238
|
Люцерна
(Medicago sativa)
|
Холодный
сухой
|
91
|
80
|
Ольха
(Alnus)
|
Теплый
сухой
|
138
|
113
|
Теплый
сухой
|
—
|
162
|
|
|
Сток
Термин
сток обычно понимается как синоним
термина речной сток и означает
сумму поверхностного стока и той
части подземного стока, которая
поступила в реки. Поверхностный
сток равен осадкам за вычетом
поверхностного задержания и
инфильтрации, представляющей
собой проникновение или движение
воды в грунт. Инфильтрацию
необходимо отличать от подземного
стока. Для понимания зависимости
между осадками и стоком, имеющей
первостепенное значение, в
частности при гидротехническом
строительстве, надо уяснить роль
стока в гидрологическом цикле.
Поверхностный
сток зависит от интенсивности и
распределения осадков,
водопроницаемости поверхности
земли, продолжительности осадков,
вида растительности, площади
водосборного бассейна, характера
гидрографической сети, глубины
залегания подземных вод и уклона
поверхности земли. Несмотря на
такую сложную зависимость,
гидрологи могут дать осмысленный
анализ данных о стоке и во многих
районах довольно точно прогнозировать
поверхностный сток, ожидаемый от
любого ливня. Обычно поверхностный
сток характеризуют и виде
гидрографа.
|
|
Инфильтрация
Роль
инфильтрации в гидрологическом
цикле впервые описана Хортоном.
Он определяет инфильтрационную
способность почвы как максимальную
скорость, с которой почва может
поглотить атмосферные осадки в
данных условиях.
Способность
почвы пропускать воду, или «о
гидравлическая проводимость,—
величина переменная. Если почва
сложена хорошо отсортированными
песком или гравием, ее влагопроводность
будет высокой и со временем
изменится незначительно. Но многие
слоистые рыхлые отложения на
поверхности земли образуют систему
слоистости, называемую почвенным
профилем (рис. 2.3). Почвенный профиль
формируется под влиянием химического
выветривания и деятельности
организмов. В полном почвенном
профиле горизонт А значительно
более проницаем, чем горизонт Б,
который обычно содержит значительные
количества глинистых и коллоидных
частиц. Горизонт В разбит трещинами,
в результате чего образуются
агрегаты призматической формы.
Когда почва суха, трещины более
или менее открыты, но но мере
насыщения инфильтрующейся водой
глина и коллоиды набухают и трещины
затягиваются. Таким образом, почва
имеет высокую влагопроводность
в начале инфильтрации, которая
постепенно уменьшается к концу
этого процесса.
На
начальной стадии инфильтрации
воздействие капиллярных сил на
воду имеет очень большое значение.
После продвижения фронта
инфильтрации более чем на два-три
фута действие капиллярных сил в
средне- и грубозернистой почве
незначительно. В тонкозернистых
почвах роль капиллярных сил
наиболее значительна при низких
величинах начальной влажности.
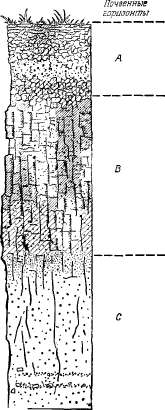
Рис.
2.3. Почвенный профиль, сформированный
на песчаном аллювии (горизонт С).
Обогащенный
глиной горизонт В препятствует
инфильтрации влаги. Вначале вода
в почву поступает довольно
интенсивно, но по мере увлажнения
и набухания глины поры почвы
затягиваются и скорость инфильтрации
снижается.
При
инфильтрации заметную роль играет
защемленный воздух. Вначале фронт
инфильтрующейся воды продвигается
неравномерно и защемленный воздух
вытесняется в различных точках.
Скорость инфильтрации падает,
поскольку затрачивается много
энергии на вытеснение воздуха из
пор почвы. По мере продвижения
насыщенного фронта остаются языки
сухой почвы, препятствующие
движению воды, но в результате
непрерывного поступления воды
часть почвенного воздуха
растворяется и скорость инфильтрации
увеличивается. Это явление
наблюдается на первом этапе
инфильтрации (рис. 2.4).
Вторичное
увеличение скорости инфильтрации
отмечается во многих, но не во
всех опытах с различными почвами.
Скорость инфильтрации возрастает,
возможно, в результате растворения
воздуха, первоначально защемленного
в почве.
1
— снижение скорости инфильтрации
вследствие набухания глинистых
частиц и коллоидов, а также
недостаточного действия капиллярных
сил натяжения;
2
— повышение скорости инфильтрации
вследствие постепенного растворения
почвенного воздуха;
3
— снижение скорости инфильтрации
в результате деятельности живых
организмов на поверхности почвы
и около нее.
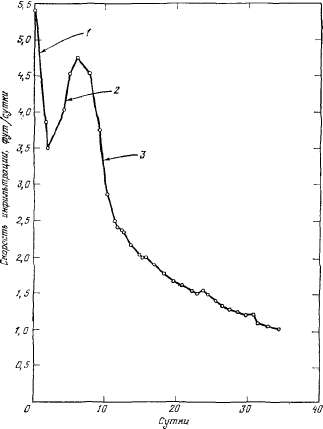
Рис.
2.4. Скорости инфильтрации в образце
почвы при подаче воды за период
более месяца.
Состояние
почвы также имеет большое значение
для инфильтрации. Поверхность
голой почвы непосредственно
подвергается ударам дождевых
капель. Дождь уплотняет почву, а
также смывает мелкие частицы в
открытые трещины и отверстия.
Таким образом во время дождя
инфильтрация в почву, лишенную
растительности, уменьшается.
Густой растительный покров
защищает поверхность почвы от
уплотнения и препятствует переносу
частиц почвы каплями дождя. Корни
растений также сохраняют пористость
почвы и способствуют инфильтрации.
Температура
воды влияет на ее вязкость, от
которой в свою очередь зависит
скорость инфильтрации. Это явление
хорошо наблюдается на опыте с
искусственной инфильтрацией
большой продолжительности. При
равенстве прочих условий
инфильтрация изменяется обратно
пропорционально вязкости и прямо
пропорционально температуре.
Однако инфильтрация осадков
зависит главным образом от других
факторов.
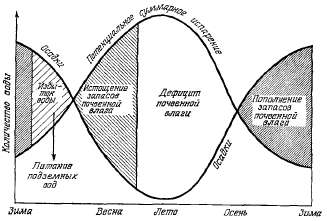
Рис.
2.5. Влияние потенциального
суммарного испарения на запасы
почвенной влаги в районе с небольшим
количеством летних осадков или
без них.
Количество
воды, достигающее водоносного
горизонта в региональном масштабе,
равно общей величине инфильтрации
за вычетом количества воды,
поглощенного почвой. Следовательно,
влажность почвы перед началом
инфильтрации — важный фактор,
влияющий на питание подземных
вод.
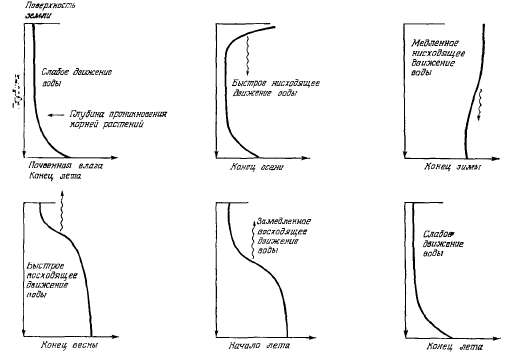
Рис.
2.6. Профили влажности гипотетической
почвы в районе с влажной зимой и
сухим летом.
На
рис. 2.5 показаны условия увлажнения
в районе с годовыми осадками около
20 дюймов. Одна из кривых характеризует
месячные осадки, другая —
потенциальное суммарное испарение.
Принимается, что поверхностный
сток равен нулю. Весной количество
осадков равно суммарному испарению.
По мере снижения количества
осадков и повышения температуры
летом почвенная влага начинает
расходоваться на суммарное
испарение. К середине лета запасы
почвенной влаги истощаются и
потери воды в атмосферу прекращаются.
Дефицит влаги существовал бы даже
при орошении. В начале осени осадки
полностью идут на суммарное
испарение. По мере увеличения
осадков и снижения температуры
образуется избыток влаги, идущий
на пополнение запасов почвенной
влаги. В конце зимы запасы почвенной
влаги превышают величину полевой
влагоемкости, и вода достигает
поверхности грунтовых вод. На
рис. 2.6 изображены вертикальные
профили влажности почвы для
указанных периодов.
|
|
Зона
почвенной влаги
Гидрогеолога
прежде всего интересует подземная
часть гидрологического цикла.
Ниже поверхности земли существуют
все виды воды: от свободно
перемещающейся до входящей в
кристаллическую структуру
минералов. В классических работах
подземные воды подразделяют на
несколько более или менее отличные
друг от друга виды. На рис. 2.7
показаны как общепринятая
классификация подземных вод, так
и классификация, которая помогает
избежать некоторых трудностей в
типизации подземных вод. Между
различными типами подземных вод
нет резкой границы. Например,
почвенная вода отличается от воды
более глубокой части зоны аэрации
лишь тем, что ее запасы и качество
сильно зависят от транспирации
и испарения. В обычной лесной
обстановке корни деревьев могут
достигать глубины более 30 футов.
Следовательно, ниже этой глубины
колебания влаги воды от транспирации
уже не зависят. Содержание влаги
в верхних нескольких дюймах
почвенной зоны также изменяется
вследствие больших изменении
температуры и упругости водяного
пара, вызванных изменением
температур воздуха и почвы. Ночью
в результате больших потерь тепла
почвой посредством излучения на
поверхности земли конденсируется
влага в виде расы и смачивает
самый верхний слой почвы. В теплые
дни вода поступает по капиллярам
на поверхность почвы, где она
испаряется и уносится к результате
движения воздуха.
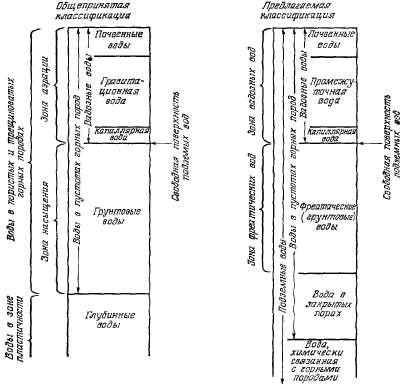
Рис.
2.7. Классификация подземных вод.
|
|
Промежуточная
зона
Между
зоной насыщения и почвенными
водами обычно лежит промежуточная
зона. Вода почвенной и промежуточной
зон называется подвешенной, или
вадозной. Эта вода перемещается
вглубь под действием силы тяжести,
поэтому специалисты называют ее
гравитационной. В настоящей книге
этот термин не используется,
потому что почти все воды движутся
под действием силы тяжести.
Промежуточная зона может
отсутствовать во влажных
климатических условиях и достигать
мощности более 1000 футов в аридных
районах. Коли промежуточная зона
представляет собой изотропную
среду, то при наличии питания
сверху влажность этой зоны обычно
меняется от почти полного насыщения
до удельной влагоемкости. Породы
в естественном залегании редко
бывают однородными, поэтому влага,
идущая на питание подземных вод,
распределяется неравномерно по
промежуточной зоне. Это характерно
для аридных районов, где количество
атмосферных осадков редко превышает
полную влагоемкость почвы. Здесь
питание подземных вод происходит
главным образом за счет фильтрации
через речные русла, сложенные
водопроницаемыми песками и
гравием. Вероятно, во многих
областях промежуточная зона
тысячелетиями не насыщалась в
достаточной степени на всю свою
мощность.
|
|
Капиллярная
кайма
Промежуточная
зона заканчивается снизу капиллярной
каймой. Переход к капиллярной
кайме в грубозернистых осадочных
породах довольно резкий, а в тонко-
и мелкозернистых отложениях —
весьма постепенный. Коли в
мелкозернистом грунте запасы
влаги пополняются интенсивно, то
плажности промежуточной зоны и
капиллярной каймы могут различаться
незначительно. Поверхность
капиллярной каймы неровная, и ее
положение постоянно меняется в
результате колебания уровня воды
и питания. В верхний части
капиллярной каймы содержатся
многочисленные воздушные карманы,
замедляющие движение воды. В
нижней ее части порода насыщена
точно так же, как и ниже свободной
поверхности подземных вод. Кроме
того, физические силы, действующие
на поток жидкости в нижней части
капиллярной каймы, идентичны
силам, действующим ниже свободной
поверхности подземных вод.
|
|
Свободная
поверхность подземных вод
|
|
Свободная
поверхность подземных вод
|
|
Зона
грунтовых, или фреатических, вод
отделена от капиллярной каймы
свободной поверхностью. Последняя
представляет собой теоретическую
плоскость, уровень которой примерно
соответствует высоте уровня воды
в неглубоком колодце, пройденном
в породах зоны насыщения. Если
поток грунтовых вод горизонтальный,
уровень воды в колодце будет почти
совпадать со свободной поверхностью.
Однако сам колодец несколько
нарушает характер потока и,
следовательно, уровень воды в
водоносном горизонте. Часто
свободную поверхность подземных
вод определяют как поверхность,
отделяющую капиллярную кайму от
зоны насыщения, или как поверхность
уровней воды в скважинах, вскрывающих
безнапорный водоносный горизонт.
Более точно свободная поверхность
определяется как поверхность
воды в безнапорном водоносном
горизонте, у которой гидростатическое
давление равно атмосферному.
Сущность этого определения хорошо
видна на рис. 2.8. Гипотетический
манометр А, заполненный водой,
расположен выше земной поверхности,
причем один конец его открыт и
вода в обоих коленах манометра
под действием атмосферного
давления устанавливается на одном
уровне. Манометр Б расположен в
сухой скважине, и один его конец
соединен с ненасыщенной средой
выше капиллярной каймы, что
позволяет видеть действие
капиллярных сил. Уровень жидкости
в открытом конце манометра В
находится в пределах капиллярной
каймы, поэтому гидростатическое
давление в нем ниже атмосферного.
Один из концов манометра Г
расположен на уровне свободной
поверхности, столбики жидкости
в его коленах уравновешены, как
в манометре А. Следовательно, на
свободной поверхности подземных
вод гидростатическое давление
равно атмосферному. Манометр Д
находится ниже свободной
поверхности, в нем гидростатическое
давление выше атмосферного.
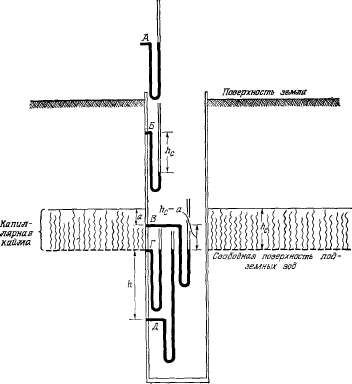
Рис.
2.8. Свободная поверхность подземных
вод в однородной пористой среде.
Положение
свободной поверхности показано
с помощью гипотетических манометров
бесконечно малого диаметра,
заполненных водой и соединенных
с пористой средой за пределами
сухой скважины. Манометр Г
показывает атмосферное давление
и уровень свободной поверхности
подземных вод.
|
|
Зона
фреатических вод
Воду
ниже свободной поверхности
подземных вод обычно называют
грунтовой, а область ее распространения
— зоной насыщения. Однако термины
— грунтовые воды и зона насыщения
— в общем-то ненаучные. Термин
груптовые воды неправильно
применяют для обозначения любых
вод, распространенных ниже
поверхности земли, а термином
зона насыщения обозначают не все
насыщенные водой породы. Чтобы
избежать этой путаницы, воды ниже
земной поверхности следует
называть подземными. Термин зона
насыщения неточен, поскольку
нижняя часть капиллярной каймы
также насыщена водой. Вода в нижней
части капиллярной каймы перемещается
примерно с той же скоростью, что
и вода, находящаяся ниже свободной
поверхности, поэтому нет оснований
сохранять этот термин. Более
приемлем термин зона фреатических
вод, поскольку фреатические воды
определяются как воды, свободно
поступающие в колодцы. Вода
капиллярной каймы заполняет
только откачивающую скважину,
пройденную ниже свободной
поверхности подземных вод.
Зона
фреатических вод переходит в зону
плотных пород, в порах которых
находится некоторое количество
воды, но поры не соединены между
гобой, поэтому в этой зоне нет
движения воды. Глубина до зоны
плотных пород различна в зависимости
от геологических условий. В районах
распространения интрузивных и
метаморфических пород она может
начинаться па глубине менее 10
тыс. футов, в районах распространения
мощных осадочных пород — около
50 тыс. футов. Глубже 100 тыс. футов
температура и давление так велики,
что открытые поры не могут
существовать и вода может быть
только химически связанной.
|
|
Водоносные
горизонты
Обычно
лишь небольшая часть зоны
фреатических вод может дать
значительные количества воды в
скважины. Такие водоносные области
называются водоносными горизонтами.
Пласт пород, не пропускающих и не
содержащих воду, называется
водонепроницаемым слоем. В отличие
от этих слоев водоносные горизонты
пропускают и накапливают воду в
поровом пространстве слагающих
их пород, а водоупоры хотя и
накапливают воду, но не пропускают
ее в значительных количествах.
Некоторые специалисты используют
термин слабоводопроницаемый
слой. Это пласт пород, накапливающий
и пропускающий количество воды,
которое необходимо учитывать при
изучении региональной миграции
подземных вод, но недостаточное
для питания отдельных скважин.
Названные
термины определены с количественной
точки зрения не точно. Так, в
пустынном районе производительность
водоносного горизонта, может
составлять 100 галл/сутки. В речных
долинах, сложенных гравийными
отложениями, дающими несколько
миллионов галлонов воды в сутки
при вскрытии их большими скважинами,
упомянутый водоносный горизонт
можно рассматривать как
слабоводопроницаемый слой или
даже как водоупор.
Но
этой причине некоторые гидрогеологи
предпочитают определять водоносный
горизонт как природную зону ниже
поверхности земли, дающую воду в
количествах, имеющих существенное
экономическое значение.
Водоносные
горизонты могут быть представлены
рыхлыми осадочными породами,
трещиноватыми плотными изверженными
породами, пористыми песчаниками,
кавернозными известняками и др.
Хотя при вычислениях очень удобно
допустить, что водоносные горизонты
однородны по составу, расположены
горизонтально и слоисты, гидрогеологи
должны всегда учитывать почти
бесконечное разнообразие форм и
свойств водоносных горизонтов.
Ниже описаны различные виды
природных водоносных горизонтов.
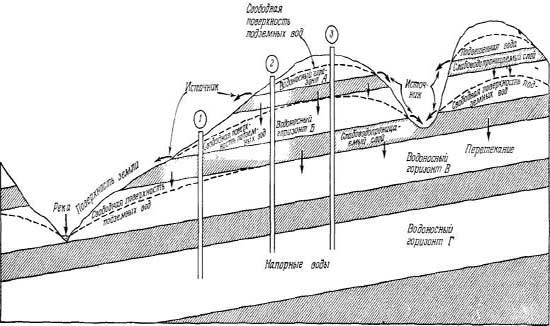
Рис.
2.9. Напорные, безнапорные и
подвешенные подземные воды в
системе простой слоистости
песчаника и глинистого сланца.
|
|
Напорные
и безнапорные подземные воды
Напорные
и безнапорные подземные воды
|
Подземные
воды, находящиеся в непосредственном
контакте с атмосферой через
открытые поры проницаемой среды,
называются безнапорными. Напорные
воды отделены от атмосферы
относительно водонепроницаемыми
породами. Так называемые
слабонапорные воды находятся в
переходных условиях, характерных
как для напорных, так и безнапорных
вод. Во многих районах первые от
земной поверхности безнапорные
воды расположены выше основной
зоны фреатических вод и представляют
собой более или менее изолированные
скопления воды, положение которых
определяется геоструктурными
условиями (рис. 2.9). Такие воды
называют подвешенными, а их верхнюю
границу — подвешенной свободной
поверхностью.
Часто
очень трудно провести различие
между напорными, слабонапорными,
безнапорными и подвешенными
подземными водами. На рис. 2.9
показано типичное залегание
водоносных горизонтов, представленных
осадочными породами. В положении,
когда заложена скважина 1, воду
горизонта Б считают подвешенной,
а воду горизонта В — безнапорной.
Скважина 2 проходит через подвешенную
воду горизонта А, безнапорную
воду горизонта Б и напорную воду
горизонтов В я Г. Скважина 3
вскрывает напорные воды во всех
горизонтах, за исключением
горизонта А. Таким образом, на
небольшом участке с простым
геологическим строением в пределах
одного водоносного горизонта
вода может быть подвешенной,
безнапорной (фреатической) и
напорной. В районах, более сложных
в геологическом отношении,
подземные воды трудно или невозможно
подразделить на указанные типы.
Напорные
воды также называют артезианскими.
Первоначально этот термин относили
к водам, обладающим достаточным
напором для самоизлива на
поверхность земли. В последние
годы термин артезианские воды
становится более или менее
синонимичным термину напорные
воды.
Наиболее
хорошо выраженные напорные воды
были найдены в обширных водоносных
горизонтах, сложенных плотными
породами в Австралии и центральной
части Северной Америки. Первые
скважины, пройденные и водоносных
горизонтах этих областей, вскрывали
воду с напором более 150 футов над
земной поверхностью. Дебит этих
самоизливающихся скважин часто
превышал 1000 галл/мин. Две скважины,
пройденные в дакотских песчаниках,
давали воду под таким напором,
что она вращала колеса мельниц
почти до конца XIX в. К сожалению,
напор в этих водоносных горизонтах
упал и в настоящее время вода из
них, как правило, откачивается.
Породы,
перекрывающие водоносный горизонт,
могут быть слабоводо-нроницаемыми,
поэтому вода таких горизонтов
слабонапорная. В таких условиях
высокое давление не формируется
и напор редко превышает 5—10 футов
над поверхностью земли. Артезианские
воды современных аллювиальных
отложений в основном именно
таковы.
|
|
Строение
артезианского бассейна
Строение
артезианского бассейна
|
Ранее
движение артезианских вод
уподобляли потоку в трубе с
источником питания, расположенным
выше точки истечения воды. В
большинстве учебников гидрогеологии
артезианский бассейн представлен
в виде синклинальной структуры
с областями питания, расположенными
выше уровня разгрузки воды (рис.
2.10). Первоначальный уровень
артезианских вод постепенно
понижается от областей питания
в сторону очага разгрузки.
Артезианский водоносный горизонт
залегает между пористыми, но почти
непроницаемыми слоями, называемыми
водоупорами и слабоводопроницаемыми
слоями. Такое строение типично
для многих больших артезианских
бассейнов. Однако в природных
условиях их разнообразие бесконечно.
Ниже описано несколько типичных
артезианских бассейнов.
На
рис. 2.11, а показан артезианский
бассейн с низким напором,
формирующимся в области
распространения закрепленных
дюнных песков. Здесь заболоченные
низины служат слабоводопроницаемыми
слоями. На рис. 2.11,б изображен
водоносный горизонт, представляющий
собой зону трещиноватости,
образованную разрывным смещением
консолидированных водонепроницаемых
пород. Такие водоносные горизонты
обладают большим напором, но
низкой производительностью. На
рис. 2.11, в видно, что артезианский
водоносный горизонт может
представлять собой не только
синклиналь, но и антиклиналь.
Горизонтально залегающие породы
часто образуют артезианские
водоносные горизонты (рис. 2.11, г).
Напорные водоносные горизонты
также распространены в ледниковых
отложениях. На рис. 2.11, д показана
артезианская скважина, вскрывающая
напорные воды на контакте
флювиогляциальных и моренных
отложений.
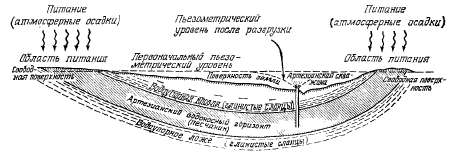
Рис.
2.10. Элементы классической
артезианской системы в виде
синклинали.
|
|
Источники
артезианского напора
Источники
артезианского напора
|
Наличие
напора воды в самоизливающей
скважине объясняют тем, что область
питания артезианского водоносного
горизонта расположена выше точки
заложения скважины. Такое простое
объяснение верно лишь по отношению
к ограниченным водоносным
горизонтам, приуроченным, например,
к зонам разрывных смещений
консолидированных пород (рис.
2.11, б). Крупные водоносные горизонты
отличаются упругостью слагающих
их пород, поэтому для объяснения
явлений, наблюдаемых в большинстве
артезианских бассейнов, необходима
более сложная механическая модель.
Если
бы артезианский бассейн имел
идеальную жесткую структуру и
был бы заполнен невязкой и
несжимаемой жидкостью, то в
результате водоотбора уровень
воды в скважинах и в области
питания понизился бы мгновенно.
В действительности этого не
происходит. Обычно влияние откачки
сказывается лишь на расстоянии
до десяти миль от скважины. Одним
из первых геологов, объяснивших
это явление, был Мейнцер. Он
заметил, что уровни воды в скважинах,
вскрывающих огромный дакотский
артезианский бассейн, зависят
только от местных откачек и что
количество воды, поступающее в
область водозабора, значительно
меньше объема откачиваемой воды.
Расчеты Мейнцера показали, что
откачиваемая вода включает: 1)
воду, поступающую на данную
площадь, 2) воду, отжимаемую в
результате уплотнения водоносных
пород, и 3) воду, поступающую при
понижении давления в водоносном
горизонте. Мейнцер пришел к выводу,
что из этих трех источников вода,
отжимаемая при уплотнении
водоносных пород, преобладает.
Вода перемещается к области
водозабора также в результате
действия следующих факторов, не
рассмотренных полностью Мейнцером:
1) расширение газов, 2) увеличение
объема минералов, 3) отжатие воды
при уплотнении водоупорных слоев
и 4) действие температуры, химических
реакций и разности электрических
потенциалов. Поступление воды в
результате расширения газов и
отжатия из водоупорных пород
существенно для некоторых
артезианских водоносных горизонтов,
но другие из выше перечисленных
источников воды, вероятно,
незначительны для пресноводных
горизонтов.
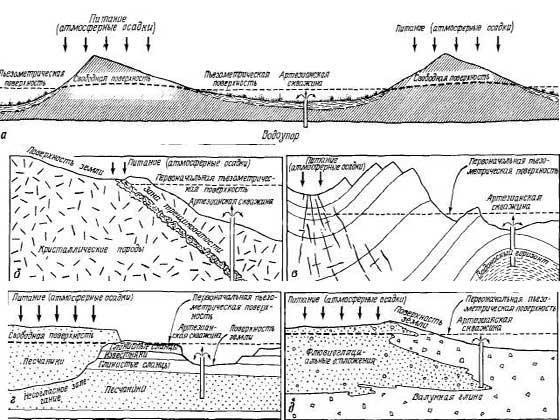
Рис.
2.11. а — артезианские скважины в
закрепленных песчаных дюнах; б —
кристаллических породах; в —
сложноскладчатых и трещиноватых
осадочных породах; г— горизонтально
залегающих осадочных породах; в
— ледниковых отложениях.
Об
упругости пород артезианских
водоносных горизонтов свидетельствуют:
изменения уровня земли около
скважин; колебания уровня воды,
вызванные нагрузками на поверхности
земли; соотношения объема
откачиваемой воды и изменения
уровня воды около скважины;
колебания уровня воды под действием
сейсмических и приливно-отливых
сил.
|
|
Данные
об уровне подземных вод на картах
и графиках
Данные
об уровне подземных вод на картах
и графиках
|
Уровни
подземных вод, замеряемые в
скважинах и колодцах, наносят на
различные карты и графики; из них
наиболее распространены следующие:
карты изолиний уровня подземных
вод (карты гидроизогипс и
гидроизопьез),. карты изменения
уровня подземных вод, глубин
залегания подземных вод,
гидрогеологические профили и
гидрографы скважин (графики
колебания уровня воды в скважинах).
Если хорошо известны расположение
скважин и границы водоносного
горизонта, то по имеющимся данным
составляют карту гидроизопьез
или карту гидроизогипс, которые
можно назвать потенциометрическими.
Уровень, до которого поднимается
вода в артезианских скважинах,
т. е. скважинах, вскрывающих
напорные воды, определяет
пьезометрическую поверхность;
эта поверхность может быть выше
или ниже поверхности земли. Если
пьезометрическая поверхность
выше поверхности земли, обсадные
трубы артезианской скважины
должны оканчиваться выше
пьезометрической поверхности.
Строго говоря, слово «пьезометрический»
означает «измеряющий давление»,
но пьезометрическая поверхность
определяется как давлением воды,
так и высотой положения водоносного
горизонта. Следовательно, термин
пьезометрическая поверхность
несколько неопределенен. Если в
настоящих безнапорных условиях
с помощью скважин определен
уровень грунтовых вод, составляют
карту гидроизогипс. Силовой
потенциал, вызывающий движение
подземных вод, прямо пропорционален
высоте уровней воды в скважинах,
пробуренных как в напорных, так
и безнапорных водоносных горизонтах.
Поэтому карты уровней подземных
вод лучше называть потенциометрическими,
т. е. характеризующими единую
систему потока в водоносном
горизонте.
Главное
направление движения подземных
вод можно показать на картах
гидроизогипс и картах гидроизопьез.
На первой из них точки с одинаковыми
высотами свободной поверхности
подземных вод соединены линиями,
по расположению которых можно
судить о наклоне свободной
поверхности. Если гидравлический
градиент менее 0,01, а водопроводимость
горизонта более или менее постоянна,
можно сказать, что свободная
поверхность подземных вод
представляет собой потенциометрическую
поверхность воды в пределах
водоносного горизонта. Поскольку
поток в таком водоносном горизонте
почти горизонтален, можно построить
его гидродинамическую сетку,
используя гидроизогипсы в качестве
эквипотенциальных линий и проведя
линии тока перпендикулярно
гидроизогипсам (рис. 2.12).
Гидродинамическую сетку используют
для отыскания очагов питания или
разгрузки и для количественной
оценки потока подземных вод. На
рис. 2.12 показана карта гидроизогипс,
на которой видны особенности
движения безнапорных подземных
вод, обусловленные геологическим
строением бассейна и гидрологическими
факторами.
Район
А (рис. 2.12) — область питания
водоносного горизонта, расположенная
в пределах конуса выноса. Глубина
до воды здесь 80 футов. В этом мосте
река постоянно теряет воду в
проницаемое ложе. Реки, имеющие
такую связь со свободной поверхностью
подземных вод, называются
дренируемыми. И точке Б уровень
воды в реке совпадает с уровнем
свободной поверхности подземных
вод. В этой точке гидроизогипса
нормальна к линии русла реки, что
объясняется отсутствием оттока
воды из реки. Следовательно, вблизи
точки Б линии тока касательны к
направлению течения реки. В точке
В уровень воды в реке ниже уровня
подземных вод, и здесь они пополняют
року, называемую в этом случае
дренирующей. В точке Е река все
еще питается подземными водами,
но значительная часть их уже
сдренировалась в реку до этого
пункта, поэтому гидроизогипсы
далее вниз по течению так резко
не изгибаются. В точке /"ведется
откачка большой производительности.
Здесь уровень подземных вод упал
на 20 футов ниже уровня в точке Б.
Спустя короткое время в результате
откачки в точке Г уровень подземных
вод еще больше понизится, и в точке
Б река будет питать подземные
воды. В районе Д происходит
пополнение водоносного горизонта.
Здесь избытки оросительных под
образовали купол, превышающий
уровень реки в точке Б на 10 футов.
В районах Ж и З река течет в
водонепроницаемом русле. Разность
расходов реки в точках Ж и 3 равна
прибыли или убыли воды в бассейне
подземных вод. Ошибки в построении
карт гидроизогипс связаны с чисто
механической экстраполяцией
результатов замеров уровней воды.
Гидроизогипсу можно ошибочно
провести даже выше поверхности
земли (рис. 2.13, а). Нельзя также
игнорировать особенности
геологического строения картируемого
района (рис. 2.13, б).
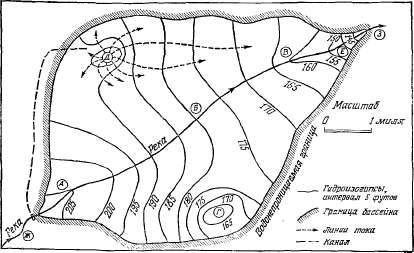
Рис.
2.12. Карта гидроизогипс малого
гипотетического бассейна грунтовых
вод.
Если
водоносный горизонт однородный
и изотропный и уклон свободной
поверхности подземных вод
небольшой, эта карта может быть
полезна для построения
гидродинамической сетки. Проведено
несколько линий тока, схождение
которых свидетельствует о различной
водопроводимости водоносного
горизонта.
Карты
глубин залегания додземных вод
используются для установления
районов, где возможны потери
подземных вод на суммарное
испарение и для определения
приблизительных глубин проходки
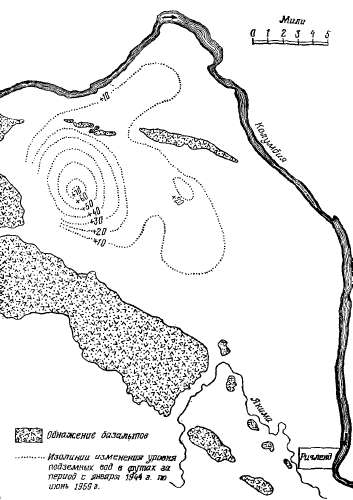
скважин. На рис. 2.14 в районе Ε
подземные воды расходуются на
суммарное испарение.
Ошибки
при составлении карт гидроизопьез
обычно происходят от неумения
установить уровни воды разных
водоносных горизонтов, что вызвано
незнанием разреза буровых скважин
(рис. 2.15). Если картируемый район
сложен в стратиграфическом или
тектоническом отношении, необходимо
максимально учитывать геологические
данные. Обычно действие теологических
факторов проявляется лишь после
начала эксплуатации водоносного
горизонта. В начальных условиях
медленного движения подземных
вод уровни воды изменяются
незначительно при пересечении
слабоводопроницаемых границ. В
ходе эксплуатации водоносного
горизонта зоны низкой проницаемости
вызывают заметные различия в
высотах уровня подземных вод.
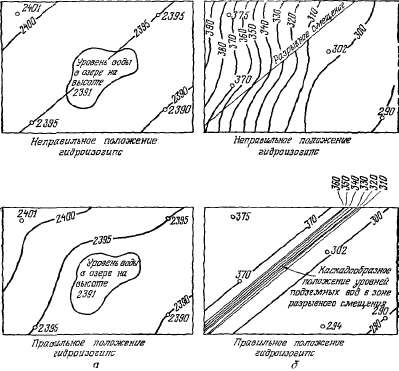
Рис.
2.13. Ошибки, часто встречающиеся
при составлении карт гидроизогипс:
а — участок с понижением (озеро);
б — участок в зоне разрывного
смешения.
Как
правило, пьезометрическая
поверхность гораздо ровнее
свободной поверхности подземных
вод. Разгрузка водоносного
горизонта через скважины или
источники быстро сказывается на
всей большой площади напорного
водоносного горизонта. Например,
ощутимое понижение пьезометрической
поверхности вокруг скважины, из
которой производится откачка,
может распространиться менее чем
за 30 сек на расстояние более 1
мили, а подобное понижение уровня
воды вокруг скважины, пройденной
в безнапорном водоносном горизонте,—
лишь в течение нескольких месяцев.
Карты
колебания уровня подземных вод
составляются по данным об изменении
уровня воды в скважинах за
определенный период времени.

Рис.
2.14. Карта глубин залегания подземных
вод в бассейне, изображенном на
рис. 2.12
Если
этот период небольшой, используют
данные по одним ж тем же скважинам,
Если наблюдения продолжительные,
в некоторых районах невозможно
использовать одни и те же скважины
вследствие их довольно быстрого
выхода из строя. В этом случае
карты гидроизогипс для сравниваемых
лет рекомендуется составлять на
кальке. Карты накладывают одна
на другую и на пересечениях
гидроизогипс отмечают изменения
уровней. Затем полученные величины
переносят на чистый лист бумаги
и проводят линии равного изменения
уровня воды (рис. 2.16).
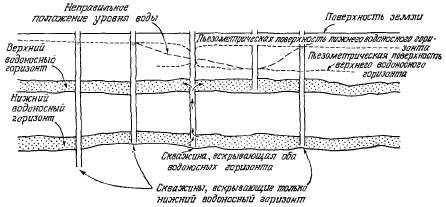
Рис.
2.15. Наблюдательные скважины в
двух водоносных горизонтах с
различными напорами. Если неизвестен
разрез скважин, правильно определить
положение уровней воды невозможно.
Карту
колебания уровня подземных вод
можно использовать для вычисления
изменения объема насыщенной части
безнапорного водоносного горизонта.
Объем дренированных пород делят
на объем откачанной воды и получают
удельную водоотдачу осушаемых
пород. Например, если из 15·106
куб. футов породы откачано 5·106
куб. футов воды, средняя удельная
водоотдача будет 33%.
Карты
колебания уровня подземных вод
также применяются для оценки
местных очагов питания и разгрузки
в виде ярковыраженных аномалий.
Обычно такие очаги трудно обнаружить
на карте гидроизогипс по отклонениям
последних. На карте колебания
уровня подземных вод (рис. 2.16) очаг
питания выражен в виде хорошо
оконтуренной круговой области.
Графики
колебания уровня воды в скважинах
строят по данным измерений уровня
воды с помощью лент, покрытых
мелом, электроуровнемеров,
пневматических и акустических
уровнемеров (рис. 2.17). Данные об
уровнях, полученные автоматическими
приборами, обрабатываются на
быстродействующих электронных
информационных машинах.
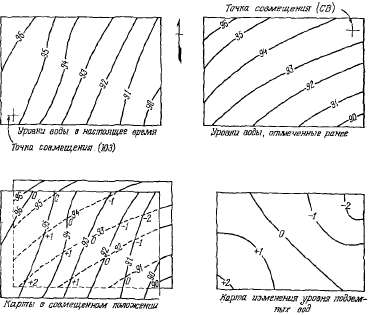
Рис.
2.16. Составление карты колебания
уровня подземных вод путем
наложения карт гидроизогипс.
График
колебаний уровня воды в скважине
— один из наиболее эффективных
способов регистрации гидрогеологической
информации. По данным многолетних
наблюдений можно судить о
производительности водоносного
горизонта и размерах его питания.
Сведения о кратковременных
изменениях уровня воды с амплитудами
менее 1/10
фута дают возможность уяснить
механические свойства пород,
служащих кровлей водоносного
горизонта, а также характер связи
между водоносным горизонтом и
атмосферой. По наблюдениям больших
изменений уровня воды, вызванных
откачкой, можно судить о границах
и водоотдаче водоносного горизонта.
Изменения
уровня подземных вод можно
подразделить на четыре основных
типа: 1) в результате изменения
запасов подземных вод; 2) действия
атмосферного давления на поверхность
воды в скважине; 3) деформации
водоносного горизонта и 4) различных
нарушений работы скважины. Причиной
небольших колебаний уровня воды
также могут служить химические
или термальные изменения в
скважинах или около них.
Изменения
уровня подземных вод в значительной
степени происходят вследствие
изменений в запасах водоносного
горизонта. Естественные факторы,
такие, как питание или разгрузка,
обычно вызывают постепенные
изменения уровня подземных вод.
Вблизи речных русел запасы
подземных вод могут изменяться
довольно быстро. В паводочный
период запасы водоносного
горизонта, связанного с рекой,
резко увеличиваются, а уровни
подземных вод быстро повышаются.
На рис. 2.18, а показано влияние
изменения уровня воды в реке на
уровень воды в скважине. На рис.
2.18, б можно видеть влияние на
уровень подземных вод длительных
изменений запасов подземных вод,
вызванных естественной разгрузкой
водоносного горизонта. Резкие
колебания уровня подземных вод,
измеряемые несколькими футами,
происходят главным образом
вследствие откачки. Кратковременные
откачки вызывают изменения уровня
в течение нескольких суток.
Сезонные повышения уровня
длительностью в несколько месяцев
сменяются падением уровня
вследствие откачек. Такой режим
уровня характерен для районов
орошения подземными водами.
Длительные изменения уровня
вызываются постепенным истощением
или пополнением водоносного
горизонта. На рис. 2.18, в изображен
график колебания уровня подземных
вод с сезонным циклом ирригационного
водозабора, наложенный на график
многолетнего изменения уровня
подземных вод, имеющего общую
тенденцию к снижению.
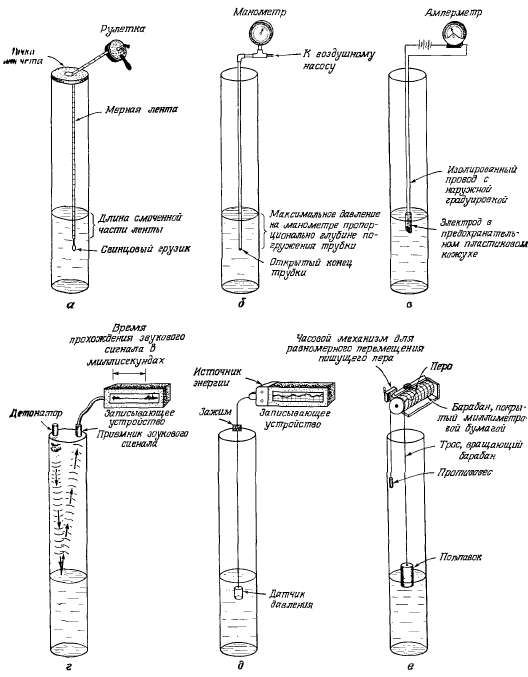
Рис.
2.17. Приборы для измерения глубины
уровня воды в скважинах: а —
стальная мерная лента (рулетка),
точность измерения уровня—около
0,005 фута; глубину до воды определяют
вычитанием длины смоченной части
ленты из общей ее длины до точки
отсчета; б — пневматический
уровнемер, точность замера уровня
при правильной работе—около 2
футов; глубина до воды равна длине
трубки в скважине за вычетом
отношения максимального давления,
Покапанного манометром, к удельному
весу воды; в — электрический
уровнемер; обычная точность
отсчета уровня — до 0,1 фута, при
использовании мерной ленты
точность измерения достигает
0,001 фута; действие прибора основано
на замыкании электрической цепи
при соприкосновении опускаемого
в скважину электрода с водой, что
отмечается амперметром; глубина
до воды определяется по градуировке
опущенного в скважину провода и
уточняется мерной лентой; г —
акустический уровнемер, дающий
приблизительные данные о глубине
до воды с точностью около 10 футов,
если известны температура воздуха,
а следовательно, и скорость звука;
глубина до воды равна половине
произведении времени прохождения
звукового сигнала на скорость
звука; д — прибор для измерения
уровня с погруженным датчиком
давления, работающем на электрических
батареях; точность регистрации
изменения глубины погружения
датчиков — менее 0,001 фута; глубину
погружения датчика определяют
непосредственно по калибровочной
кривой; е — барабанный самописец
— один из самых старых и наиболее
надежных приборов для измерения
уровня воды; точность измерения
колебания уровня — менее 0,001 фута;
глубина начального уровня
определяется с помощью мерной
ленты, последующие изменения
уровня регистрируются пером на
миллиметровой бумаге.
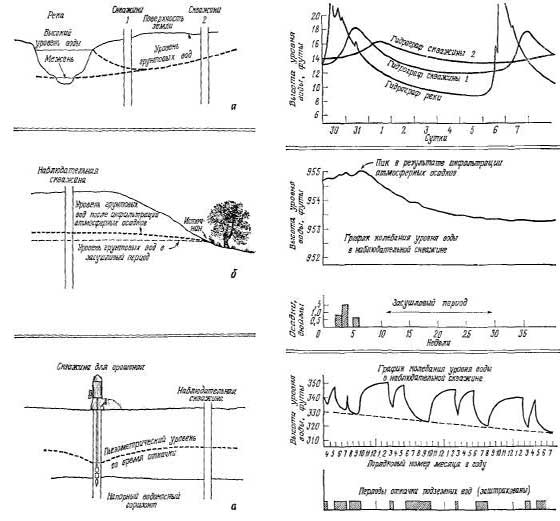
Рис.
2.18. Колебания уровня подземных
вод. а — вызванные изменением
уровня воды в реке; б — постепенным
истощением водоносного горизонта
в засушливый период; в — отбором
воды на орошение.
Колебания
уровня подземных вод, вызванные
действием атмосферного давления
на поверхность воды в скважине,
бывают двух типов. Кратковременные
изменения происходят вследствие
порывов ветра над устьем скважины.
В результате увеличения скорости
ветра над устьем скважины
атмосферное давление в последней
уменьшается, от чего уровень воды
поднимается. При ослаблении ветра
уровень воды в скважине падает.
Изменения
атмосферного давления также
вызывают более длительные колебания
уровня воды в скважинах. По мере
увеличения атмосферного давления
уровни воды в скважинах, вскрывающих
напорные водоносные горизонты,
понижаются. Отношение величины
изменения уровня воды в скважине
к величине изменения атмосферного
давления называется барометрической
эффективностью водоносного
горизонта. Максимальная величина
барометрической эффективности
составляет примерно 80%.
Вес
перекрывающих пород и атмосферное
давление оказывают на водоносный
горизонт давление ра
(рис. 2.19). Этому давлению противостоит
давление pw
подземных вод и реактивное давление
ps
пород водоносного горизонта.
Увеличение атмосферного давления
на Δра
вызывает увеличение напряжения
скелета водоносных пород Δрs
и увеличение давления воды Δрw
в пределах водоносного горизонта.
Итак,
ра=рw
+ рs
(2.2)
и
Δра
= Δрw
+ Δрs.
(2.3)
При
наличии скважины увеличение
атмосферного давления на величину
Δра
передается через воду в скважине
непосредственно на водоносный
горизонт. В этом случае вода из
скважины выжимается в водоносный
горизонт.
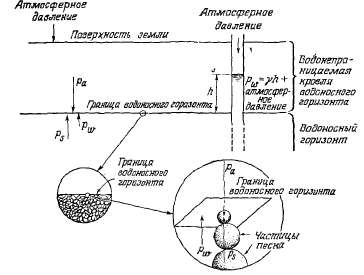
Рис.
2.19. Влияние изменения атмосферного
давления на напорный водоносный
горязонт.
Если
атмосферное давление возросло
на величину + Δpa,
то давление воды увеличится на +
Δpw
. Следовательно, + Δpw
= γ (—Δh) + Δpa.
Отрицательное значение Δh
свидетельствует о том, что уровень
воды падает, поскольку Δpa
> Δpw.
Если атмосферное давление снизилось
на величину — Ар , давление воды
уменьшится на величину —Δpw-
Следовательно, — Δpw
= γ Δh — Δpa
. Положительная величина Δh
означает, что уровень воды в
скважине поднялся.
Такое
изменение уровня воды на величину
Δh продолжается до тех пор, пока
оно будет остановлено
противодействующим давлением.
Таким образом,
Δhγ
+ Δpw
= Δpa
(2.4)
где
γ — удельный вес воды. Это уравнение
предполагает, что объем воды,
выжатой в водоносный горизонт,
незначителен по сравнению с
объемом воды водоносного горизонта.
Разумеется, для глубоких скважин
в слабопроницаемых породах это
положение нельзя считать доказанным,
но для большинства водоносных
горизонтов, сложенных рыхлыми
осадочными породами, такое
допущение возможно. Вообще величина
Δpw
мала для водоносных горизонтов,
сложенных скальными породами, и
велика для водоносных горизонтов,
сложенных рыхлыми породами. Таким
образом, барометрическая
эффективность прямо пропорциональна
плотности пород водоносного
горизонта.
Колебания
уровня подземных вод возможны
также вследствие деформации
водоносного горизонта. Одна из
наиболее распространенных причин
этого явления — нагрузка,
оказываемая на прибрежные
водоносные горизонты водами
океана в результате колебания их
уровня. Морские ветры во время
шторма могут поднять уровень воды
в океане на высоту до 2 м. Этот
подъем уровня накладывается на
обычное повышение уровня океана
вследствие периодических приливов.
Итак, при повышении уровня воды
в океане на прибрежный водоносный
горизонт действует большая
нагрузка:
Δрt
= Δрw
+ Δрs,
(2.5)
где
Δрt
— изменение давления на водоносный
горизонт вследствие изменения
уровня воды в океане (рис. 2.20). Если
водоносный горизонт представлен
упругими породами, величина Δрw
будет большая. Повышение уровня
воды в скважине составит Δh, или
Δhγ
= Δрw.
(2.6)
Джейкоб
вывел зависимость между приливной
и барометрическом эффективностью.
Если
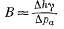 (2.7)
(2.7)
и
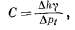 (2.8)
(2.8)
то
B
+ C=1,
(2.9)
где
С — приливная эффективность, В —
барометрическая эффективность
на берегу океана. Следовательно,
приливная эффективность служит
мерой упругости водоносного
горизонта.
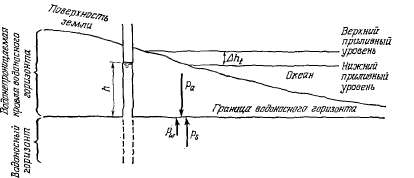
Рис.
2.20. Влияние приливных колебаний
уровня океана на уровень воды в
скважине, вскрывающей напорный
водоносный горизонт.
Давление
на водоносный горизонт ра
суммируется из атмосферного
давления, давления столба воды
океана, веса водонепроницаемой
кровли водоносного горизонта и
перекрывающих пород. Поскольку
Δрw
= γΔh и Δрw
прямо пропорционально изменению
уровня воды в скважине вследствие
прилива Δht,
величины Δht
и Δh имеют одинаковый алгебраический
знак (направление движения). Однако
изменение Уровня воды в скважине
Δh всегда меньше изменения уровня
воды в океане Δht
на величину
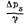 при
γ ~ γ0,
где γ0
— удельный вес воды окаеана. Если
атмосферное давление постоянно,
pw = γh Также Δрt=
Δhtγ0.
при
γ ~ γ0,
где γ0
— удельный вес воды окаеана. Если
атмосферное давление постоянно,
pw = γh Также Δрt=
Δhtγ0.
Земные
приливы также вызывают небольшие
изменения уровня воды в некоторых
скважинах. Эти изменения амплитудой
обычно менее 0,1 фута ежесуточно
достигают двух минимумов,
соответствующих верхней и нижней
кульминациям Луны. В результате
лунного притяжения происходит
некоторое расширение водоносного
горизонта, что в свою очередь
уменьшает давление внутри него
и вызывает понижение уровня воды
в скважине.
Эпизодические
изменения уровня подземных вод
происходят при землетрясениях,
прохождении поездов, работе
землеройных машин, вызываются
взрывами и другими кратковременными
нагрузками на водоносные горизонты.
Амплитуда этих колебаний обычно
менее 0,1 фута, но при очень сильных
землетрясениях она достигает
нескольких футов.
Изменения
уровня подземных вод в результате
землетрясений могут быть упругими
и не упругими. Сейсмические
колебания земной коры, возникшие
в одном районе, передаются в другие
области земного шара, где горные
породы претерпевают упругую
деформацию. Колебание уровня
подземных вод неупругого характера
заключается в перераспределении
частиц пород водоносного горизонта
или пород, граничащих с последним.
Небольшое изменение объема
водоносного горизонта в результате
землетрясений вызывает изменения
уровня воды в скважинах, вскрывающих
напорные водоносные горизонты
средней водоироводимости.
Постоянные
деформации рыхлых осадочных пород
обычно происходят на расстоянии
до 100 км от эпицентра очень сильного
землетрясения. При более слабых
землетрясениях это расстояние
сокращается. Особенно резкое
влияние землетрясений на уровень
подземных вод отмечается в
водоносных горизонтах, сложенных
современными песчаными отложениями.
Вода начинает изливаться из
скважин, вскрывающих такие
водоносные горизонты, во время
сильного землетрясения или сразу
после него. Это происходит в
результате вытеснения воды из
водоносных горизонтов, сжимаемых
сейсмическими колебаниями. Там,
где песок залегает на относительно
небольшой глубине, под действием
гидравлического напора на
поверхность земли выбрасывается
смесь песка и воды, в результате
чего там образуются небольшие
песчаные бугорки в виде миниатюрных
вулканов.
Нередко
колебания уровня воды менее 1 фута
вызываются различными нарушениями
внутри скважины. Утечка воды через
трубы, попадание мелких животных
в скважину, выделение газа в воде
и другие причины могут исказить
данные об уровне воды, отражаемые
на графике. К счастью, непериодический
характер колебаний уровня такого
рода, а также малая величина их
амплитуд дают возможность
гидрогеологам отличать эти
изменения от более значительных.
|
|
Разгрузка
подземных вод
Длиннейший
отрезок гидрологического цикла
заканчивается там, где подземные
воды разгружаются на поверхность
земли или в водоемы поверхностных
вод. Разгрузка подземных вод
осуществляется различными путями,
из которых источники, водоотбор
и транспирация важнейшие. Местами
наблюдаются рассредоточенные
выходы подземных вод; в этом случае
подземные воды испаряются
непосредственно с поверхности
почвы или просачиваются в реки и
озера.
|
|
Источники
Среди
явлений, связанных с деятельностью
подземных вод, наибольшего внимания
заслуживают источники. В аридных
районах в древности человек
селился главным образом вблизи
источников. Многочисленные
упоминания о них содержатся в
религиях разных народов. Медицина
прошлого часто предписывала
лечение водами минеральных и
термальных источников. Многие до
сих пор считают, что вода источников
обладает волшебной силой.
Современная реклама пользуется
этим обстоятельством, особенно
для продажи напитков. Считается,
что вода источников исключительно
чистая, хотя это и не подтверждено
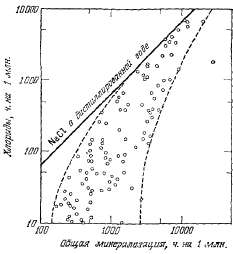
фактами. Минерализация вод источни-
ков
может превышать минерализацию
водопроводной воды в два-три раза.
Вода источников обычно легче
загрязняется по сравнению с водой,
поступающей из водозаборных
скважин или коммунальной системы
водоснабжения.
Таблица 2.2 Классификация источников
по дебиту, Мейнцер
Класс
|
Дебит
в английских мерах
|
Дебит
в метрических мерах
|
I
|
Более
100 куб. фут/сек
|
Более
2,83 м3/сек
|
II
|
10—100
куб. фут/сек
|
0,283—2,83
м3/сек
|
III
|
1—10
куб. фут/сек
|
28,3—283
л/сек
|
IV
|
100
галл/мин — 1 куб. фут/сек
|
6,31—28,3
л/сек
|
V
|
10—100
галл/мин
|
0,631—6,31
л/сек
|
VI
|
1—10
галл/мин
|
63,1—631
мл/сек
|
VII
|
1
пинта/мин — 1 галл/мин
|
7,9—63,1
мл/сек
|
VIII
|
Менее
1 пинта/ мин
|
Менее
7,9 мл/сек
|
Источники
классифицируют: по величине дебита
(табл. 2.2), приуроченности к
определенному типу водоносного
горизонта, химическому составу
и температуре воды, направлению
движения воды, связи с рельефом
и геологическими условиями
местности и т. д. Можно насчитать
несколько тысяч типов различных
их характеристик.
Ниже
сделана попытка дать основные
принципы классификации источников
и описать несколько их характерных
типов.
Любой
естественный выход воды на земную
поверхность в виде небольшого
потока называется источником.
Разгрузка подземных вод с меньшим
расходом называется высачиванием.
Источники разгружаются
непосредственно в океаны, моря,
озера и реки ниже уреза воды.
Подводные источники обычно трудно
обнаружить, если их дебит не
превышает несколько кубических
футов в секунду.
Дебит
источника зависит от трех основных
переменных: проницаемости пород
водоносного горизонта, площади
области его питания и размера
питания. Благодаря высокой
водопроницаемости пород большие
объемы воды концентрируются на
небольшой площади. Многие водоносные
горизонты, разгружающиеся через
источники, имеют значительную
суммарную производительность,
но если их водопроводимость низка,
выклинивание возможно на большой
площади. Например, общий дебит
источников, расположенных по
берегам рек большой речной системы,
может составить несколько сотен
кубических футов в секунду, при
этом дебит самого большого
источника будет не более 1 галл/мин.
Область
питания источника может занимать
площадь от менее тысячи квадратных
футов во влажных районах до более
пяти тысяч квадратных миль в
аридных. На рис. 2.21 показана
зависимость между площадью
водосбора и дебитом источников.
В
некоторых районах с большим
количеством осадков и сильно
проницаемой поверхностью величина
инфильтрации достигает 10 футов
в год. В аридной зоне и при наличии
водонепроницаемых пород размер
питания подземных вод может
составить 0,1 дюйма в год.
На
Земле насчитывается лишь несколько
сотен источников с дебитом более
100 куб. фут/сек. Это объясняется
довольно редким сочетанием
условий, необходимых для
существования крупного источника:
большое количество инфильтрующейся
воды осадков, большая площадь
дренирования и благоприятные
геологические условия. Некоторые
крупные источники питаются водой
рек или озер, которая просачивается
в водоносный горизонт.
Такая
вода обычно проходит небольшое
расстояние до места разгрузки. К
источникам такого типа относится
источник бассейна реки Рио-Мауле
в центральной части Чили. Этот
источник первого класса с дебитом
до 1000 куб. фут/сек выходит на
поверхность из-под лавового
потока, запрудившего озеро. Недавно
в результате сооружения плотины
уровень воды в озере поднялся и
дебит источника увеличился.
На
рис. 2.21 показано, что довольно
крупные источники могут иметь
небольшие площади водосбора.
Источник при умеренном размере
инфильтрации, составляющей лишь
2 см/год, и площади питания менее
0,01 км2
удовлетворяет бытовым потребностям
в воде целой семьи. Источники
могут располагаться даже на
вершинах гор, обычно ниже гребня
хребтов, и иметь водосборную
площадь в несколько десятков или
сотен акров (рис. 2.21). Когда на
вершине горы выпадает большое
количество осадков, расположенный
там источник может дать дебит в
несколько литров в минуту с площади
менее десяти акров.
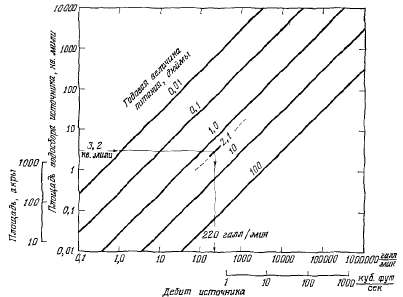
Рис.
2.21. Зависимость между площадью
водосбора и дебитом источников
при различных годовых величинах
питания подземных вод.
Дебит
многих источников сильно зависит
от сезонных колебаний осадков.
Большинство источников VIII класса
действуют после выпадения осадков
непродолжительное время.
Дебит
источников, дренирующих водоносные
горизонты большой емкости,
изменяется незначительно.
Изменчивость дебита источника
определяется следующей формулой:
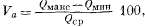 (2.10)
(2.10)
где
Va
— изменчивость дебита источника
в процентах; Qмакс
— максимальный, Qмин
— минимальный, Qср
— средний дебит. При вычислении
изменчивости дебита необходимо
указывать длительность наблюдений.
Например, в период с июня 1957 по
сентябрь 1960 г. источник имел
30%-ную изменчивость. Указать период
наблюдений необходимо, иначе не
ясно, для какого периода получена
эта величина — двух недель или
пяти лет.
Суточные
колебания дебита небольших
источников обычно объясняются
потреблением воды растительностью.
Такие источники обильны между
полуночью и рассветом, днем же
могут даже не действовать. Зимой,
когда транспирация полностью
прекращается, малые источники
имеют постоянный дебит (если они
полностью не промерзают.).
Почти
все источники I класса выходят из
лав, известняков, галечников и
гравелитов. Большинство из них
также связано с крупной
кавернозностыо, но некоторые
имеют незначительный начальный
дебит. Водоносные горизонты,
сложенные песчаниками, конгломератами,
песками, обычно характеризуются
недостаточной водопроницаемостью,
чтобы в них могли возникнуть
источники I или даже II классов.
Небольшие
источники можно найти в породах
всех типов. В столь различных
породах, как лёсс, доломит,
граувакка, гипс или серпентинит,
встречаются источники VII и VIII
классов. Даже в твердых кристаллических
породах небольшие источники
приурочены к зонам разломов и
трещиноватости. Источники
образуются и в сланцеватых породах
вдоль трещин и в мелках линзах
алевритов или песка.
Если
бы горные породы были совершенно
однородными, подземные воды
разгружались бы на поверхность
земли путем рассеянного высачивания
на сравнительно больших площадях.
Источники обычно образуются в
следующих условиях. Там, где
имеются благоприятные условия
рельефа, свободная поверхность
подземных вод пересекает поверхность
земли и начинается поверхностный
сток (рис. 2.22, а). Этот тип высачивания
известен в областях распространения
песчаных дюн, лёссовых отложений
и на площадях, сложенных монолитными
песчаниками или однородными
породами и рыхлыми отложениями.
Изменчивость
водопроницаемости пород по
горизонтали и вертикали чаще
всего служит причиной возникновения
источников. Небольшие действующие
посезонно источники обычно связаны
с изменениями водопроницаемости
коры выветривания. Источники
могут образовываться в делювиальных
отложениях и осыпях (рис. 2.22, б).
Различная водопроницаемость
пород по вертикали, связанная с
горизонтальным напластованием
осадочных пород, служит причиной
возникновения крупных, более
постоянных источников (рис. 2.22,
в).
Структурные
особенности горных пород,
обусловленные орогениче-скими
движениями, значительно влияют
на проницаемость пород, а
следовательно, и на образование
источников. Зоны наибольшей
водопроницаемости формируются
вдоль разрывных смещений (разломов
или сбросов), пересекающих твердые
и ломкие породы. Если разрыв сечет
несцементированные породы, зона
разрыва обычно характеризуется
меньшей водопроницаемостью, чем
окружающие породы. Образование
источников в этих условиях показано
на рис. 2.22, г и д. Трещиноватость
горных пород обычно служит причиной
появления небольших источников.
Образование источника в условиях
вторичного расслаивания массивных
гранитов представлено на рис.
2.22, е.
Орогенические
движения вызывают наклон слоев
и складкообразование, в результате
которых проницаемые или непроницаемые
слои оказываются у поверхности.
На рис. 2.22, ж и г показано образование
источников двух типов, связанных
со складками.
Большинство
известных крупнейших источников
вытекает из вулканических пород
или гравелисто-галечниковых
отложений (рис. 2.22, и). Дайки,
пластовые интрузии, отложения
туфа и погребенные почвы обычно
определяют размещение источников
в вулканических породах.
Источники
особого типа образуются в результате
разгрузки талых ледниковых вод
через полости и каналы внутри
ледника. Некоторые из крупнейших
источников на земном шаре, возможно,
относятся к этому типу, но данных
о дебитах таких источников почти
нет. Обычно источники в ледниках
не относят к источникам, но если
лед ледников рассматривать как
горную породу, то нет оснований
исключать их из общей геологической
классификации источников.
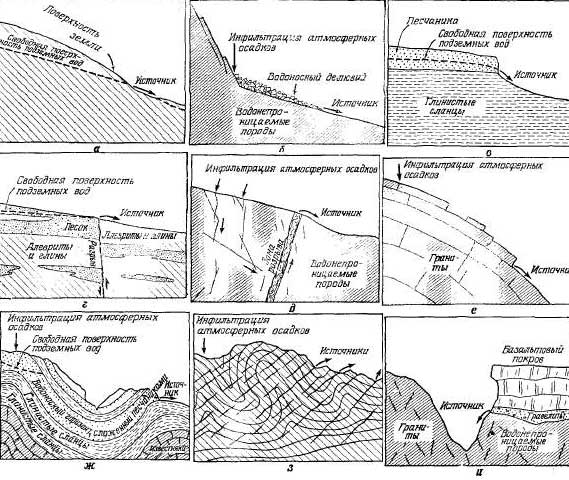
Рис.
2.22. Выходы источников: а — в
понижениях, при пересечении
поверхности земли свободной
поверхностью подземных вод; б —
в результате инфильтрации
атмосферных осадков в грубообломочные
делювиальные отложения; в —
водопроницаемые песчаники
подстилаются непроницаемыми
глинистыми сланцами; г — разрыв,
приведший водонепроницаемые слои
в контакт с проницаемыми
аллювиальными отложениями; д —
открытая зона трещиноватости в
хрупких породах, вызванная
разрывным смещением пород; е —
плитчатая структура гранитов; ж
— выход на поверхность артезианского
водоносного горизонта; з —
преобладающая трещиноватость
пород в одном направлении, и —
обнажение водопроницаемых
гравелитов и базальтов, подстилаемых
непроницаемыми гранитами.
|
|
Искусственная
разгрузка подземных вод
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Искусственная
разгрузка подземных вод
|
Отбор
подземных вод скважинами и
колодцами лежит в основе многих
проблем, рассматриваемых в
последующих главах настоящей
книги. Хотя социально-экономические
аспекты использования подземных
вод находятся за пределами
геологической или инженерной
подготовки гидрогеолога, последний
часто сталкивается с вопросами
зонального регулирования и водного
законодательства, спорами между
работниками охраны вод и инженерами,
с нехваткой денежных средств на
нужды эксплуатации подземных вод
и многими другими проблемами,
только отдаленно связанными с
научной деятельностью. Ниже
некоторые из этих проблем описаны
лишь кратко. Для широкого знакомства
с юридическими, социальными и
экономическими проблемами, с
которыми сталкивается гидрогеолог
в своей деятельности, отсылаем к
работам Томаса, Пайпера, Нейса,
Дейча, Казмана и Робинова.
Юридическими
правами на эксплуатацию поверхностных
вод обычно обладают как
землевладельцы, так и лица,
приобретающие право на них, если
источники воды расположены даже
на некотором расстоянии от места
потребления. Ранее считалось, что
если граница земельного участка
проходит по берегу озера или реки,
землевладелец имеет право
безграничного пользования водой.
По мере роста потребления воды
стало ясно, что эта доктрина
несправедлива, особенно в засушливые
периоды. Постепенно, с целью
справедливого распределения воды
в период ее недостатка, право
владельца прибрежной полосы на
использование воды было видоизменено.
Расточительное пользование водой,
как правило, не защищается
современным законодательством.
В
районах с острой нехваткой воды
всегда господствовало преимущественное
право на воду. Сущность этой
доктрины заключается в том, что
лицо (или группа лиц), присвоив
источник воды первым, приобретает
право на воду в первую очередь.
Источник воды, используемый в
соответствии с преимущественным
правом, может располагаться на
чьей-то земле или находиться за
много миль от пункта потребления.
Приоритетное право каждого
последующего водопользователя
ограничивается, и последний из
них может использовать только
избытки воды в паводочный период.
Во многих районах преимущественное
право на воду претерпело изменения
подобно праву землевладельца на
воду.
Попытки
применить положения законодательства,
разработанного для поверхностных
вод, в области эксплуатации
подземных вод оказались неудачными.
Частично это объясняется отсутствием
ясных представлений о характере
движения подземных вод. Например,
делаются бесплодные попытки
определить границы «подземных
водотоков», чтобы применить право
владельца прибрежной полосы на
воду. Дело в том, что в подземных
водах заинтересован большой круг
лиц. Водоносные горизонты могут
залегать в недрах сотен тысяч
частных землевладений. Отбор воды
из одной части водоносного
горизонта влияет на уровень воды
всего горизонта. Равное распределение
прав на подземные воды среди
такого большого числа землевладельцев
с разными потребностями в воде
практически невозможно.
В
настоящее время право регулировать
использование подземных вод в
США принадлежит органам округов,
штатов, экономических районов и
федеральному правительству. В
США значительная доля власти
принадлежит органам штатов. В
каждом штате водное законодательство
имеет свои особенности. Во многих
штатах инженер штата наделен
правом выдавать разрешения на
сооружение скважин большой
производительности. В этом случае
истощение запасов подземных вод
можно предотвратить при условии,
что инженер штата и его сотрудники
полностью осведомлены о состоянии
ресурсов подземных вод во всех
пунктах их эксплуатации. Например,
в Калифорнии эксплуатация подземных
вод слабо регулируется властями
штата, но зато образованы местные
водные участки, обладающие правом
регулировать использование
подземных вод в районах с
определенными гидрогеологическими
границами. Некоторые из этих
участков облагают налогами
владельцев крупных скважин с
целью сбора средств для искусственного
пополнения подземных вод.
Отнесение
подземных вод к возобновляемым
природным ресурсам выдвинуло в
аридных районах некоторые важные
социально-экономические проблемы.
В этих районах немногие понимают,
что почти всегда усиленная
эксплуатация подземных вод
приводит к истощению водоносных
горизонтов. Однако если отбор
подземных вод ограничить объемом
их естественного восполнения, то
запасы их не будут истощаться, но
при этом возможны лишь небольшие
и непроизводительные горные
разработки, малопродуктивное
сельское хозяйство или слаборазвитая
промышленность. И наоборот, при
интенсивном потреблении воды
становится возможным эффективное
использование дорог, различного
оборудования, живой силы и т. п.
Таким образом, отбор подземных
вод необходимо планировать так
же, как добычу невоспроизводимых
ресурсов угля, железной руды или
других полезных ископаемых. При
сооружении зданий и строений,
требующих больших капиталовложений,
надо учитывать возможные сроки
эксплуатации подземных вод.
Часто
невозможно планировать эксплуатацию
подземных вод заранее. Обычно к
советам специалистов относительно
правильной эксплуатации подземных
вод прибегают только при серьезных
нехватках воды. Такая ситуация
нередко складывается, когда
города, дороги, фермы уже построены,
подземные воды эксплуатируются
необходимыми темпами, т. е. вложение
средств достигло такого размера,
что обжитый район не может быть
оставлен. Тогда прибегают к таким
дорогостоящим мероприятиям, как
искусственное пополнение подземных
вод, регулирование откачки,
переброска воды из других районов
и очистка сточных вод для повторного
использования.
|
|
|
|


![]() Разведка
подземных вод
Гидрологические
и гидрогеологические методы
Разведка
подземных вод
Гидрологические
и гидрогеологические методы

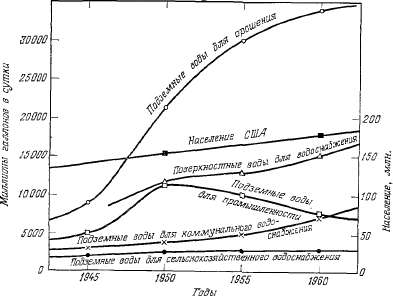






















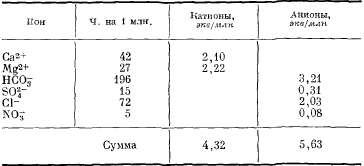
 (3.1)
(3.1)