
- •Оглавление
- •Глава 1. Химическая термодинамика процессов горения
- •Глава 2. Кинетика химических реакций горения…………………30
- •Глава 3. Процессы теплообмена на пожаре ……………………….49
- •Глава 4. Свойства и поведение веществ в раздробленном
- •Предисловие
- •Химическая термодинамика процессов горения и его прекращения Общие положения
- •Расчет стандартной энтальпии, стандартной энтропии, стандартной энергии Гиббса реакции горения при температуре 298 k
- •1.2. Изменение энергии Гиббса − критерий направленности протекания реакция горения
- •Расчет стандартной изобарной теплоемкости реакции горения при заданной температуре
- •Расчет изменения стандартной энтальпии реакции горения в зависимости от температуры
- •Расчет изменения стандартной энтропии реакции горения в зависимости от температуры
- •Расчет изменения стандартной энергии Гиббса реакции горения в зависимости от температуры
- •Примеры решения задач
- •Термодинамические свойства, необходимые для расчета изменения изобарной
- •1.24. Рассчитайте значения термодинамических характеристик горения (с , rН , rS , rG ) веществ при заданной температуре т согласно данным табл. 1.4.
- •Контрольные вопросы
- •Кинетика химических реакций горения Общие положения
- •2.1. Скорость реакции горения
- •2.2. Влияние температуры на скорость горения. Правило Вант-Гоффа. Уравнение Аррениуса
- •Примеры решения задач
- •Контрольные вопросы
- •Процессы теплообмена на пожаре Общие положения
- •Перенос теплоты теплопроводностью
- •3.2. Конвективный теплоперенос на пожаре
- •3.3. Теплоперенос излучением от пламени
- •Примеры решения задач
- •Контрольные вопросы
- •Свойства и поведение веществ в раздробленном (дисперсном) состоянии Общие положения
- •4.1. Количественные характеристики веществ в раздробленном состоянии
- •4.2. Поверхностное натяжение воды и материалов
- •4.3. Свойства дисперсных материалов
- •4.4. Особенности горения пылей и порошков
- •Примеры решения задач
- •Контрольные вопросы
Кинетика химических реакций горения Общие положения
Химическая термодинамика не может ответить на вопросы о том, как долго осуществляется данный процесс и какова его скорость. Эти вопросы как механизм химической реакции, в том числе реакции горения, изучаются химической кинетикой.
Химическая кинетика содержит два основных раздела:
1) формальная кинетика (формально-математическое описание скорости химической реакции без учета действующего механизма);
2) учение о механизмах химических взаимодействий.
Основной кинетической характеристикой в химическом процессе является скорость реакции.
Скорость химической реакции есть изменение концентрации реагирующих веществ в единице объема за единицу времени. Ее размерность [кг/(м3·с) или моль /(м3·с)].
В случае односторонних (необратимых) химических реакций, какими являются рассматриваемые реакции горения, концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Определение средней скорости реакции в интервале времени от начала реакции 1 до ее окончания 2 (Δ = 2 − 1) рассматривается следующим образом:
![]() .
(2.1)
.
(2.1)
В различных интервалах времени средняя скорость химической реакции может иметь разные значения. Истинная (мгновенная) скорость реакции определяется как производная концентрации исходного вещества по времени:
![]() .
(2.2)
.
(2.2)
(Знак "минус" означает, что количество реагирующего вещества уменьшается через накопление одного из продуктов реакции).
Скорость
реакции, как правило, уменьшается с
течением времени. Графическое
изображение зависимости концентрации
реагентов от времени называется
кинетической
кривой
С
=
f![]() (рис. 2.1).
(рис. 2.1).
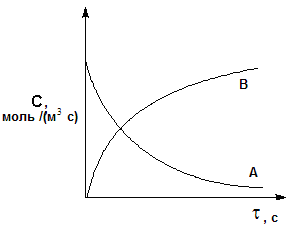
Рис. 2.1. Кинетические кривые для исходных веществ (А) и
продуктов реакции (В)
Графически
скорость реакции выражается величиной
углового коэффициента касательной в
точке кинетической
кривой, соответствующей
выбранному моменту времени
(рис. 2.2).
Истинная скорость реакции в данный
момент времени равна по абсолютной
величине тангенсу угла наклона
касательной: ![]() .
(2.3)
.
(2.3)
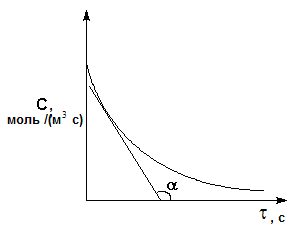
Рис. 2.2. Графическое определение скорости реакции
Скорость химической реакций, в том числе реакции горения, зависит от природы реагирующих веществ, концентрации, температуры, давления, наличия катализаторов, состояния поверхности раздела фаз, условий тепло-, массообмена и т.д.
2.1. Скорость реакции горения
Одной из задач химической кинетики является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции.
Различают кинетику гомогенных реакций и кинетику гетерогенных реакций. В гетерогенных системах процесс химического взаимодействия состоит из двух последовательных стадий:
диффузии реагирующих веществ к поверхности раздела фаз;
химического взаимодействия на поверхности.
Скорость процесса определяется наиболее медленной стадией, которая называется лимитирующей или определяющей стадией. Если скорость процесса определяется химическим взаимодействием веществ на поверхности, то говорят, что реакция протекает в кинетической области. Если же определяющей является стадия диффузии, то считается, что реакция протекает в диффузионной области. Скорости в кинетических и диффузных областях могут очень сильно различаться.
Уравнение процесса горения в общем виде можно записать следующим образом:
n ГВ + m ОК = S ni ПГi,
где ГВ и ОК − химические формулы горючего вещества и окислителя; ПГi − химическая формула i-го продукта горения; n, m, ni − стехиометрические коэффициенты при соответствующих веществах.
Согласно закону действующих масс при постоянной температуре скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в степенях их стехиометрических коэффициентов.
Для гомогенных реакций скорость реакции определяется по выражению
![]() ,
кг/(м3с),
(2.4)
,
кг/(м3с),
(2.4)
где k – константа скорости реакции (коэффициент пропорционально
сти, численно равный скорости реакции при концентрациях всех реа-
гирующих веществ, равных 1 моль/л); Сгор – концентрация горючего
вещества, кмоль/м3; Сок – концентрация окислителя, кмоль/м3; m и n
– стехиометрические коэффициенты при концентрациях горючего и
окислителя.
Для гетерогенных систем скорость реакции рассчитывают как
![]() ,
кг/(м3·с).
(2.5)
,
кг/(м3·с).
(2.5)
Концентрация твердого вещества в ходе реакции практически не изменяется.
Например, скорость реакции горения пропана в кислороде
С3Н8 + 5О2 = 3СО2 + 4Н2О ;
выразится
уравнением ![]() =
k
[С3Н8][О2]5.
=
k
[С3Н8][О2]5.
Скорость реакции горения бутана в воздухе
С4Н10 + 6,5(О2 + 3,76 N2) = 4СО2 + 5Н2О + 6,5·3,76 N2 ;
= k [С4Н10][(О2 + 3,76N2)]6,5.
Если в реакции горения наряду с парами и газами участвуют еще и твердые вещества, то скорость реакции, протекающей на поверхности вещества, изменяется только в зависимости от концентрации газообразных компонентов. Эта зависимость выражается уравнением
= k [О2]n. (2.6)
Например, скорость горения серы или угля выражается математическим уравнением
S + (O2 + 3,76 N2) = SO2 + 3,76 N2 ;C + (O2 + 3,76N2)= CO2 + 3,76 N2 ;
= k [О2].
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции.
Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (соответственно m и n) называется частным порядком реакции по данному компоненту. Знание частных порядков реакции позволяет определить вклад того или иного компонента в скорость химической реакции. Сумма показателей степени в кинетическом уравнении химической реакции (m + n) представляет собой общий порядок реакции.
Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени. Суммарное уравнение реакции горения, которая является многостадийной и зачастую цепной, как правило, не отражает истинного механизма ее протекания, поэтому порядки реакции в уравнении далеко не всегда совпадают со значением стехиометрических коэффициентов в уравнении.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Реакции могут быть нулевого, 1-го, 2-го, 3-го, а также дробного порядка (для сложных реакций, протекающих через промежуточные стадии). В случае протекания сложной многостадийной реакции, в частности для процессов горения, порядок реакции может принимать значения выше трех. В этом случае его следует называть формальным, не учитывающим механизм, а только отражающим стехиометрические коэффициенты при реагентах в уравнении реакции.
Для определения частных порядков используется несколько методов. Наиболее простой метод подстановок. Суть его заключается в следующем. Экспериментальные данные зависимости концентрации от времени С = f() подставляют в кинетические уравнения для различных порядков и определяют, при использовании какого уравнения константа скорости реакции постоянна (k = const). Иногда используют графический вариант этого метода. При получении прямой в координатах lgC(τ) реакция 1-го порядка, 1/С(τ) 2-го порядка, 1/С2(τ) 3-го порядка.
