
- •Часть III
- •Содержание
- •Лабораторный практикум:
- •Формулы для приближенных вычислений.
- •Тригонометрические формулы.
- •Изучение явления теплоотдачи
- •§1.Элементы теории теплоотдачи
- •§2. Графическое представление результатов
- •§3. Экспериментальное изучение явления остывания воды.
- •Расчеты и выводы Контрольные вопросы.
- •Литература:
- •Определение удельной теплоемкости металлов
- •Введение: опыт и модельно-теоретические представления о теплоемкости атомных и ионных кристаллов.
- •§1. Закон Дюлонга-Пти.
- •§2. Отклонения в экспериментальной зависимости теплоемкости (молярной и удельной) атомных кристаллов от закона Дюлонга-Пти.
- •§3. Квантово-механические представления о составляющих, определяющих теплоемкость атомных кристаллов.
- •Эксперимент
- •§4. Определение удельной теплоемкости металла калориметрическим методом.
- •Последовательность экспериментальной работы:
- •§5. Определение удельной теплоемкости твердых тел методом остывания.
- •5.1 Метод и расчетные формулы
- •Эксперимент
- •Вертикальный разрез образца и гнезда крепления измерительного узла термопары.
- •Расчеты и выводы: Контрольные вопросы:
- •Литература.
- •Теоретическое введение
- •§1. Диаграммы состояний и плавкости однокомпонентных систем.
- •§2. Диаграммы состояний и плавкости двухкомпонентных систем.
- •§2А. Твердые растворы: диаграмма состояний и плавкости.
- •§2Б. Эвтектические сплавы: диаграммы состояния и плавкости.
- •Диаграммы плавкости сплавов эвтектического состава.
- •Диаграммы плавкости эвтектических сплавов с превышением одного из компонентов от эвтектического состава.
- •Эксперимент
- •Работа с потенциометром постоянного тока пп-63.
- •Контрольные вопросы:
- •Рекомендуемая литература:
- •Определение средних значений коэффициентов линейного и объемного расширения конденсированных сред. Теоретическое введение
- •§1. Физические характеристики (коэффициенты) теплового расширения.
- •§2. Объяснение теплового расширения.
- •Металлический тип связи между положительными ионами жидкости или твердого тела, осуществляемый свободными электронами (рис.1).
- •1. Экспериментальное определение коэффициентов линейного расширения.
- •Экспериментальное определение коэффициентов объемного расширения жидкостей
- •Газовый термометр: градуировка и измерение температуры.
- •§1. Теоретическое введение.
- •§2. Термодинамические (рабочие) тела, температурные параметры в различных методах измерения температуры.
- •§3. Порядок выполнения работы.
- •Контрольные вопросы:
- •Литература:
Расчеты и выводы Контрольные вопросы.
Сформулируйте I начало термодинамики по отношению к процессам теплообмена; к процессам, протекающим в калориметре.
Какая из предложенных в §3, пункт 1 ситуаций для исследования Вам кажется наиболее приемлемой (самой интересной!)?
Назовите возможные систематические погрешности, которые могут вести к искажению результатов полученных в предлагаемых экспериментах.
Приведите примеры систем, у которых не монотонно меняются физические характеристики от времени.
Литература:
Р.В. Телеснин. Молекулярная физика. М.: Высшая школа, 1973, §64 (Закон охлаждения Ньютона); §65 (Конвекция). !*Обязательно прочесть.
В.Ф. Яковлев. Курс физики (теплота и молекулярная физика) М. 1976. §15 (Измерение теплоемкости), §16 (Внутренняя энергия как функция состояния).
Энциклопедия и физические энциклопедические словари на слова: теплообмен и теплоотдача.
Определение удельной теплоемкости металлов
Удельной теплоемкостью однородной материальной среды принято называть то количество теплоты, которое необходимо сообщить единице массы системы, чтобы изменить её температуру на единицу.
![]()
Для
конденсированных сред в большинстве
ситуаций (исключая область близкую к
критическому состоянию жидкости)
![]() мало значимо в сравнении с изменением
внутренней энергии Duх.
Следовательно, корректно считать:
мало значимо в сравнении с изменением
внутренней энергии Duх.
Следовательно, корректно считать:
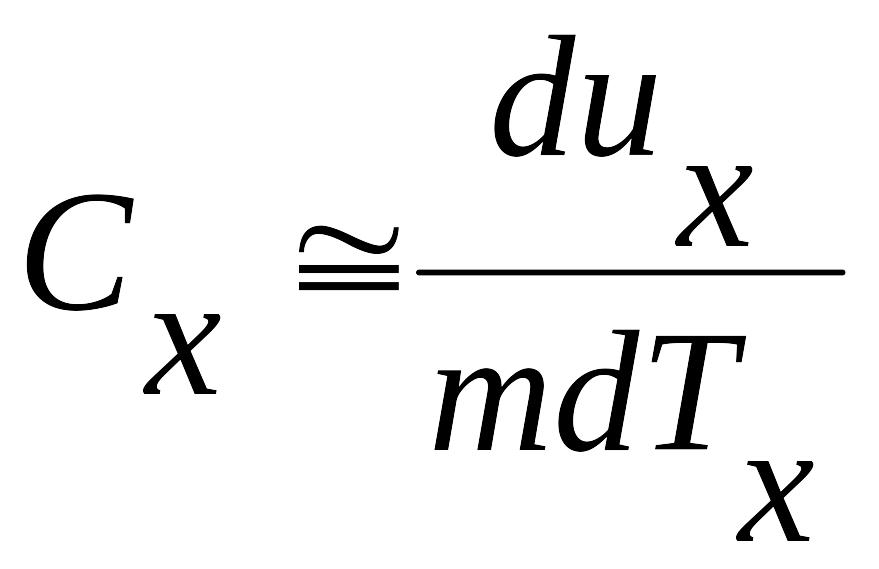
Сравнивая СV и Сp таких сред, важно отметить, что
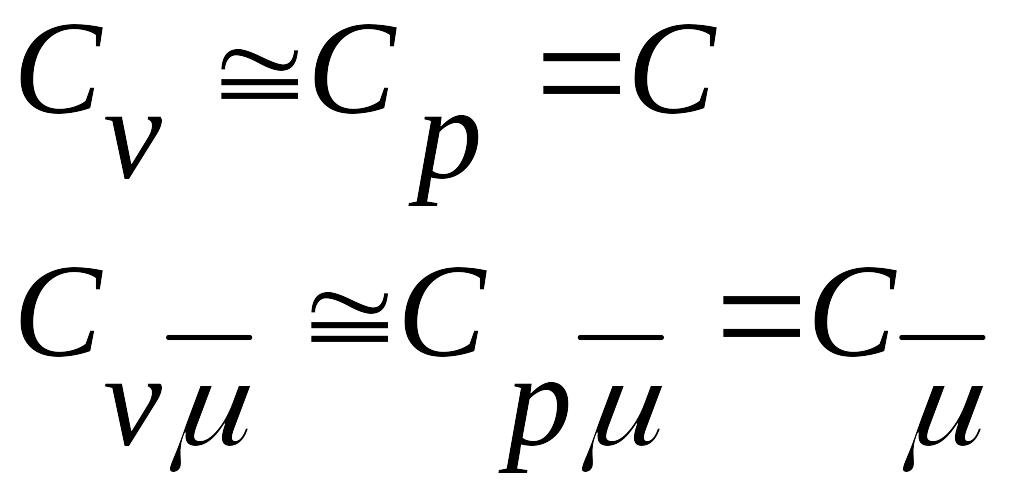
Введение: опыт и модельно-теоретические представления о теплоемкости атомных и ионных кристаллов.
§1. Закон Дюлонга-Пти.
К 1819 году французскими учеными Дюлонгом и Пти лабораторно-опытным путем был установлен закон о теплоемкости металлов в твердой фазе: произведение удельной теплоемкости и атомного веса простых твердых тел (атомных кристаллов металлов) является величиной почти одинаковой (таблица 1).
Таблица 1.
В-во
характеристика |
|
(сталь) |
|
|
|
|
С
Сm
|
896
24,2 |
460
25,7 |
395
25,1 |
234
25,3 |
126
26,1 |
230
27,3 |
Теоретически обосновать этот закон о молярной теплоемкости атомных кристаллов (металлов и ионных структур типа NaCl, LiF, CaCl2) удалось только с учетом представлений развитых Л. Больцманом о средней энергии, приходящейся на различные степени свободы хаотического движения микрочастиц (поступательное – пхдм; вращательное – вхдм; колебательное – кхдм). В классическом приближении, когда энергетический спектр разрешенных (дозволенных) значений энергии непрерывен, средняя энергия на одну степень свободы:
п.х.д.м. и в.х.д.м. -
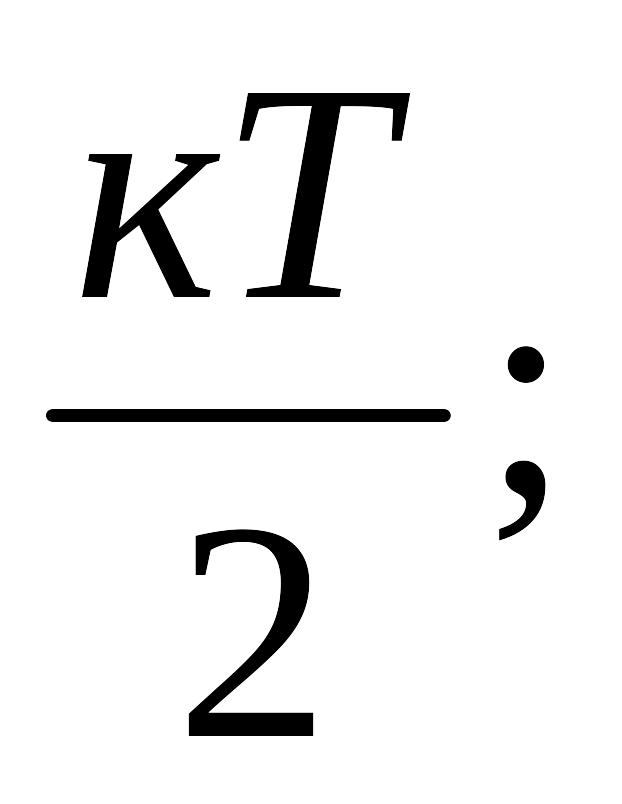
к.х.д.м. – кТ = (
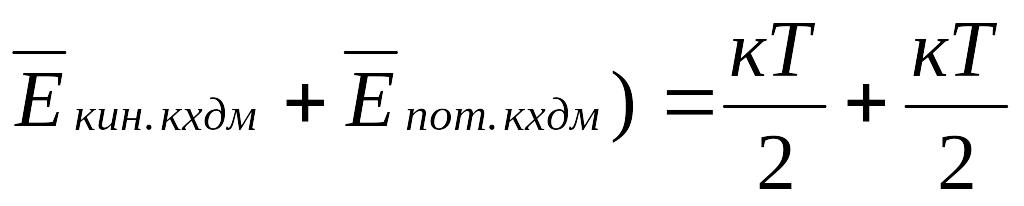
В
соответствии с классическим приближением
ионы металла колеблются в узлах
кристаллической решетки, а, обладая
тремя степенями свободы, характеризуются
средним значением
![]() .
.
![]()
![]()
![]() (1.2)
(1.2)
Именно вблизи этого значения и находятся экспериментальные данные, приведенные в таблице 1 и подтверждающие закон Дюлонга – Пти.
*Заключение, аналогичное (1.1) и (1.2) можно сделать и для ионных твердых тел (кристаллы NaCl, LiF, CaCl2 и др.), если учесть, что каждый ион структуры реализует три степени свободы:
для двухатомных кристаллов
![]()
для трехатомных
![]()
** Об ожидаемом вкладе свободных электронов металлов в удельную теплоемкость.
В классическом приближении электронный газ металлов (свободные электроны) должен давать существенный вклад в теплоемкость. Если допустить, что каждый атом дает один свободный электрон (строго соблюдается в щелочных металлах Na, К, Cs и др.), то внутренняя энергия моля металла должна быть:
![]() (1.3)
(1.3)
![]() ;
(
;
(![]() - ожидаемая электронная составляющая
теплоемкости;
- ожидаемая электронная составляющая
теплоемкости;
![]() - ожидаемая решеточная составляющая).
- ожидаемая решеточная составляющая).
Однако реальность не подтверждает такого вклада электронов в теплоемкость металлов. В широком температурном интервале этот вклад мал. Только при высоких температурах (близких или превышающих тысячу К) вклад этот становится значимым.
