
- •Часть II
- •Содержание.
- •Лабораторный практикум:
- •Формулы для приближенных вычислений
- •Тригонометрические формулы
- •Определение абсолютной и относительной влажности воздуха
- •§1. Основные представления о водяном паре и влажности воздуха
- •§2. Диаграмма состояний в системе жидкость-пар и зависимость давления, насыщенного пара от температуры
- •§3. Определение влажности воздуха конденсационным гигрометром Ламбрехта (по точке росы)
- •§4. Измерение относительной влажности с помощью психрометров
- •Как пользоваться психрометрическим графиком (номограммой).
- •Контрольные вопросы и задания.
- •§1. Качественный анализ особого состояния поверхностного слоя
- •§ 2. Динамический анализ особого состояния поверхностного слоя
- •§ 3. Энергетический анализ особого состояния поверхностного слоя
- •§ 4. Связь между динамическим и энергетическим коэффициентами поверхностного натяжения
- •§ 5. Давление Лапласа
- •II. Экспериментальное определение коэффициента поверхностного натяжения жидкостей
- •По высоте подъема в капиллярных трубках.
- •2 . По методу отрыва капель
- •3. По методу выдувания пузыря из мыльной пленки
- •Порядок выполнения.
- •4. По методу отрыва рамки.
- •Контрольные вопросы:
- •Литература:
- •Зависимость температуры кипения жидкости от давления
- •§1. Пузырьковое кипение.
- •§2. Дифференциальная и интегральная зависимость температуры кипения от внешнего давления (или: давления насыщенного пара от температуры).
- •§3. Диаграмма состояний однокомпонентной системы.
- •§4. Экспериментальное изучение зависимости Ткип(р).
- •Порядок выполнения работы.
- •Расчеты и выводы: Контрольные вопросы:
- •Литература:
- •Зависимость вязкости жидкостей от температуры.
- •Теоретическое введение.
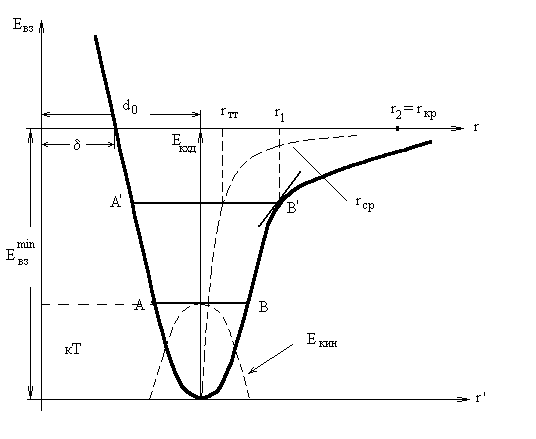
- •§1.Объяснение некоторых свойств систем с учетом особенностей взаимодействия двух молекул.
- •§ 2. Согласованное поле периодической структуры.
- •§3. Использование представлений о согласованном потенциальном поле для объяснения некоторых физических свойств конденсированных сред.
- •§4. Дефекты в кристаллах и температурная зависимость вязкости в жидкостях.
- •Эксперимент и обработка его результатов.
- •Расчеты и выводы: Контрольные вопросы:
- •Литература:
Федеральное агентство по образованию
Поморский государственный университет имени М.В.Ломоносова
Кафедра общей физики
Лабораторный практикум
по молекулярной физике
Часть II
Архангельск
САФУ 2011
Методические рекомендации для студентов 1-го курса физического факультета ПГУ.
П о с в я щ а ю т с я
сыну и отцу физико-математического факультета
Дубровину
Павлу Васильевичу
(27 августа 1912 – 30 июля 1975)
Автор-составитель и редактор методических рекомендаций:
доцент кафедры общей физики Колпачников Г.Н.
Кафедра общей физики ПГУ имени М.В. Ломоносова.
Лаборатория механики и молекулярной физики.
Г руппа
__________ Фамилия И.О. студента ______________
руппа
__________ Фамилия И.О. студента ______________
Содержание.
Стр.
Периодическая система элементов 4
Формулы приближенных вычислений, тригонометрические формулы 5
Лабораторный практикум:
1. Определение абсолютной и относительной влажности воздуха 6
Определение коэффициентов поверхностного натяжения
жидкостей. 18
Зависимость температуры кипения воды от давления: Tкип (P) 35
4. Зависимость вязкости жидкостей от температуры 44
Автор-составитель искренне благодарен тем, кто принимал участие в постановке и модернизации работ практикума, в подготовке настоящих методических рекомендаций: Лазаревой О.В., Абикулову И.В., Тюкину Д.А, Михайлову И.Н, Орлову А.В. и др.

Формулы для приближенных вычислений
Если а << 1, то в первом приближении можно принять:

Если угол мал ( < 5о или < 0,1 рад) и выражен в радианах, то в первом приближении можно принять:
![]()
Тригонометрические формулы
sin (x + y) = sin x cos y + sin y cos x sin (x – y) = sin x cos y – sin y cos x
cos (x + y) = cos x cos y – sin x sin y cos (x – y) = cos x cos y + sin x sin y
sin 2x = 2sin x cos y cos 2x = cos2x – sin2x
sin2x = ½(1 – cos 2x) cos2x = ½(1+cos 2x)
sin аx sin bx = ½ cos (a – b)x – ½ cos (a+b)x
sin ax cos bx = ½ sin (a + b)x + ½ sin (a – b)x
Определение абсолютной и относительной влажности воздуха
Цель работы: сформулировать основные понятия, характеризующие влажность воздуха, овладеть приборными методами определения характеристик влажности, понять суть показаний барометра-анероида и погодных примет, касающихся выпадения осадков.
§1. Основные представления о водяном паре и влажности воздуха
Бытовая практика и совершенные молекулярно-кинетические представления показывают, что в газообразном состоянии водяной пар при заданной докритической температуре (Тк = 374оС = 647 К; Рк = 218 атм. = 22,0106 Па; к = 3,21105 г/м3 = 3,21102 кг/м3) может достичь максимального давления и плотности. Такой пар называют насыщенным. Если насыщенный пар находится в равновесии с жидкостью, то это равновесие принято называть динамическим равновесием: сколько молекул испаряется из жидкости столько же в нее и возвращается (конденсируется) за выбранный промежуток времени.
Таблица 1.
Давление и плотность насыщенного водяного пара в зависимости от температуры Т.
Температура |
Р, Па |
г/м3 = 10-3 кг/м3 |
||
toC |
T К |
|||
- 20 - 19 - 18 - 17 - 16 - 15 - 14 - 13 - 12 - 11 - 10 - 9 - 8 - 7 - 6 - 5 - 4 - 3 - 2 - 1 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 40 50 60 70 80 90 100 |
253
|
102,6 113,3 125,3 137,3 150,6 165,3 181,3 198,6 217,3 237,3 259,9 283,9 337,2 351,9 367,9 401,2 437,2 475,9 517,2 562,5 610,5 656,1 758,4 797,3 812,1 871,8 934,4 1001,1 1073,1 1147,7 1227,7 1300,7 1402,3 1497,0 1598,3 1704,9 1817,0 1943,5 2063,5 2196,8 2338,1 2486,1 2643,4 2808,6 2983,3 3167,2 3360,5 3564,5 3779,0 4004,3 4241,6 7374,2 12330,3 19915,0 31152,2 47334,8 70089,1 101308,0 |
0,85 0,96 1,05 1,15 1,27 1,38 1,51 1,65 1,80 1,96 2,14 2,33 2,54 2,76 2,99 3,24 3,51 3,81 4,13 4,47 4,84 5,22 5,60 5,98 6,40 6,84 7,3 7,8 8,3 8,8 9,4 10,0 10,7 11,4 12,1 12,8 13,6 14,5 15,4 16,3 17,3 18,65 19,4 20,6 21,8 23,0 24,4 25,8 27,2 28,7 30,3 51,2 83,0 130 198 293 424 598 |
8,5 10-4 9,6 10-4 1,05 10-3 1,1510-3 1,2710-3 1,3810-3 1,5110-3 1,6510-3 1,8010-3 1,9610-3 2,1410-3 2,3310-3 2,5410-3 2,7610-3 2,9910-3 3,2410-3 3,5110-3 3,8110-3 4,1310-3 4,4710-3 4,8410-3 5,2210-3 5,6010-3 5,9810-3 6,4010-3 6,8410-3 7,310-3 7,810-3 8,310-3 8,810-3 9,410-3 10,010-3
10,7·10-3 11,4·10-3 12,1·10-3 12,8·10-3 13,6·10-3 14,5·10-3 15,4·10-3 16,3·10-3 17,3·10-3 18,65·10-3 19,4·10-3 20,6·10-3 21,8·10-3 23,0·10-3 24,4·10-3 25,8·10-3 27,2·10-3 2,8710-2 3,0310-2 5,1210-2 8,3010-2 13,010-2 0,198 0,293 0,424 0,5980,60 |
tк = 374 |
647 |
22,0106 |
3,27 105 |
0,324 103 |
! Если температура измерена до долей градуса, то рекомендуем воспользоваться методом интерполяции. К примеру, температура 29,6оС:
Р29 = 4004 Па;
Р30 = 4242
![]() .
.
Давление и плотность водяного пара в воздухе в большинстве случаев не достигают максимально возможных величин. Такой пар называют ненасыщенным, а значения Р и (их величины) абсолютной влажностью. Абсолютную влажность (в том числе и максимальную) можно измерять, как в единицах давления, так и плотности, т. к. при состояниях далеких от критического (данные о критическом состоянии приведены) пар с достаточно высокой степенью точности следует уравнение Клапейрона-Менделеева:
![]()
Абсолютную влажность вне зависимости от единиц измерения принято обозначать буквой E. Максимально возможную при данной температуре Ео.
Тогда:
Ео – Е = ΔЕ - разность между максимально возможной и реальной влажностью при данной температуре называют дефицитом влажности;
отношение
![]() называют относительной влажностью;
[r] = %.
называют относительной влажностью;
[r] = %.
Задание 1.
Покажите, воспользовавшись таблицей 1, что в интервале температур (-20 100) оС водяной пар действительно следует уравнению состояния идеального газа, просчитайте для 5-ти точек через 20оС. Существенные отклонения от этого уравнения будут в критической точке (и, конечно, вблизи ее; проверьте).
Знание характеристик влажности воздуха (абсолютной, максимально возможной и относительной) очень важно для процессов, протекающих в природе (погода, поведение животных и растений), и жизнедеятельности человека. Терморегуляция растений, животных и человеческого тела практически полностью определяется процессами испарения воды.
При испарении, т.е. переходе молекул из жидкости в пар, происходит понижение температуры. Это связано с тем, что жидкость покидают наиболее быстрые молекулы, энергии которых достаточно для совершения работы выхода. Жидкость обедняется быстрыми молекулами, а, следовательно, их средняя энергия в ней уменьшается, а температура понижается. Ясно, что интенсивность испарения (число молекул, покидающих жидкость в единицу времени) зависит от поверхности жидкости, скорости удаления паров, от относительной влажности окружающей среды и температуры жидкости.
Несколько замечаний о влиянии влажности на самочувствие людей. Различная относительная влажность при одинаковой температуре создает различное самочувствие. Причина тому – интенсивность испарения при дыхании и с поверхности тела. Если относительная влажность мала, т.е. воздух сухой, испарение, а, следовательно, и охлаждение происходит быстро. Если воздух влажный, охлаждение незначительно. Так, например, при температуре 25о - 30оС и r = 25% можно чувствовать себя хорошо. При такой же температуре, но r = 80 - 90% будет ощущаться жар и дискомфорт. При температуре 18оС и r = 25% ощущается холод. При той же температуре и r = 60% человек чувствует себя хорошо. Установлено, что для хорошего самочувствия необходима относительная влажность 40-60%. Зимой обычно относительная влажность в помещении пониженная. Это связано с проникновением с улицы холодного воздуха, который содержит мало влаги. В жилых помещениях в это время года необходимо поддерживать искусственным путем оптимальное значение относительной влажности, как для человека, так и растений (цветы) – ставят открытые сосуды с водой.
Очевидно, что при
понижении температуры воздушной среды
ненасыщенный пар может перейти в
насыщенный. Так пар с плотностью 10,0 г/м3
при температуре 25оС будет
ненасыщенным с относительной влажностью
![]() .
Если же температуру понизить до 11оС,
то пар будет насыщенным. Малейшее
понижение температуры (чуть меньше
11оС) будет сопровождаться
конденсацией пара – на предметах,
находящихся в воздушной среде, выпадет
роса.
.
Если же температуру понизить до 11оС,
то пар будет насыщенным. Малейшее
понижение температуры (чуть меньше
11оС) будет сопровождаться
конденсацией пара – на предметах,
находящихся в воздушной среде, выпадет
роса.
