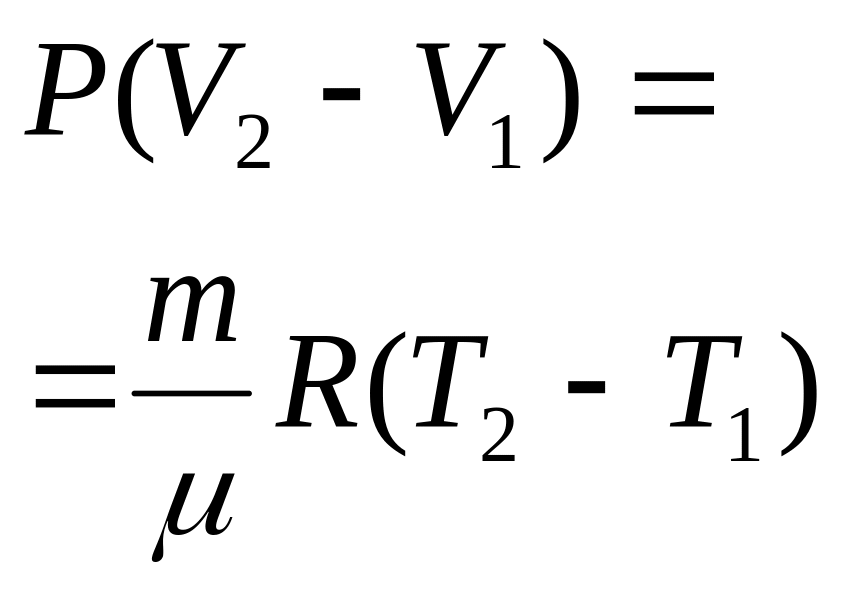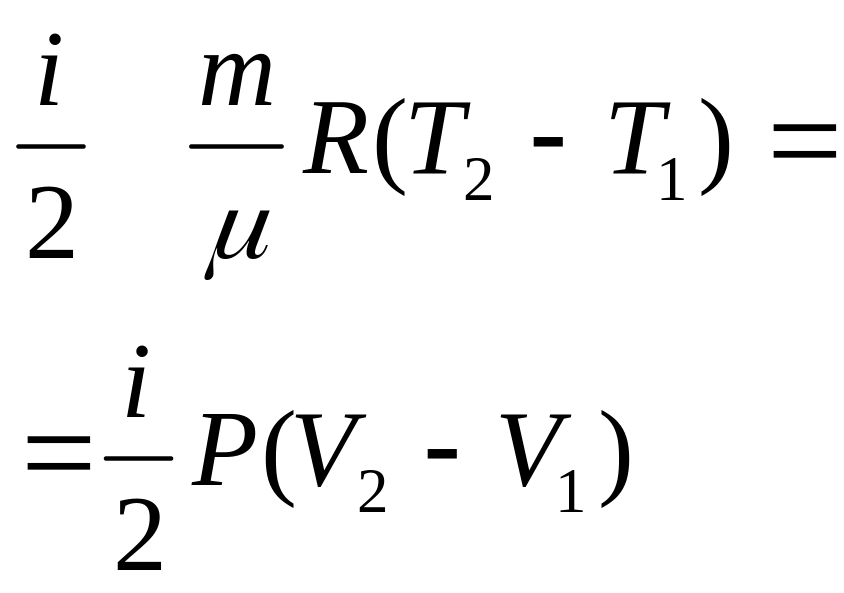- •Часть I
- •Содержание.
- •Лабораторный практикум:
- •Измерения, их погрешности и обработка результатов измерений.
- •Обработка результатов прямых измерений.
- •II. Значащие и запасные цифры в числах и вычислительные операции с этими числами.
- •III. Обработка и представление результатов косвенных измерений.
- •Некоторые числа и физические константы, используемые при расчетах:
- •Формулы для приближенных вычислений
- •Некоторые математические формулы и соотношения:
- •Тригонометрические формулы
- •Формулы дифференциального и интегрального исчислений
- •Определение удельной теплоты плавления льда калориметрическим методом
- •§1. Характеристики процессов теплообмена.
- •§2. Энергетика фазовых переходов при плавлении и кристаллизации.
- •§3. Экспериментальные закономерности для процессов плавления.
- •§4. Общие принципы калориметрических измерений.
- •§5. Определение удельной теплоты плавления льда при атмосферном давлении (определяется по барометру и пересчитывается в Па с учетом 3х значащих цифр).
- •Расчеты.
- •Контрольные вопросы:
- •Литература:
- •Теоретическая часть:
- •§1. Основные понятия.
- •§2. Законы изопроцессов и уравнение Клапейрона (уравнение для любых реальных идеальных газов).
- •§3. Уравнение состояния однокомпонентного идеального газа – уравнение Клапейрона-Менделеева.
- •§4. Физический смысл универсальной газовой постоянной.
- •§5. Давление. Разность давлений. Измерение давления и разности давлений.
- •I. Экспериментальное определение r методом откачивание воздуха из сосуда определенного объема.
- •II. Определение r методом впрыскивания в сосуд с воздухом легко испаряющейся жидкости.
- •Результаты эксперимента и обработки данных представлены в таблице №2.
- •Контрольные вопросы:
- •Теоретическое введение
- •§1. Внутренняя энергия идеального газа
- •§3. О воздухе.
- •§4. Адиабатный и политропический процессы.
- •§4А. Постройте графики изопроцессов, включая адиабатный, в различных координатах:
- •§4Б. Политропические процессы при различных “n” и их графическое представление.
- •§6. Экспериментальное определение для воздуха.
- •1. Описание метода Клемана и Дезорма (приближение Клемана-Дезорма).
- •2. Измерения и обработка результатов.
- •Контрольные вопросы:
- •Литература:
- •Определение коэффициента внутреннего трения воздуха.
- •Явления переноса
- •§ 1. Феноменологическое описание явлений переноса
- •§2. Модель явления внутреннего трения в идеальном газе.
- •Экспериментальное определение коэффициента внутреннего трения η в газовых средах (в воздухе)
- •§3. Вывод рабочей формулы (формулы Пуазейля) для определения коэффициента вязкости .
- •§4. Методы экспериментального определения и обработка результатов измерений.
- •4.1. По методу натекания воздуха из атмосферы через капилляр в разряженную среду.
- •4.2. По выталкиванию воздуха через капилляр в атмосферу.
- •Измерения и обработка данных для первого и второго предлагаемых методов.
- •4.3. По натеканию воздуха через капилляр в разреженную среду.
- •§5. Расчёт средней длины свободного пробега ( ) и эффективного диаметра молекулы воздуха
- •Контрольные вопросы:
Контрольные вопросы:
Графики изопроцессов с реальным идеальным газом в координатах PV, P,T (P, tоC); V,T (V,tоC).
Построить поверхность, соответствующую УС идеального газа определенной массы m в координатах PVT.
Систематические погрешности в предлагаемых методах определения R и возможные методы уменьшения их влияния.
ЛИТЕРАТУРА:
Кикоин А. К., Кикоин И. К. Молекулярная физика. М., «Наука», 1976.
Сивухин Д. В. Общей курс физики, т. II. М., 1975, §7, 8, 9.
Штрауф Е. А. Молекулярная физика. Л.,1949, стр. 138-147.
Шубин А. С. Курс общей физики. М., «Высшая школа»,1976.
Яковлев В. Ф. Курс физики. Теплота и молекулярная физика. М., «Просвещение», 1976, §7, 8, 9, 10.
Определение отношения изобарической и изохорической теплоемкостей воздуха методом
Клемана и Дезорма.
Цель работы: экспериментально, используя метод Клемана и Дезорма, определить отношение теплоемкостей в изобарическом и изохорическом процессах для воздуха; сравнить полученный результат с ожидаемым из модельно-теоретических представлений; выявить возможные систематические погрешности и попытаться их устранить.
Теоретическое введение
§1. Внутренняя энергия идеального газа
В соответствии с моделью идеального газа изменение расстояния между молекулами при не ведет к изменению энергии взаимодействия. Поэтому внутренняя энергия идеального газа от объема не зависит. Так как потенциальная энергия взаимодействия Uпотенц = const, то можно принять ее для идеального газа равной 0. Тогда U идеального газа представить, как сумму 3-х слагаемых:
U = Uп.х.д.м. + Uв.х.д.м. + Uк.х.д.а.м., (1)
где:
Uп.х.д.м. – кинетическая энергия поступательного хаотического движения молекул,
Uв.х.д.м. – кинетическая энергия вращательного хаотического движения молекул,
Uк.х.д.а.м. – механическая энергия, связанная с колебательным хаотическим движением атомов в молекулах.
Внутренняя энергия данной массы идеального газа зависит только от температуры. Однако внутренняя энергия одной и той же массы различных газов при одной температуре может отличаться, что определяется числом степеней свободы молекул. Число степеней свободы i – количество независимых координат, задающих положение молекулы в пространстве.
По теореме Больцмана: в условиях термодинамического равновесия средняя энергия, приходящаяся на одну степень свободы п.х.д.м. и в.х.д.м. – кТ/2; на одну степень свободы к.х.д.а.м. – кТ.
Внутренняя энергия некоторой массы идеального газа:
![]() (2)
(2)
где N – число молекул данного вида в системе.
Опыт показывает, (объяснение дает квантово-механическая теория), что в широком диапазоне температур молекулы двух- и трехатомных газов можно считать жесткими. Интервалы жесткости основных молекул, входящих в воздух: N2 – (29¸3300) К; О2 – (2,1¸3200) К; СО2 – (300¸2000) К; HСl – (3,0¸3300) К. Обусловлено это свойство молекул тем, что между атомами, в них входящими, реализуется достаточно сильная химическая связь – ковалентная связь.
В этом приближении N молекул однокомпонентного газа обладают внутренней энергией:
![]() (3)
(3)
где i – число степеней свободы, приходящихся на поступательное и вращательное хаотическое движение молекулы.
Таблица №1 (для жестких молекул).
Газ |
Одноатомный |
Двухатомный |
Многоатомный |
|
Линейные молекулы |
Пространственные молекулы |
|||
i |
3 |
5 |
5 |
6 |
Для моля такого газа:
![]() (4)
(4)
Для произвольной массы:
![]() (5)
(5)
В ситуации многокомпонентного газа:
![]() (6)
(6)
§2. Термическое и калорическое описание изопроцессов (V=const; p=const; T=const).
Если учесть уравнения и условия изопроцессов с идеальным газом и аналитическую зависимость внутренней энергии такого газа от Т, то первое начало термодинамики для произвольного элементарного процесса будет иметь вид:

В соответствии с (1) характеристики изопроцессов можно представить в таблице 2.
Термическое и калорическое описание изопроцессов.
Таблица 2.
Процессы |
А |
Du |
Q |
Теплоемкость |
|
Сх |
Схm |
||||
V=сonst (dV=0)
P=cT |
0 |
|
Qv=Du |
|
|
P = const (dP = 0)
V = сТ |
|
|
|
|
|
T = const (dT = 0) PV = const |
|
0 |
Qт = Ат |
±¥ |
±¥ |