- •Часть IV. Процессы нервной и гуморальной регуляции Глава 15. Общие принципы регуляции. М. Циммерман
- •15.1. Основные элементы цепей управления в биологии и технике Отличия рефлексов от систем управления
- •Структура системы управления
- •Глава 15. Общие принципы регуляции 335
- •Рефлекс растяжения — система для регуляции длины мышц
- •15.2. Динамическое и статическое поведение цепей управления Реакция на ступенчатое воздействие
- •Глава 15. Общие принципы регуляции 337
- •Работа следящей системы
- •Глава 15. Общие принципы регуляции 339
- •Работа системы управления в стационарном режиме
- •15.3. Особые свойства систем управления
- •Глава 15. Общие принципы регуляции 341
- •Сопряжение систем управления
- •15.4. Литература
- •Глава 16 вегетативная нервная система. В. Ениг
- •16.1. Периферический отдел вегетативной нервной системы Анатомическое подразделение вегетативной нервной системы
- •Глава 16. Вегетативная нервная система 345
- •Влияние симпатических и парасимпатических волокон на эффекторные органы
- •Глава 16. Вегетативная нервная система 347
- •Нейрогуморальная передача в периферическом отделе вегетативной нервной системы
- •Глава 16. Вегетативная нервная система 349
- •Мозговое вещество надпочечников. Общее действие адреналина и норадреналина
- •Глава 16. Вегетативная нервная система 351
- •Синаптическая организация периферического отдела вегетативной нервной системы
- •Глава 16. Вегетативная нервная система 353
- •Энтеральная нервная система
- •Глава 16. Вегетативная нервная система 355
- •Тонус вегетативных нервов в покое
- •Глава 16. Вегетативная нервная система 357
- •Спинальные вегетативные рефлексы
- •Глава 16. Вегетативная нервная система 359
- •Регуляция вегетативных функций на уровне ствола головного мозга
- •Глава 16. Вегетативная нервная система 361
- •16.3. Мочеиспускание и дефекация Нервная регуляция опорожнения мочевого пузыря
- •Глава 16. Вегетативная нервная система 363
- •Нервная регуляция опорожнения кишечника
- •Глава 16. Вегетативная нервная система 365
- •16.4. Половые рефлексы
- •Половые рефлексы у мужчин
- •Глава 16. Вегетативная нервная система 367
- •Половые рефлексы у женщин
- •Изменение других органов во время полового цикла
- •Глава 16. Вегетативная нервная система 369
- •16.5. Функции гипоталамуса
- •Функциональная анатомия гипоталамуса
- •Гипоталамо-гипофизарная система
- •Глава 16. Вегетативная нервная система 371
- •Гипоталамус и сердечно-сосудистая система
- •Глава 16. Вегетативная нервная система 373
- •Гипоталамус и поведение
- •16.6. Лимбическая система и поведение
- •Глава 16. Вегетативная нервная система 375
- •Элементы лимбической системы
- •Глава 16 вегетативная нервная система 377
- •Функции лимбической системы
- •Лимбическая система и эмоции
- •Глава 16. Вегетативная нервная система 379
- •Моноаминергические системы и поведение
- •Глава 16. Вегетативная нервная система 381
- •16.7. Литература
- •Глава 16. Вегетативная нервная система 383
- •Глава 17. Эндокринология. В. Вутке
- •17.1. Общая эндокринология Гормоны как носители информации
- •Глава 17. Эндокринология 385
- •Синтез и распад гормонов
- •Новые аспекты эндокринологии
- •Глава 17. Эндокринология 387
- •Методы изучения
- •Эндокринные цепи регуляции
- •Глава 17. Эндокринология 389
- •17.2. Система задней доли гипофиза Функциональная организация
- •Антидиуретический гормон
- •Глава 17. Эндокринология 391
- •Окситоцин
- •17.3. Система передней доли гипофиза
- •Гормоны аденогипофиза
- •Глава 17. Эндокринология 393
- •Регуляция секреции аденогипофиза
- •Гормон роста
- •Глава 17. Эндокринология 395
- •Пролактин
- •Глава 17. Эндокринология 397
- •17.4. Система щитовидной железы Образование и секреция тиреоидных гормонов
- •Глава 17. Эндокринология ш-
- •Функции тиреоидных гормонов
- •Патофизиологические аспекты
- •17.5. Система коры надпочечников
- •Глюкокортикоиды
- •Клетки, секретирующие проопиомеланокортин.
- •Глава 17. Эндокринология 401
- •Глава 17. Эндокринология 403
- •Андрогены надпочечников
- •Минералокортикоиды
- •Краткая характеристика стероидных гормонов
- •Глава 17. Эндокринология 405
- •17.6. Гормоны поджелудочной железы
- •Инсулин
- •Глава 17. Эндокринология 407
- •Глюкагон
- •Соматостатин
- •Регуляция уровня глюкозы
- •Глава 17. Эндокринология 409
- •Патофизиологические аспекты
- •17.7. Гомеостаз баланса кальция и фосфата
- •Гормональная регуляция
- •Патофизиология гомеостаза кальция
- •Глава 17. Эндокринология 411
- •17.8. Гормоны мозгового слоя надпочечников Катехоламины
- •17.9. Дополнительные эндокринные системы
- •17.10. Литература
- •Глава 17. Эндокринология 413
- •Часть V. Кровь и система кровообращения Глава 18 функции крови. X. Вайс, в. Елькманн
- •18.1. Основные положения
- •Функции крови
- •Объем крови
- •Гематокрит
- •Глава 18. Функция крови 415
- •18.2. Плазма крови
- •Электролиты плазмы
- •Глава 18. Функция крови 417
- •Б елки плазмы
- •Глава 18. Функция крови 4ш
- •Глава 18. Функция крови 421
- •18.3. Эритроциты Число, форма и размеры
- •Глава 18. Функция крови 423
- •Образование, продолжительность жизни и разрушение эритроцитов
- •Метаболизм и свойства мембран эритроцитов
- •Глава 18. Функция крови 425
- •Особые физико-химические свойства эритроцитов
- •18.4. Лейкоциты Общие свойства и образование лейкоцитов
- •Глава 18. Функция крови 427
- •Гранулоциты
- •Глава 18. Функция крови 429
- •Моноциты
- •Лимфоциты
- •Число лейкоцитов: методы подсчета и патологические сдвиги
- •18.5. Тромбоциты
- •Глава 18. Функция крови 431
- •18.6. Остановка кровотечения и свертывание крови Гемостаз
- •Глава 18. Функция крови 433
- •Свертывание крови и факторы свертывания
- •Глава 18. Функция крови 437
- •Фибринолиз
- •Глава 18. Функция крови 439
- •18.7. Защитная функция крови Классификация защитных механизмов
- •Специфические защитные механизмы
- •Глава 18. Функция крови 441
- •Глава 18. Функция крови 443
- •Глава 18. Функция крови 445
- •Неспецифические гуморальные защитные механизмы
- •Глава 18. Функция крови 447
- •Неспецифические клеточные защитные механизмы
- •Важнейшие этапы иммунного ответа
- •Глава 18. Функция крови 449
- •18.8. Группы крови человека
- •Система аво
- •Глава 18. Функция крови 451
- •Система Rh
- •Переливание крови
- •18.9. Литература
- •Глава 18. Функция крови 453
- •Глава 19. Функция сердца. Г. Антони
- •19.1. Строение и общая физиология сердца
- •Глава 19. Функция сердца 455
- •19.2. Основные механизмы возбуждения и электромеханического сопряжения в сердце
- •Возникновение и распространение возбуждения
- •Глава 19. Функция сердца 457
- •Характеристики процесса возбуждения на клеточном уровне
- •Глава 19. Функция сердца 459
- •Глава 19. Функция сердца 461
- •Связь между возбуждением и сокращением (электромеханическое сопряжение)
- •Вегетативная иннервация сердца; основные механизмы действия медиаторов вегетативной нервной системы
- •Глава 19. Функция сердца 463
- •464 Часть V. Кровь и система кровообращения
- •Глава 19. Функция сердца 465
- •19.3. Электрокардиография
- •Глава 19. Функция сердца 467
- •Происхождение экг
- •Глава 19. Функция сердца 469
- •Глава 19. Функция сердца 471
- •Отведения экг
- •Отведения от конечностей
- •Глава 19. Функция сердца 473
- •Использование экг в диагностике
- •Некоторые патологические типы экг
- •Глава 19. Функция сердца 475
- •Глава 19. Функция сердца 477
- •19.4. Механическая работа сердца
- •Функция клапанов сердца
- •Глава 19. Функция сердца 479
- •Сердечный цикл
- •Период нзоволюметрнческого расслабления.
- •Глава 19. Функция сердца 481
- •Функциональная анатомия и геометрия сокращения желудочков
- •Глава 19. Функция сердца 483
- •Инвазивные методы исследования сердца: внутрисердечные измерения
- •Глава 19. Функция сердца 485
- •19.5. Приспособление сердечной деятельности к различным нагрузкам
- •Причины изменений максимумов давления и объема.
- •Глава 19. Функция сердца 487
- •Саморегуляторные реакции сердца на кратковременные нагрузки объемом и давлением
- •Глава 19. Функция сердца 489
- •Динамика иннервируемого сердца in situ
- •Глава 19. Функция сердца 491
- •Приспособление сердца к длительной физической нагрузке
- •19.6. Энергетика сокращения сердца
- •Мощность и работа сердца
- •Глава 19. Функция сердца 493
- •Потребление кислорода я питательных веществ
- •Кровоснабжение миокарда
- •Глава 19. Функция сердца 495
- •Глава 19. Функция сердца 497 Сердечная недостаточность
- •19.7. Литература
- •Глава 20. Функции сосудистой системы. Э. Вицлеб
- •Глава 20. Функции сосудистой системы 499
- •20.1. Основы гемодинамики
- •Физические основы гемодинамики
- •Глава 20. Функции сосудистой системы 501
- •Типы течений жидкости
- •Взаимосвязь между объемной скоростью тока жидкости и гидродинамическим сопротивлением
- •Глава 20. Функции сосудистой системы 503
- •20.2. Свойства стенок и изменения диаметра сосудов Строение стенок сосудов
- •Трансмуральное давление, диаметр сосудов и напряжение в стенке
- •Взаимосвязь между давлением в сосудах и их объемом
- •Глава 20. Функции сосудистой системы 505
- •20.3. Функциональная организация сосудистой системы Функциональные группы сосудов
- •Глава 20. Функции сосудистой системы 507
- •Сопротивление в кровеносной системе
- •О бъем крови в кровеносной системе
- •Глава 20. Функции сосудистой системы 509
- •20.4. Артериальный отдел большого круга кровообращения
- •Кровоток в артериях
- •Давление в артериальном русле
- •Глава 20. Функции сосудистой системы 511
- •Влияние эластических свойств сосудов иа гемодинамику
- •Глава 20. Функции сосудистой системы 513
- •Исследование пульса
- •Глава 20. Функции сосудистой системы 515
- •20.5. Венозный отдел большого круга кровообращения Давление и скорость кровотока в венозном русле
- •Глава 20. Функции сосудистой системы 517
- •Центральное венозное давление и венозный возврат
- •Механизмы, способствующие венозному возврату
- •Глава 20. Функции сосудистой системы 519
- •20.6. Микроциркуляция Терминальное (микроциркуляторное) сосудистое русло
- •Глава 20. Функции сосудистой системы 521
- •Глава 20. Функции сосудистой системы 523
- •20.7. Лимфатическая система
- •Глава 20. Функции сосудистой системы 525
- •20.8. Регуляция регионального (локального) кровообращения Основные особенности регуляции регионального кровообращения
- •Местные регуляторные механизмы
- •Глава 20. Функции сосудистой системы 527
- •Нервная регуляция
- •Глава 20. Функции сосудистой системы 529
- •Влияние химических и гормональных факторов
- •Глава 20. Функции сосудистой системы 531
- •20.9. Регуляция системной гемодинамики Основные принципы регуляции системного кровообращения
- •Барорецепторные рефлексы
- •Глава 20. Функции сосудистой системы 533
- •Глава 20. Функции сосудистой системы 535
- •Рефлексы с рецепторов растяжения сердца
- •Рефлексы с артериальных хеморецепторов
- •Реакция на ишемию цнс
- •Влияние адреналина и норадреналина на сердечно-сосудистую систему
- •Глава 20. Функции сосудистой системы 537
- •Промежуточные (по времени) регуляторные механизмы
- •Релаксация напряжения в сосудистой стенке.
- •Регуляторные механизмы длительного действия
- •Глава 20. Функции сосудистой системы 539
- •Глава 20. Функции сосудистой системы 541
- •Центральная регуляция кровообращения
- •Глава 20. Функции сосудистой системы 543
- •20.10. Легочное кровообращение Гемодинамические особенности легочного кровообращения
- •Глава 20. Функции сосудистой системы 545
- •Функциональные особенности
- •Регуляция легочного кровообращения
- •20.11. Кровообращение при различных физиологических и патологических состояниях Артериальное давление у человека
- •Глава 20. Функции сосудистой системы 547
- •Глава 20. Функции сосудистой системы 549
- •Влияние положения тела на гемодинамику
- •Глава 20. Функции сосудистой системы 551
- •Физическая нагрузка
- •Температурный стресс
- •Кровопотеря
- •Глава 20. Функции сосудистой системы 553
- •Сердечно-сосудистый шок
- •Глава 20. Функции сосудистой системы 555
- •20.12. Кровообращение в отдельных органах и его регуляция Коронарное кровообращение
- •Мозговое кровообращение
- •Кровообращение в печеночных и портальных сосудах
- •Глава 20. Функции сосудистой системы 557
- •Почечное кровообращение
- •Кровообращение в скелетных мышцах
- •Кожное кровообращение
- •Глава 20. Функции сосудистой системы 559
- •Кровообращение в матке и у плода
- •20.13. Измерение давления, кровотока и объема крови в сердечно-сосудистой системе Измерение давления
- •Глава 20. Функции сосудистой системы 561
- •Измерение кровотока
- •Глава 20. Функции сосудистой системы 563
- •Измерение объема крови
- •Глава 20. Функции сосудистой системы 565
- •20.14. Литература
- •Часть VI дыхание Глава 21. Легочное дыхание. Г. Тевс
- •21.1. Дыхательные движения Дыхательные экскурсии грудной клетки
- •Глава 21. Легочное дыхание 569
- •Функции воздухоносных путей
- •Функции альвеол
- •Глава 21. Легочное дыхание 571
- •21.2. Легочная вентиляция Легочные объемы и емкости
- •Глава 21. Легочное дыхание 573
- •Измерение легочных объемов
- •Анатомическое и функциональное мертвое пространство
- •Глава 21. Легочное дыхание 575
- •Искусственное дыхание
- •Глава 21. Легочное дыхание 577
- •21.3. Механика дыхания
- •Упругие (эластические) сопротивления
- •Статические кривые объем-давление
- •Глава 21. Легочное дыхание 579
- •Неэластическое сопротивление
- •Глава 21. Легочное дыхание 581
- •Соотношение между давлением и объемом в ходе дыхательного цикла
- •Глава 21. Легочное дыхание 583
- •Дыхательные пробы
- •Определение типа нарушения вентиляции
- •Глава 21. Легочное дыхание 585
- •21.4. Газообмен Содержание газов в альвеолах
- •Глава 21. Легочное дыхание 587
- •Парциальные давления дыхательных газов
- •Глава 21. Легочное дыхание 589
- •Диффузия дыхательных газов
- •Глава 21. Легочное дыхание 591
- •21.5. Легочная перфузия и оксигенация крови в легких Легочная перфузия
- •Глава 21. Легочное дыхание 593
- •21.6. Центральный генез дыхательного ритма и регуляция дыхания
- •Центральный ритмогенез
- •Глава 21. Легочное дыхание 595
- •Глава 21. Легочное дыхание 597
- •Влияние химических факторов
- •Глава 21. Легочное дыхание 599
- •Влияние других факторов на дыхание
- •Глава 21. Легочное дыхание 601
- •Глава 21. Легочное дыхание 603
- •21.7. Литература
- •Глава 22. Транспорт газов кровью и кислотно-щелочное равновесие. Г. Тевс
- •22.1. Структура и свойства гемоглобина Строение молекулы гемоглобина
- •Поглощение света гемоглобином
- •Глава 22. Транспорт газов крови 607
- •Содержание гемоглобина в крови; среднее содержание гемоглобина в эритроците
- •Глава 22. Транспорт газов крови 609
- •22.2. Перенос кислорода кровью Физическая растворимость газов
- •Связывание кислорода гемоглобином
- •Глава 22. Транспорт газов крови 611
- •Факторы, влияющие на кривую диссоциации оксигемоглобина
- •Глава 22. Транспорт газов крови 613
- •Связывание гемоглобина с оксидом углерода
- •22.3. Перенос со2 кровью Формы транспорта со2
- •Глава 22. Транспорт газов крови 615
- •Сатурационные кривые co2 1)
- •22.4. Кислотно-щелочное равновесие крови pH крови
- •Глава 22. Транспорт газов крови 617
- •Буферные свойства крови
- •Глава 22. Транспорт газов крови 619
- •Механизмы регуляции pH
- •Глава 22. Транспорт газов крови 621
- •Глава 22. Транспорт газов крови 623
- •Оценка кислотно-щелочного равновесия
- •22.5. Литература
- •Глава 22. Транспорт газов крови 625
- •Глава 23. Тканевое дыхание. Й. Гроте
- •23.1. Тканевой метаболизм и потребности тканей в кислороде Обмен веществ и преобразование энергии в клетках.
- •Биологическое окисление в митохондриях
- •Глава 23. Тканевое дыхание 627
- •Потребность тканей в кислороде
- •Глава 23. Тканевое дыхание 629
- •23.2. Снабжение тканей кислородом Запасы кислорода в тканях
- •Поступление кислорода к тканям и его утилизация
- •Глава 23. Тканевое дыхание 631
- •Обмен дыхательных газов в тканях
- •Напряжение (парциальное давление) о2 в тканях
- •Глава 23. Тканевое дыхание 633
- •Глава 23. Тканевое дыхание 635
- •Распределение парциального давления о2 в работающих скелетных мышцах
- •23.3 Регуляция снабжения тканей кислородом и кислородное голодание Механизмы, обеспечивающие соответствие поступления кислорода потребности в нем
- •Глава 23. Тканевое дыхание 637
- •Причины недостаточного снабжения тканей кислородом
- •Кислородотерапия; кислородное отравление
- •Глава 23. Тканевое дыхание 639
- •Обратимые и необратимые нарушения при острой тканевой аноксни
- •23.4. Литература
- •Глава 23. Тканевое дыхание 641
- •Оглавление
- •Электронное оглавление
- •Электронное содержание
- •Глава 17. Эндокринология. В. Вутке 82
- •Часть V. Кровь и система кровообращения 126
- •Глава 18 функции крови. X. Вайс, в. Елькманн 126
- •Глава 19. Функция сердца. Г. Антони 188
- •Глава 20. Функции сосудистой системы. Э. Вицлеб 248
- •Часть VI дыхание 345
- •Глава 21. Легочное дыхание. Г. Тевс 345
- •Глава 22. Транспорт газов кровью и кислотно-щелочное равновесие. Г. Тевс 392
- •Глава 23. Тканевое дыхание. Й. Гроте 420
Глава 18. Функция крови 4ш
|
 передвигаться
в одном направлении (к аноду), но с
различной
скоростью (рис. 18.4).
передвигаться
в одном направлении (к аноду), но с
различной
скоростью (рис. 18.4).
Для того чтобы не только разделить белки, но также определить их молекулярные массы, применяют метод ультрацентрифугирования. На ультрацентрифуге Сведберга можно получить ускорение от 100000 до 750000 g. При данном ускорении скорость оседания молекул зависит от их удельной массы и формы (рис. 18.3) и плотности среды. Особенно хорошо белковые компоненты в какой-либо смеси можно разделить методом центрифугирования в градиенте плотности, так как при этом каждый из компонентов занимает в пробирке определенный уровень.
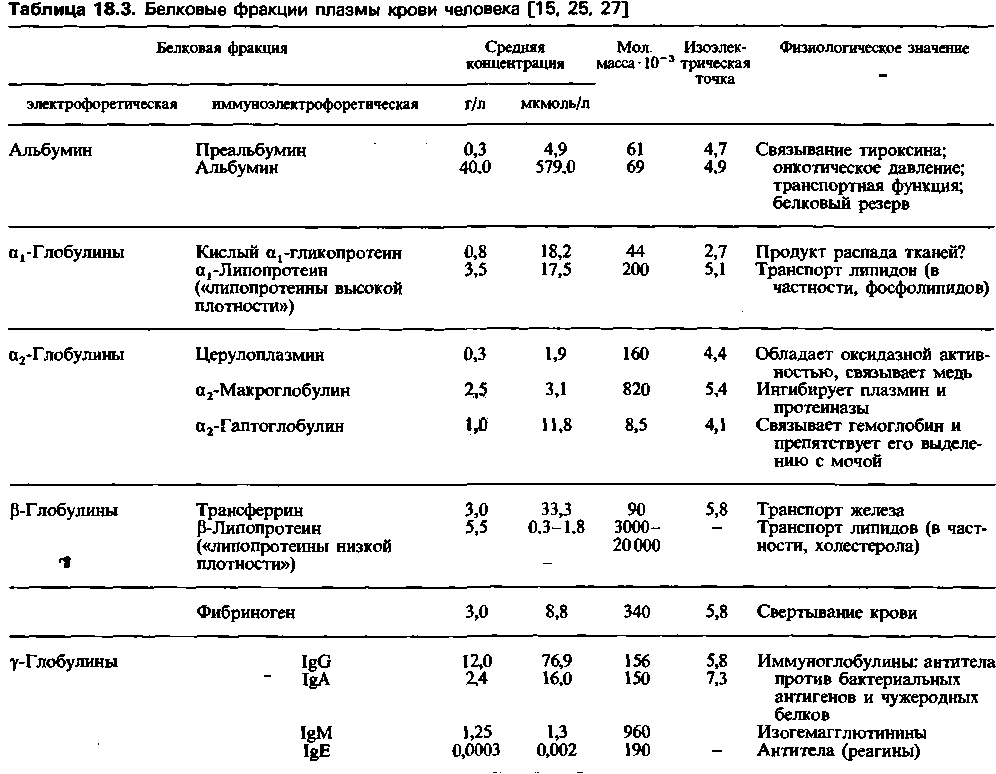
Еще более тонким способом разделения белков служит электрофорез в сочетании с иммунопреципитацией (иммуноэлектрофорез). При этом исследовании злектрофоретически разделенные белковые фракции диффундируют в геле по направлению к капле внесенной в него сыворотки. Когда белковый антиген достигает сыворотки, происходит осаждение антител-в геле появляется беловатая полоса мутности. При помощи этого метода было показано, что электрофоретически однородные белковые фракции могут состоять из нескольких белков, различающихся по иммунологическим свойствам (табл. 18.3).
Свойства и функции отдельных белковых фракций. Поскольку чаще всего для разделения белков используют электрофорез, в дальнейшем будут обсуждаться лишь белковые фракции, выделяемые этим методом. На рис. 18.3 схематично показаны относительные размеры и форма основных белков плазмы.
Альбумин плазмы. Около 60% общего белка плазмы приходится на долю альбумина, содержание которого составляет 35-45 г/л. Молекулярная масса альбумина-одного из самых низкомолекулярных белков плазмы-равна 69000. Поскольку концентрация альбумина высока, а размеры его молекулы невелики, этот белок на 80% определяет коллоидно-осмотическое давление плазмы. Общая площадь поверхности множества мелких молекул альбумина очень велика, поэтому они особенно хорошо подходят для выполнения функции переносчиков многих транспортируемых кровью веществ. К веществам, связываемым альбумином, относятся: били-
420 ЧАСТЬ V. КРОВЬ И СИСТЕМА КРОВООБРАЩЕНИЯ
рубин, уробилин, жирные кислоты, соли желчных кислот и некоторые экзогенные вещества - пенициллин, сульфамиды, ртуть и т. д. Одна молекула альбумина может одновременно связать 25-50 молекул билирубина (мол. масса 500). При многих патологических состояниях, в частности воспалительных заболеваниях и поражениях печени и почек, содержание альбумина снижается.
Глобулины плазмы. Глобулинами называют группу белков, которые могут быть разделены электрофоретически. В порядке убывания электрофоретической подвижности различают a1-, a2-, ßи γ-глобулины (рис. 18.4). Однако даже эти субфракции неоднородны по составу белков: каждую из них можно разделить при помощи других методов, например иммуноэлектрофореза (табл. 18.3).
Фракция а1-глобулинов состоит из многих коньюгированных белков, простетической группой которых являются углеводы-преимущественно гексозы и гексозамины. Эти белки называют гликопротеинами. Около 2/3 всего количества глюкозы плазмы присутствует в связанной форме в составе гликопротеинов. Эту связанную глюкозу невозможно определить с помощью клинических проб на сахар в плазме, лишенной белков; она может быть измерена лишь после отделения от белков методом кислотного гидролиза (в этом случае ее концентрация составляет 0,8-1,65 г/л). К субфракции гликопротеинов относится еще одна группа углеводсодержащих белков -протеогликаны (мукопротеины), в состав которых входят мукополисахариды.
К другим белкам, выделяющимся вместе с α1-глобулинами, относятся тироксин-связывающий белок, (витамин В12)-связывающий глобулин (транскобаламин), билирубин-связывающий глобулин и кортизол-связывающий глобулин {транскортин).
Фракция α2-глобулинов включает гаптоглобин, относящийся по химическому строению к протеогликанам, и медьсодержащий белок церулоплазмин. На каждую молекулу последнего приходится 8 атомов меди, обусловливающих оксидазную активность этого белка. Церулоплазмин связывает около 90% всей меди, содержащейся в плазме (однако с током крови к клеткам переносится медь, связанная не церулоплазмином, а альбумином).
К ß-глобулинам относятся основные белковые переносчики липидов и полисахаридов. Важное значение липопротеинов состоит в том, что они удерживают в растворе нерастворимые в воде жиры и липоиды и обеспечивают тем самым их перенос кровью. Около 75% всех жиров и липоидов плазмы входят в состав липопротеинов. Небольшие количества липопротеинов обнаруживаются и во фракции a1-глобулинов, однако большинство относится к ß-глобулинам; главный из них - это ß-липопротеин, молекула которого на 77% состоит из липи-
дов. Исследование липопротеинов плазмы методом ультрацентрифугирования и электрофореза (электрофоретическая подвижность липопротеинов обусловлена их белковым компонентом) - это важное средство диагностики различных форм гиперлипопротеинемий (см. учебники биохимии). Кроме липопротеинов к ß-глобулинам относится группа металлсодержащих белков, один из которых - трансферрин- служит переносчиком меди и, что особенно важно, железа. Каждая молекула трансферрина содержит два атома трехвалентного железа; именно трансферрин обеспечивает транспорт этого элемента кровью. В норме трансферрин плазмы лишь на 30% насыщен железом, и содержание железа составляет 1 мг Fe3+ на 1 л плазмы.
К неоднородной группе γ-глобулинов относятся белки с самой низкой электрофоретической подвижностью: их изоэлектрические точки ближе к нейтральному значению pH, чем у других белков плазмы (табл. 18.3). Данная группа включает большинство защитных и обезвреживающих веществ крови (иммуноглобулинов). Поскольку потребности в белках, выполняющих такие специфические функции, бывают различны, размеры и состав фракции γ-глобулинов существенно варьируют. Почти при всех заболеваниях, особенно воспалительных, содержание γ-глобулинов в плазме повышается. При этом общее количество белков плазмы обычно остается приблизительно тем же, так как повышение содержания γ-глобулинов сопровождается примерно равным уменьшением фракции альбумина; в результате так называемый альбумин-глобулиновый коэффициент снижается. К γ-глобулинам относятся также агглютинины крови, называемые анти-А и анти-В.
Фибриноген выявляется в виде узкой отдельной полосы, расположенной между полосами β- и γ-глобулинов. Этот белок представляет собой растворимый предшественник фибрина; последний превращается в нерастворимую форму, обеспечивая образование сгустка крови (с. 432). Молекула фибриногена имеет удлиненную форму (соотношение длина/ширина равно 17:1). Высокая вязкость растворов фибриногена обусловлена тенденцией его молекул образовывать агрегаты в виде «ниток бус».
Характерные изменения фракции фибриногена обнаруживаются лишь при некоторых редких заболеваниях, поэтому электрофоретически выявляемые сдвиги в содержании этого белка не имеют большого диагностического значения. Кроме того, при электрофорезе на бумаге подвижность удлиненной молекулы фибриногена в большей степени зависит от свойств бумаги, чем подвижность других белков плазмы. Из этих соображений при электрофорезе белков крови на бумаге, применяемом в клиниках, обычно используют не плазму, а сыворотку, в результате чего на типичной электрофореграмме полоса фибриногена отсутствует (рис. 18.4).