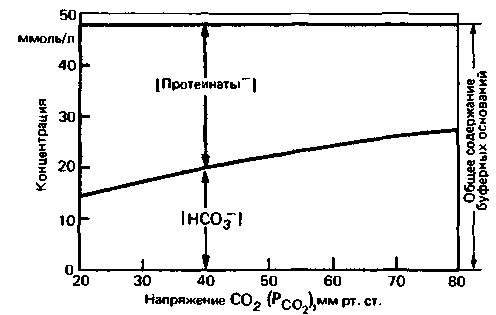- •Часть IV. Процессы нервной и гуморальной регуляции Глава 15. Общие принципы регуляции. М. Циммерман
- •15.1. Основные элементы цепей управления в биологии и технике Отличия рефлексов от систем управления
- •Структура системы управления
- •Глава 15. Общие принципы регуляции 335
- •Рефлекс растяжения — система для регуляции длины мышц
- •15.2. Динамическое и статическое поведение цепей управления Реакция на ступенчатое воздействие
- •Глава 15. Общие принципы регуляции 337
- •Работа следящей системы
- •Глава 15. Общие принципы регуляции 339
- •Работа системы управления в стационарном режиме
- •15.3. Особые свойства систем управления
- •Глава 15. Общие принципы регуляции 341
- •Сопряжение систем управления
- •15.4. Литература
- •Глава 16 вегетативная нервная система. В. Ениг
- •16.1. Периферический отдел вегетативной нервной системы Анатомическое подразделение вегетативной нервной системы
- •Глава 16. Вегетативная нервная система 345
- •Влияние симпатических и парасимпатических волокон на эффекторные органы
- •Глава 16. Вегетативная нервная система 347
- •Нейрогуморальная передача в периферическом отделе вегетативной нервной системы
- •Глава 16. Вегетативная нервная система 349
- •Мозговое вещество надпочечников. Общее действие адреналина и норадреналина
- •Глава 16. Вегетативная нервная система 351
- •Синаптическая организация периферического отдела вегетативной нервной системы
- •Глава 16. Вегетативная нервная система 353
- •Энтеральная нервная система
- •Глава 16. Вегетативная нервная система 355
- •Тонус вегетативных нервов в покое
- •Глава 16. Вегетативная нервная система 357
- •Спинальные вегетативные рефлексы
- •Глава 16. Вегетативная нервная система 359
- •Регуляция вегетативных функций на уровне ствола головного мозга
- •Глава 16. Вегетативная нервная система 361
- •16.3. Мочеиспускание и дефекация Нервная регуляция опорожнения мочевого пузыря
- •Глава 16. Вегетативная нервная система 363
- •Нервная регуляция опорожнения кишечника
- •Глава 16. Вегетативная нервная система 365
- •16.4. Половые рефлексы
- •Половые рефлексы у мужчин
- •Глава 16. Вегетативная нервная система 367
- •Половые рефлексы у женщин
- •Изменение других органов во время полового цикла
- •Глава 16. Вегетативная нервная система 369
- •16.5. Функции гипоталамуса
- •Функциональная анатомия гипоталамуса
- •Гипоталамо-гипофизарная система
- •Глава 16. Вегетативная нервная система 371
- •Гипоталамус и сердечно-сосудистая система
- •Глава 16. Вегетативная нервная система 373
- •Гипоталамус и поведение
- •16.6. Лимбическая система и поведение
- •Глава 16. Вегетативная нервная система 375
- •Элементы лимбической системы
- •Глава 16 вегетативная нервная система 377
- •Функции лимбической системы
- •Лимбическая система и эмоции
- •Глава 16. Вегетативная нервная система 379
- •Моноаминергические системы и поведение
- •Глава 16. Вегетативная нервная система 381
- •16.7. Литература
- •Глава 16. Вегетативная нервная система 383
- •Глава 17. Эндокринология. В. Вутке
- •17.1. Общая эндокринология Гормоны как носители информации
- •Глава 17. Эндокринология 385
- •Синтез и распад гормонов
- •Новые аспекты эндокринологии
- •Глава 17. Эндокринология 387
- •Методы изучения
- •Эндокринные цепи регуляции
- •Глава 17. Эндокринология 389
- •17.2. Система задней доли гипофиза Функциональная организация
- •Антидиуретический гормон
- •Глава 17. Эндокринология 391
- •Окситоцин
- •17.3. Система передней доли гипофиза
- •Гормоны аденогипофиза
- •Глава 17. Эндокринология 393
- •Регуляция секреции аденогипофиза
- •Гормон роста
- •Глава 17. Эндокринология 395
- •Пролактин
- •Глава 17. Эндокринология 397
- •17.4. Система щитовидной железы Образование и секреция тиреоидных гормонов
- •Глава 17. Эндокринология ш-
- •Функции тиреоидных гормонов
- •Патофизиологические аспекты
- •17.5. Система коры надпочечников
- •Глюкокортикоиды
- •Клетки, секретирующие проопиомеланокортин.
- •Глава 17. Эндокринология 401
- •Глава 17. Эндокринология 403
- •Андрогены надпочечников
- •Минералокортикоиды
- •Краткая характеристика стероидных гормонов
- •Глава 17. Эндокринология 405
- •17.6. Гормоны поджелудочной железы
- •Инсулин
- •Глава 17. Эндокринология 407
- •Глюкагон
- •Соматостатин
- •Регуляция уровня глюкозы
- •Глава 17. Эндокринология 409
- •Патофизиологические аспекты
- •17.7. Гомеостаз баланса кальция и фосфата
- •Гормональная регуляция
- •Патофизиология гомеостаза кальция
- •Глава 17. Эндокринология 411
- •17.8. Гормоны мозгового слоя надпочечников Катехоламины
- •17.9. Дополнительные эндокринные системы
- •17.10. Литература
- •Глава 17. Эндокринология 413
- •Часть V. Кровь и система кровообращения Глава 18 функции крови. X. Вайс, в. Елькманн
- •18.1. Основные положения
- •Функции крови
- •Объем крови
- •Гематокрит
- •Глава 18. Функция крови 415
- •18.2. Плазма крови
- •Электролиты плазмы
- •Глава 18. Функция крови 417
- •Б елки плазмы
- •Глава 18. Функция крови 4ш
- •Глава 18. Функция крови 421
- •18.3. Эритроциты Число, форма и размеры
- •Глава 18. Функция крови 423
- •Образование, продолжительность жизни и разрушение эритроцитов
- •Метаболизм и свойства мембран эритроцитов
- •Глава 18. Функция крови 425
- •Особые физико-химические свойства эритроцитов
- •18.4. Лейкоциты Общие свойства и образование лейкоцитов
- •Глава 18. Функция крови 427
- •Гранулоциты
- •Глава 18. Функция крови 429
- •Моноциты
- •Лимфоциты
- •Число лейкоцитов: методы подсчета и патологические сдвиги
- •18.5. Тромбоциты
- •Глава 18. Функция крови 431
- •18.6. Остановка кровотечения и свертывание крови Гемостаз
- •Глава 18. Функция крови 433
- •Свертывание крови и факторы свертывания
- •Глава 18. Функция крови 437
- •Фибринолиз
- •Глава 18. Функция крови 439
- •18.7. Защитная функция крови Классификация защитных механизмов
- •Специфические защитные механизмы
- •Глава 18. Функция крови 441
- •Глава 18. Функция крови 443
- •Глава 18. Функция крови 445
- •Неспецифические гуморальные защитные механизмы
- •Глава 18. Функция крови 447
- •Неспецифические клеточные защитные механизмы
- •Важнейшие этапы иммунного ответа
- •Глава 18. Функция крови 449
- •18.8. Группы крови человека
- •Система аво
- •Глава 18. Функция крови 451
- •Система Rh
- •Переливание крови
- •18.9. Литература
- •Глава 18. Функция крови 453
- •Глава 19. Функция сердца. Г. Антони
- •19.1. Строение и общая физиология сердца
- •Глава 19. Функция сердца 455
- •19.2. Основные механизмы возбуждения и электромеханического сопряжения в сердце
- •Возникновение и распространение возбуждения
- •Глава 19. Функция сердца 457
- •Характеристики процесса возбуждения на клеточном уровне
- •Глава 19. Функция сердца 459
- •Глава 19. Функция сердца 461
- •Связь между возбуждением и сокращением (электромеханическое сопряжение)
- •Вегетативная иннервация сердца; основные механизмы действия медиаторов вегетативной нервной системы
- •Глава 19. Функция сердца 463
- •464 Часть V. Кровь и система кровообращения
- •Глава 19. Функция сердца 465
- •19.3. Электрокардиография
- •Глава 19. Функция сердца 467
- •Происхождение экг
- •Глава 19. Функция сердца 469
- •Глава 19. Функция сердца 471
- •Отведения экг
- •Отведения от конечностей
- •Глава 19. Функция сердца 473
- •Использование экг в диагностике
- •Некоторые патологические типы экг
- •Глава 19. Функция сердца 475
- •Глава 19. Функция сердца 477
- •19.4. Механическая работа сердца
- •Функция клапанов сердца
- •Глава 19. Функция сердца 479
- •Сердечный цикл
- •Период нзоволюметрнческого расслабления.
- •Глава 19. Функция сердца 481
- •Функциональная анатомия и геометрия сокращения желудочков
- •Глава 19. Функция сердца 483
- •Инвазивные методы исследования сердца: внутрисердечные измерения
- •Глава 19. Функция сердца 485
- •19.5. Приспособление сердечной деятельности к различным нагрузкам
- •Причины изменений максимумов давления и объема.
- •Глава 19. Функция сердца 487
- •Саморегуляторные реакции сердца на кратковременные нагрузки объемом и давлением
- •Глава 19. Функция сердца 489
- •Динамика иннервируемого сердца in situ
- •Глава 19. Функция сердца 491
- •Приспособление сердца к длительной физической нагрузке
- •19.6. Энергетика сокращения сердца
- •Мощность и работа сердца
- •Глава 19. Функция сердца 493
- •Потребление кислорода я питательных веществ
- •Кровоснабжение миокарда
- •Глава 19. Функция сердца 495
- •Глава 19. Функция сердца 497 Сердечная недостаточность
- •19.7. Литература
- •Глава 20. Функции сосудистой системы. Э. Вицлеб
- •Глава 20. Функции сосудистой системы 499
- •20.1. Основы гемодинамики
- •Физические основы гемодинамики
- •Глава 20. Функции сосудистой системы 501
- •Типы течений жидкости
- •Взаимосвязь между объемной скоростью тока жидкости и гидродинамическим сопротивлением
- •Глава 20. Функции сосудистой системы 503
- •20.2. Свойства стенок и изменения диаметра сосудов Строение стенок сосудов
- •Трансмуральное давление, диаметр сосудов и напряжение в стенке
- •Взаимосвязь между давлением в сосудах и их объемом
- •Глава 20. Функции сосудистой системы 505
- •20.3. Функциональная организация сосудистой системы Функциональные группы сосудов
- •Глава 20. Функции сосудистой системы 507
- •Сопротивление в кровеносной системе
- •О бъем крови в кровеносной системе
- •Глава 20. Функции сосудистой системы 509
- •20.4. Артериальный отдел большого круга кровообращения
- •Кровоток в артериях
- •Давление в артериальном русле
- •Глава 20. Функции сосудистой системы 511
- •Влияние эластических свойств сосудов иа гемодинамику
- •Глава 20. Функции сосудистой системы 513
- •Исследование пульса
- •Глава 20. Функции сосудистой системы 515
- •20.5. Венозный отдел большого круга кровообращения Давление и скорость кровотока в венозном русле
- •Глава 20. Функции сосудистой системы 517
- •Центральное венозное давление и венозный возврат
- •Механизмы, способствующие венозному возврату
- •Глава 20. Функции сосудистой системы 519
- •20.6. Микроциркуляция Терминальное (микроциркуляторное) сосудистое русло
- •Глава 20. Функции сосудистой системы 521
- •Глава 20. Функции сосудистой системы 523
- •20.7. Лимфатическая система
- •Глава 20. Функции сосудистой системы 525
- •20.8. Регуляция регионального (локального) кровообращения Основные особенности регуляции регионального кровообращения
- •Местные регуляторные механизмы
- •Глава 20. Функции сосудистой системы 527
- •Нервная регуляция
- •Глава 20. Функции сосудистой системы 529
- •Влияние химических и гормональных факторов
- •Глава 20. Функции сосудистой системы 531
- •20.9. Регуляция системной гемодинамики Основные принципы регуляции системного кровообращения
- •Барорецепторные рефлексы
- •Глава 20. Функции сосудистой системы 533
- •Глава 20. Функции сосудистой системы 535
- •Рефлексы с рецепторов растяжения сердца
- •Рефлексы с артериальных хеморецепторов
- •Реакция на ишемию цнс
- •Влияние адреналина и норадреналина на сердечно-сосудистую систему
- •Глава 20. Функции сосудистой системы 537
- •Промежуточные (по времени) регуляторные механизмы
- •Релаксация напряжения в сосудистой стенке.
- •Регуляторные механизмы длительного действия
- •Глава 20. Функции сосудистой системы 539
- •Глава 20. Функции сосудистой системы 541
- •Центральная регуляция кровообращения
- •Глава 20. Функции сосудистой системы 543
- •20.10. Легочное кровообращение Гемодинамические особенности легочного кровообращения
- •Глава 20. Функции сосудистой системы 545
- •Функциональные особенности
- •Регуляция легочного кровообращения
- •20.11. Кровообращение при различных физиологических и патологических состояниях Артериальное давление у человека
- •Глава 20. Функции сосудистой системы 547
- •Глава 20. Функции сосудистой системы 549
- •Влияние положения тела на гемодинамику
- •Глава 20. Функции сосудистой системы 551
- •Физическая нагрузка
- •Температурный стресс
- •Кровопотеря
- •Глава 20. Функции сосудистой системы 553
- •Сердечно-сосудистый шок
- •Глава 20. Функции сосудистой системы 555
- •20.12. Кровообращение в отдельных органах и его регуляция Коронарное кровообращение
- •Мозговое кровообращение
- •Кровообращение в печеночных и портальных сосудах
- •Глава 20. Функции сосудистой системы 557
- •Почечное кровообращение
- •Кровообращение в скелетных мышцах
- •Кожное кровообращение
- •Глава 20. Функции сосудистой системы 559
- •Кровообращение в матке и у плода
- •20.13. Измерение давления, кровотока и объема крови в сердечно-сосудистой системе Измерение давления
- •Глава 20. Функции сосудистой системы 561
- •Измерение кровотока
- •Глава 20. Функции сосудистой системы 563
- •Измерение объема крови
- •Глава 20. Функции сосудистой системы 565
- •20.14. Литература
- •Часть VI дыхание Глава 21. Легочное дыхание. Г. Тевс
- •21.1. Дыхательные движения Дыхательные экскурсии грудной клетки
- •Глава 21. Легочное дыхание 569
- •Функции воздухоносных путей
- •Функции альвеол
- •Глава 21. Легочное дыхание 571
- •21.2. Легочная вентиляция Легочные объемы и емкости
- •Глава 21. Легочное дыхание 573
- •Измерение легочных объемов
- •Анатомическое и функциональное мертвое пространство
- •Глава 21. Легочное дыхание 575
- •Искусственное дыхание
- •Глава 21. Легочное дыхание 577
- •21.3. Механика дыхания
- •Упругие (эластические) сопротивления
- •Статические кривые объем-давление
- •Глава 21. Легочное дыхание 579
- •Неэластическое сопротивление
- •Глава 21. Легочное дыхание 581
- •Соотношение между давлением и объемом в ходе дыхательного цикла
- •Глава 21. Легочное дыхание 583
- •Дыхательные пробы
- •Определение типа нарушения вентиляции
- •Глава 21. Легочное дыхание 585
- •21.4. Газообмен Содержание газов в альвеолах
- •Глава 21. Легочное дыхание 587
- •Парциальные давления дыхательных газов
- •Глава 21. Легочное дыхание 589
- •Диффузия дыхательных газов
- •Глава 21. Легочное дыхание 591
- •21.5. Легочная перфузия и оксигенация крови в легких Легочная перфузия
- •Глава 21. Легочное дыхание 593
- •21.6. Центральный генез дыхательного ритма и регуляция дыхания
- •Центральный ритмогенез
- •Глава 21. Легочное дыхание 595
- •Глава 21. Легочное дыхание 597
- •Влияние химических факторов
- •Глава 21. Легочное дыхание 599
- •Влияние других факторов на дыхание
- •Глава 21. Легочное дыхание 601
- •Глава 21. Легочное дыхание 603
- •21.7. Литература
- •Глава 22. Транспорт газов кровью и кислотно-щелочное равновесие. Г. Тевс
- •22.1. Структура и свойства гемоглобина Строение молекулы гемоглобина
- •Поглощение света гемоглобином
- •Глава 22. Транспорт газов крови 607
- •Содержание гемоглобина в крови; среднее содержание гемоглобина в эритроците
- •Глава 22. Транспорт газов крови 609
- •22.2. Перенос кислорода кровью Физическая растворимость газов
- •Связывание кислорода гемоглобином
- •Глава 22. Транспорт газов крови 611
- •Факторы, влияющие на кривую диссоциации оксигемоглобина
- •Глава 22. Транспорт газов крови 613
- •Связывание гемоглобина с оксидом углерода
- •22.3. Перенос со2 кровью Формы транспорта со2
- •Глава 22. Транспорт газов крови 615
- •Сатурационные кривые co2 1)
- •22.4. Кислотно-щелочное равновесие крови pH крови
- •Глава 22. Транспорт газов крови 617
- •Буферные свойства крови
- •Глава 22. Транспорт газов крови 619
- •Механизмы регуляции pH
- •Глава 22. Транспорт газов крови 621
- •Глава 22. Транспорт газов крови 623
- •Оценка кислотно-щелочного равновесия
- •22.5. Литература
- •Глава 22. Транспорт газов крови 625
- •Глава 23. Тканевое дыхание. Й. Гроте
- •23.1. Тканевой метаболизм и потребности тканей в кислороде Обмен веществ и преобразование энергии в клетках.
- •Биологическое окисление в митохондриях
- •Глава 23. Тканевое дыхание 627
- •Потребность тканей в кислороде
- •Глава 23. Тканевое дыхание 629
- •23.2. Снабжение тканей кислородом Запасы кислорода в тканях
- •Поступление кислорода к тканям и его утилизация
- •Глава 23. Тканевое дыхание 631
- •Обмен дыхательных газов в тканях
- •Напряжение (парциальное давление) о2 в тканях
- •Глава 23. Тканевое дыхание 633
- •Глава 23. Тканевое дыхание 635
- •Распределение парциального давления о2 в работающих скелетных мышцах
- •23.3 Регуляция снабжения тканей кислородом и кислородное голодание Механизмы, обеспечивающие соответствие поступления кислорода потребности в нем
- •Глава 23. Тканевое дыхание 637
- •Причины недостаточного снабжения тканей кислородом
- •Кислородотерапия; кислородное отравление
- •Глава 23. Тканевое дыхание 639
- •Обратимые и необратимые нарушения при острой тканевой аноксни
- •23.4. Литература
- •Глава 23. Тканевое дыхание 641
- •Оглавление
- •Электронное оглавление
- •Электронное содержание
- •Глава 17. Эндокринология. В. Вутке 82
- •Часть V. Кровь и система кровообращения 126
- •Глава 18 функции крови. X. Вайс, в. Елькманн 126
- •Глава 19. Функция сердца. Г. Антони 188
- •Глава 20. Функции сосудистой системы. Э. Вицлеб 248
- •Часть VI дыхание 345
- •Глава 21. Легочное дыхание. Г. Тевс 345
- •Глава 22. Транспорт газов кровью и кислотно-щелочное равновесие. Г. Тевс 392
- •Глава 23. Тканевое дыхание. Й. Гроте 420
Глава 22. Транспорт газов крови 619
ви обусловлены способностью аминокислот ионизироваться. Концевые карбокси- и аминогруппы белковых цепей играют в этом отношении незначительную роль, так как таких групп мало и их рК' существенно отличаются от pH крови. Значительно больший вклад в создание буферной емкости белковой системы вносят боковые группы, способные ионизироваться, и особенно имидазольное кольцо гистидина. К буферным белкам относятся как белки плазмы (в частности, альбумин), так и содержащийся в эритроцитах гемоглобин. На долю последнего приходится большая часть буферной емкости белковой системы, что связано как со значительной концентрацией гемоглобина, так и с относительно высоким содержанием в нем гистидина.
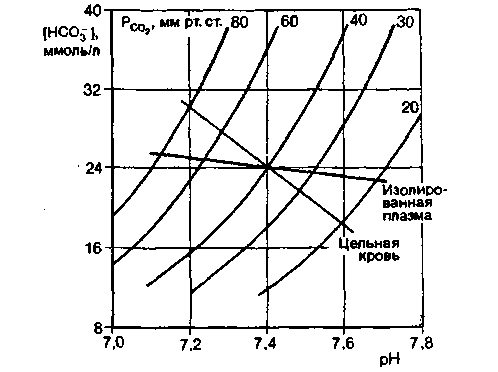
Особенно наглядно роль гемоглобина в создании буферной емкости крови можно показать, если сравнить сдвиги pH в ллазме и цельной крови, вызываемые одинаковыми изменениями напряжения СО2. Результаты такого сравнения удобно представить в виде графика зависимости pH от [HCO3− ], на который нанесены кривые для постоянного напряжения СО2, рассчитанные в соответствии с уравнением Гендерсона-Гассельбальха [уравнение (19)]. Измерив при разных значениях напряжения СО2 pH и содержание HCO3− в плазме и в цельной крови, где происходит обмен ионов между плазмой и эритроцитами, строят так называемые равновесные кривые СО2 для изолированной плазмы и цельной крови (рис. 22.12). Чем круче наклон кривой для цельной крови, тем больший вклад вносит в буферную емкость крови гемоглобин, и чем больше угол наклона кривой буферной емкости, тем меньше изменения pH при данном увеличении или уменьшении напряжения СО2 .
|
Рис. 22.12. Равновесные кривые СО2 для изолированной плазмы и цельной крови. По оси ординат -содержание в плазме бикарбоната, по оси абсцисс pH. Приведены также кривые для постоянного напряжения СО2. Поскольку в цельной крови между плазмой и эритроцитами происходит обмен ионами, буферная емкость плазмы добавляется к буферной емкости гемоглобина и наклон соответствующей равновесной кривой становится круче |
|
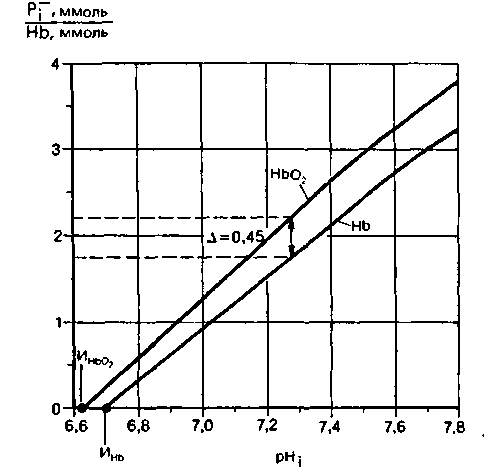
Рис. 22.13. Буферные кривые для недиффундирующих буферных систем эритроцита на основе гемоглобина (при незначительном участии АТР и 2,3-ДФГ) (по [19] с изменениями). По оси ординат-отношение содержания недиффундирующих буферных анионов Pi к содержанию гемоглобина; по оси абсцисс-pH внутри эритроцита. ИHbO2 и ИHb изоэлектрические точки. Благодаря тому что буферная кривая для Hb смещена вправо относительно буферной кривой для НbО2. при полной деэоксигенации гемоглобина 1 ммоль Hb может дополнительно связывать 0,45 ммоль Н+ без изменения ρΗ внутри эритроцита |
Гемоглобин играет также важную роль в буферной емкости крови благодаря изменению его кислотных свойств при оксигенации и дезоксигенации. Эта зависимость выражена на рис. 22.13, где приведены буферные кривые (кривые титрования) для недиффундирующих буферных систем эритроцита на основе гемоглобина в оксигенированном и дезоксигенированном состояниях. Видно, что в физиологическом диапазоне pH оксигемоглобин является более сильной кислотой, чем дезоксигемоглобин. Такая разница обусловлена главным образом влиянием кислорода, связанного с железом, на связывание Н + соседними имидазольными группами гистидина. Благодаря этому влиянию гемоглобин, освобождая в тканях кислород, приобретает большую способность к связыванию ионов Η+, образующихся при одновременном поглощении СО2. При поглощении кислорода кровью в легких происходят обратные процессы. Таким образом, обмен О2 усиливает буферный эффект гемоглобина.
Буферные основания. Буферные свойства крови обусловлены суммарным эффектом всех анионных
620 ЧАСТЬ VI. ДЫХАНИЕ
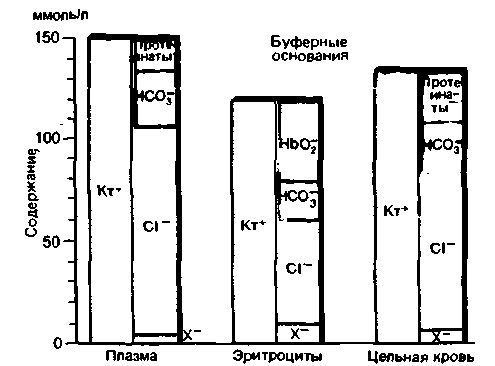
групп слабых кислот; важнейшими из них являются бикарбонат и анионные группы белков («протеинаты»). Все эти анионы, обладающие буферными эффектами, называют буферными основаниями (по международной номенклатуре-buffer bases, BB) [10].
На рис. 22.14 приведены концентрации различных ионов в плазме, эритроцитах и цельной крови человека (для артериальной крови). Высота столбиков пропорциональна концентрации ионов. Верхняя часть столбиков, относящихся к анионам, соответствует буферным основаниям (темно-красный цвет), а нижняя часть-всем анионам сильных кислот (кроме Сl−), не обладающих буферными свойствами, таким как SO42− и органические анионы (обозначенные вместе Х~). Из рисунка видно, что в плазме основную часть буферных оснований составляют ионы НСО3− , а в эритроцитах-протеинаты. В цельной крови более чем 1/3 всех анионов обладают буферным действием.
Концентрация буферных оснований в артериальной крови составляет примерно 48 ммоль/л. Очень важно, что эта величина не изменяется при сдвигах напряжения СО2. Рассмотрим причины такого постоянства. Предположим, например, что напряжение СО2 возрастает. При этом образуются равные количества Н+ и HCO3−. Ионы Н+ почти полностью связываются протеинатами, переходящими при этом в недиссоциированную форму. В результате концентрация протеинатов снижается настолько, насколько увеличивается концентрация бикарбоната (рис. 22.15).
|
Рис. 22.14. Содержание ионов в плазме, эритроцитах и цельной крови. К буферным основаниям относятся анионы буферных систем (темно-красный столбик); фосфаты не изображены, так как их содержание очень низко. Х− - анионы всех сильных кислот, не обладающих буферными свойствами, за исключением Cl−; Kt+ -суммарная концентрация катионов |
|
Рис. 22.15. Зависимость концентраций протеинатов и бикарбоната от РСO2 . Суммарное содержание двух буферных оснований остается постоянным (в норме48 ммоль/л) |
Подобные концентрационные сдвиги в буферных системах не взаимоуравновешиваются полностью, так как некоторые протоны остаются в свободной форме, изменяя тем самым pH. Так, если PCO2 возрастает от 40 до 50 мм рт. ст., то pH внутри эритроцитов снижается на 0,06, а в плазме- на 0,1. Это означает, что концентрация ионов Н+ увеличивается примерно на 10−5 ммоль/л. Однако этот сдвиг очень мал и не влияет на характер графика, приведенного на рис. 22.15.
Поскольку суммарная концентрация буферных оснований крови не зависит от РCO2 , по ней можно судить о сдвигах кислотно-щелочного равновесия, вызванных увеличением или уменьшением содержания нелетучих кислот в крови. Отклонение концентрации буферных оснований от нормального уровня (48 ммоль/л) называется избытком оснований (по международной номенклатуре-base excess, BE). Таким образом, в норме BE по определению равен нулю. При патологическом увеличении содержания буферных оснований BE становится положительным, а при снижении - отрицательным. В последнем случае можно использовать термин «дефицит оснований», так как выражение «отрицательный избыток оснований» с семантической точки зрения бессмысленно.