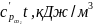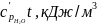- •Введение
- •Основные понятия и определения
- •Состав и теплота сгорания горючих веществ
- •Стехиометрические реакции горения. Определение теоретически необходимого количества воздуха.
- •Расчет состава продуктов горения
- •Термодинамические характеристики процессов горения
- •Характеристики пожаро-взрывоопасности веществ и материалов
- •Пример расчета
- •Задание на расчетно-графическую работу. Часть 2 «Расчет избыточного давления при взрывном горении газовоздушных смесей в помещении»
- •Пример расчета
- •Литература
- •Состав природных газов
Стехиометрические реакции горения. Определение теоретически необходимого количества воздуха.
Расчеты процессов горения проводят на основе стехиометрических реакций окисления горючих компонентов веществ. Рассмотрим определение теоретически необходимого расхода окислителя (кислорода, воздуха) на примере анализа горения твердых и жидких горючих веществ.
Стехиометрическая реакция горения углерода
C + O2 = CO2. (11)
12 кг C +32 кг O2 = 44 кг CO2.
1 кг C + 8/3 кг O2 = 11/3 кг CO2.
Стехиометрическая реакция горения водорода
2H2 + O2 = 2H2O. (12)
4 кг H2 + 32 кг O2 = 36 кг H2O.
1 кг H2 + 8 кг O2 = 9 кг H2O.
Стехиометрическая реакция горения серы
S + O2 = SO2. (13)
32 кг S + 32 кг O2 = 64 кг SO2.
1 кг S + 1 кг O2 = 2 кг SO2.
Потребное количество кислорода воздуха для полного выгорания компонентов с учетом стехиометрических коэффициентов уравнений (10)…(12), кг/кг (горючего вещества)
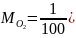 )
. (14)
)
. (14)
Теоретически необходимое количество воздуха для сжигания горючего вещества, м3/кг
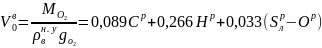 ,
(15)
,
(15)
где вн.у = 1,293 кг/м3 – плотность воздуха при нормальных физических условиях; gO2 = 0,232 - массовая доля кислорода в стандартном воздухе.
Аналогичным образом определяют теоретически необходимый расход воздуха для сжигания газообразных горючих веществ
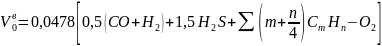 .
(16)
.
(16)
Действительный расход воздуха превышает теоретически необходимый вследствие не идеальности условий взаимодействия (перемешивания) горючего вещества и окислителя

где α – коэффициент избытка воздуха, зависящий от вида горючего вещества, способа сжигания, условий смесеобразования, конструкции топливосжигающего устройства и др. факторов. При развитии крупных лесных пожаров и возникновении мощных конвективных потоков воздуха со средними скоростями до 15…20 м/с α может существенно превышать единицу и зависеть от времени процесса горения.
Коэффициент избытка воздуха – экспериментальная характеристика. При сжигании твердых и жидких горючих веществ в топливосжигающих устройствах (топках, печах, камерах сгорания) α = 1,1…1,7; газообразных горючих веществ α = 1,05…1,15.
Расчет состава продуктов горения
Образующиеся при полном горении продукты, называемые обычно дымовыми газами, состоят из трехатомных газов RO2 = CO2 + SO2, двухатомных газов R2 = N2 + O2св (O2св - свободный (избыточный) кислород, не участвующий в горении) и водяного пара Н2O. Объёмный состав продуктов горения рассчитывается на основе стехиометрических уравнений (10)…(12).
Объём трехатомных газов, м3/кг
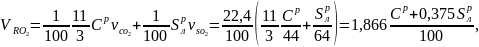 (18)
(18)
где
 -
удельные объёмы диоксидов углерода и
серы, м3/кг;
vµ0
=22,4 м3/кмоль
- объём 1 кмоля газа при нормальных
физических условиях;
-
удельные объёмы диоксидов углерода и
серы, м3/кг;
vµ0
=22,4 м3/кмоль
- объём 1 кмоля газа при нормальных
физических условиях;
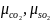 -
молярные массы CO2
и SO2,
кг/кмоль.
-
молярные массы CO2
и SO2,
кг/кмоль.
Объём
двухатомных газов, м3/кг
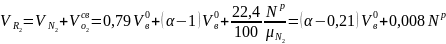 .(19)
.(19)
Объём водяных паров, м3/кг
 ,
(20)
,
(20)
где dв = 0,0161 кг/кг – влагосодержание стандартного воздуха.
Для газообразных горючих веществ расчетные формулы компонентов дымовых газов имеют вид, м3/м3:
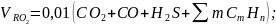 (21)
(21)
 (22)
(22)
 (23)
(23)
где dг, кг/кг – влагосодержание газа (принимается по справочным данным).
Общий объём дымовых газов, м3/кг (м3/м3)
 (24)
(24)
Энтальпия продуктов сгорания. Температура горения
Энтальпия дымовых газов рассчитывается по правилу аддитивности, кДж/кг (кДж/м3)
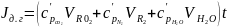 ,
(25)
,
(25)
где
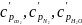 - удельные объёмные теплоемкости при
постоянном давлении CO2,
N2,
H2O,
зависящие от температуры. Табличные
данные по теплоемкостям газов можно
найти в специальной справочной литературе
[18], в приложениях к задачникам по
технической термодинамике и теплотехнике
[1, 2] и других изданиях.
- удельные объёмные теплоемкости при
постоянном давлении CO2,
N2,
H2O,
зависящие от температуры. Табличные
данные по теплоемкостям газов можно
найти в специальной справочной литературе
[18], в приложениях к задачникам по
технической термодинамике и теплотехнике
[1, 2] и других изданиях.
В
практических расчетах удобно пользоваться
справочными данными [2] (табл.1),
представляющими собой произведение
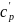 –
удельная энтальпия 1 м3
при нормальных физических условиях
различных газов и воздуха в широком
диапазоне изменения температуры.
–
удельная энтальпия 1 м3
при нормальных физических условиях
различных газов и воздуха в широком
диапазоне изменения температуры.
Табл.1. Удельная объёмная энтальпия газов и воздуха
t, °С |
|
|
|
|
1 |
2 |
3 |
4 |
5 |
100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700 1800 1900 2000 2100 2200 |
169 357 559 772 996 1222 1461 1704 1951 2202 2457 2717 2976 3240 3504 3767 4035 4303 4571 4843 5115 5387 |
130 260 392 527 664 804 946 1093 1243 1394 1545 1695 1850 2009 2164 2323 2482 2642 2805 2964 3127 3290 |
151 304 463 626 794 967 1147 1335 1524 1725 1926 2131 2344 2558 2779 3001 3227 3458 3688 3926 4161 4399 |
132 266 403 542 684 830 979 1130 1281 1436 1595 1754 1913 2076 2239 2403 2566 2729 2897 3064 3232 3399 |
Калориметрическая температура горения – температура продуктов полного сгорания горючего вещества, достигаемая при α = 1, температуре воздуха tв = 0°С, отсутствии потерь теплоты из зоны (очага) горения в окружающую среду
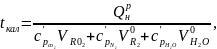 (26)
(26)
где
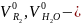 значения
объемов двухатомных газов и водяных
паров при α =1.
значения
объемов двухатомных газов и водяных
паров при α =1.
Теоретическое тепловыделение при горении топлива в топливосжигающем устройстве определяется следующим образом, кДж/кг:
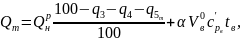 (27)
(27)
где
 –
потери теплоты (в %) от химического,
механического недожога горючего вещества
и в окружающую среду; температура
воздуха, подаваемого в зону горения.
При отсутствии подогрева воздуха tв
обычно принимают равной 30°С. Потери
теплоты зависят от вида топлива, способа
сжигания, конструкции топливосжигающего
устройства и особенностей его эксплуатации:
–
потери теплоты (в %) от химического,
механического недожога горючего вещества
и в окружающую среду; температура
воздуха, подаваемого в зону горения.
При отсутствии подогрева воздуха tв
обычно принимают равной 30°С. Потери
теплоты зависят от вида топлива, способа
сжигания, конструкции топливосжигающего
устройства и особенностей его эксплуатации:
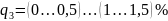 ;
;
 и более;
и более;
 Меньшие значения потерь соответствуют
сжиганию газа и мазута в камерных,
вихревых и циклонных топках.
Меньшие значения потерь соответствуют
сжиганию газа и мазута в камерных,
вихревых и циклонных топках.
Теоретическая температура горения,°С

Учитывая
зависимость удельной энтальпии газов
от текущей температуры, характерные
температуры горения находят методом
последовательных приближений. Более
удобный способ определения связан с
построением J
– t
диаграммы при выбранном значении
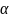 и трех – четырех значениях температуры
(рис.1). Откладывая величины
и трех – четырех значениях температуры
(рис.1). Откладывая величины
 или
или
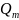 по оси ординат, по оси абсцисс находят
соответственно
по оси ординат, по оси абсцисс находят
соответственно
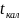 и
и
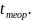
Температура пожара – опытная величина, заметно меньшая или При внутренних пожарах принимается равной средней температуре дымовых газов, при внешних – средневзвешенной температуре пламени. Измерение температур можно осуществить с помощью современных тепловизионных средств или оптических пирометров.