
- •1. Микро и макроскопические тела.
- •2. Тепловые явления и их значение.
- •3. Основные положения мкт.
- •4. Характеристики молекул.
- •5. Броуновское движение.
- •6. Идеальный газ.
- •7. Основное уравнение мкт.
- •8. Температура и ее изменения.
- •9. Абсолютная температура.
- •10. Измерение скоростей молекул.
- •11. Уравнение состояния идеального газа.
- •12. Газовые законы.
- •13. Насыщенный пар.
- •14. Кипение.
- •15. Поверхностное натяжение.
- •16. Смачивание, капиллярность.
- •17. Влажность воздуха.
- •18. Кристаллические тела.
- •19. Аморфные тела.
- •20. Механические свойства твердых тел.
- •21. Внутренняя энергия.
- •22. Работа газа
- •23. Количество теплоты.
- •24. Первый закон термодинамики.
- •25. Адиабатный процесс.
- •26. Необратимость процессов в природе.
- •27. Статистическое истолкование необратимости.
- •28. Принцип действия тепловых машин.
- •29. Кпд тепловых двигателей.
11. Уравнение состояния идеального газа.
Состояние газа характеризуется тремя
величинами – давлением, объемом,
температурой. P=nkT,
т.к.
![]() следовательно
следовательно
![]() (k*Na = R
= 8,31) Получаем уравнение состояния
идеального газа
(k*Na = R
= 8,31) Получаем уравнение состояния
идеального газа
![]() (Уравнение
Менделеева- Клапейрона)
(Уравнение
Менделеева- Клапейрона)![]() следовательно
следовательно
![]() (Уравнение Клапейрона)
(Уравнение Клапейрона)
12. Газовые законы.
Газовые законы – частный случай уравнения состояния идеального газа, один из параметров которой остается постоянным.
Процесс изменения состояния системы макроскопических тел при постоянной температуре – изотермический. Pv=const при T=const. Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно. ЗАКОН ЬОЙЛЯ-МАРИОТТА (справедлив обычно для любых газов, а также их смесей).
 ИЗОТЕРМА
ИЗОТЕРМА
Равновесие- состояние газа, при котором T и p во всех точках объема одинаковы.
Процесс изменения состояния
термодинамической системы при постоянном
давлении – изобарный. VT
=const при p=const.
Для газа данной массы при постоянном
давлении отношение объема к температуре
постоянно. ЗАКОН ГЕЙ-ЛЮССАКА.
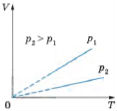 ИЗОБАРА
ИЗОБАРА
В области низких температур все изобары идеального газа сходятся в точке Т=0. Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем, если внешнее давление постоянно.
Процесс изменения состояния термодинамической системы при постоянном объеме –изохорный. PТ=const и V=const. Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. ЗАКОН ШАРЛЯ. P=const*T.
 ИЗОХОРА
ИЗОХОРА
13. Насыщенный пар.
(Духи, лужа про повышение температуры) Чем выше температура жидкости, тем большая кинетическая энергия молекул. В какой-то момент кинетическая энергия станет на столько большой, что они окажутся способными вылететь из жидкости. Процесс превращения жидкости в пар – испарение. При этом число молекул, вылетевших из жидкости, больше возвращающихся. Процесс превращения пара в жидкость – конденсация. (Молекулы возвращаются в жидкость). При испарении жидкость покидают более быстрые молекулы, средняя кинетическая энергия молекул жидкости уменьшается, поэтому понижается и температура. (Рука с бензином, холод). Одновременно с процессом испарения происходит и конденсация, оба процесса компенсируют друг друга (в закрытом сосуде). В результате образуется термодинамическое равновесие, при котором число молекул, покинувших жидкость, равно числу молекул, вернувшихся в жидкость. Пар в термодинамическом равновесии – насыщенный пар. Концентрация молекул насыщенного пара при постоянной температуре не зависит от его объема. Давление насыщенного пара не зависит от заминаемого им объема. Давление пара, при котором жидкость находится в равновесии со своим паром – давление насыщенного пара. Газовые законы не справедливы для насыщенного пара. Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры. Но по формуле p=nkt давление пара зависит и от концентрации молекул.
