- •Электродегидраторы
- •Циклоалканы
- •Химические свойства
- •Ароматические углеводороды (арены)
- •Химические свойства
- •Механизм реакции электрофильного замещения
- •На примере реакции хлорирования
- •Реакции замещения
- •Правила ориентации в реакциях электрофильного замещения в бензоле
- •Реакции присоединения и окисления
- •Реакции электрофильного замещения конденсированных аренов
- •Отдельные представители
- •Основные реакции сульфидов
- •Строение нафтеновых кислот
Элементный состав нефти:
С – 82,5-87
Н – 11,5-14,5
S – до 5,3
N – до 1,8 (10)
O – до 0,05-0,35 (0,7)
Спектральный анализ позволил расположить эти элементы в порядке уменьшения их содержания –
V |
Ванадий |
Al |
Алюминий |
As |
мышьяк |
K |
Калий |
Mn |
Марганец |
|
|
Ni |
Никель |
Pb |
Свинец |
|
|
Si |
Кремний |
Ag |
серебро |
|
|
Ca |
кальций |
Au |
Золото |
|
|
Fe, |
Железо |
Cu |
Медь |
|
|
Mg |
Магний |
U |
Уран |
|
|
Na |
натрий |
Sn |
олово |
|
|
Всего в нефтях найдено более 50 элементов
Фракционный состав нефти
Из-за сложности состава разделить нефть на индивидуальные углеводороды методом перегонки не удается
Разделение на фракции проводят на
установках первичной перегонки нефти
с применением процессов дистилляции и
ректификации (отбор фракций происходит
по Т![]() и Ткк
и Ткк
На промышленных установках обычно выделяют фракции:
н.к. – 1800С – бензиновую;
180 – 2400С – керосиновую;
240 – 3500С – газойлевую.
Фракции, отбираемые до 3500С, называются светлыми. Из них получают топлива. Температурные пределы отбора фракций могут отличаться от указанных в зависимости от качества и ассортимента получаемых топлив.
Остаток выше 3500С – мазут –разгоняется в вакууме, из него отбирают масляные фракции:
350 – 4200С – легкая масляная фракция (трансформаторный дистиллят);
420 – 4900С – средняя масляная фракция (машинный дистиллят);
450 – 5000С – тяжелая масляная фракция (цилиндровый дистиллят).
Выше 5000С (иногда 5500С) остается самый тяжелый остаток перегонки – гудрон. Мазут и получаемые из него фракции называются темными.
Химический состав определяется:
химическим составом исходных веществ
возрастом нефти (определяется по возрасту осадочных пород, к которым приурочена нефть
общая продолжительность осадконакопления 520 млн лет
Кайнозой 59 млн лет
Мезозой 188 млн лет
Палеозой 523 млн лет
свойствами веществ с которыми контактирует нефть(подземные воды, газ …)
давление и температура в пласте
температура возрастает на 10 за 30 м (геотермический градиент –это величина не постоянная зависит от климатического района, состава пород, наличие восходящих горячих вод) Для нефтяных месторождений градиент колеблется от 10 30 м
Возможно наличие и др. факторов так или иначе повлиявших на хим. состав нефтей
Групповой химический состав нефти
I.Углеводороды
1. Алканы (парафины)
2. Циклоалканы (нафтены)
3.Ароматические углеводороды
II. Гетероатомные соединения
1.Соединения, содержащие серу
2. Соединения, содержащие азот
3. Соединения, содержащие кислород
III.САВ
1.Смолы
2.Асфальтены
3.Карбены
4.Карбоиды

ПАРАФИНОВЫЕ УГЛЕВОДОРОДЫ НЕФТИ (АЛКАНЫ)
Парафиновые углеводороды широко представлены в нефтях, начиная с первого члена ряда -метана, СН4, который находится в нефтях в растворенном состоянии и заканчивая твердыми парафинами с числом углеродных атомов 55 и выше.
Номенклатура
Формула гомологического ряда СnH2n+2
Формулы и названия нормальных алканов
СH4 |
метан |
C11H24 |
ун(ген)декан |
C35H72 |
пентатриаконтан |
С2H6 |
этан |
C12H26 |
додекан |
C36H74 |
гексатриаконтан |
С3H8 |
пропан |
C16H34 |
гексадекан |
C37H76 |
гептатриаконтан |
С4H10 |
бутан |
C20H42 |
эйкозан |
C40H82 |
тетаконтан |
С5H12 |
пентан |
C21H44 |
ун(гне)эйкозан |
C50H102 |
пентаконтан |
С6H14 |
гексан |
C22H46 |
докозан |
C60H122 |
гексаконтан |
С7H16 |
гептан |
C23H48 |
трикозан |
C70 H142 |
гептаконтан |
С8H18 |
октан |
C30H62 |
триаконтан |
C80H162 |
октаконтан |
С9H20 |
нонан |
C31H64 |
унтриаконтан |
C90H182 |
нонаконтан |
С10H22 |
декан |
C34H70 |
тетратриаконтан |
C100H202 |
гектан |
Формулы и названия изоалканов
CH3 H2C-CH3 CH3 | | | H3C
– C –
CН – CH – CH2 –
CH – CH2 –
CH – CH3 | | CH3 H2C – CH – CH3 | CH3
|
|
|
|
Физические свойства
Первые члены ряда: метан, этан, пропан, бутан, изобутан, неопентан (2,2-диметилпропан) – газы.
Начиная с изопентана –жидкости.
Н-алканы имеют более высокие температуры кипения, чем разветвленные.
Например, температуры кипения бутанов и пентанов,0С:
-
Н-бутан
-0,6
Изобутан
-11,7
Н-пентан
+36,0
Изопентан (2-метилбутан)
+28,0
неопентан (2,2-диметилпропан)
+9,5
Н-алканы с числом углеродных атомов С5 –С15 – жидкости, начиная с С16 –С17 –твердые вещества.
Температуры плавления:
гекадекана C16H34 180С
гептадекана C17H36 220С.
Подобно температурам кипения, температуры плавления н-алканов выше, чем разветвленных.
С увеличением числа атомов углерода для нормальных алканов С6 –С24 Существует закономерность: при переходе от углеводорода с нечетным числом атомов углерода к углеводороду с четным числом атомов углерода увеличение температур плавления больше, чем при переходе от четного изомера к нечетному, т.е. изомеры с четным числом атомов углерода плавятся выше, чем с нечетным
Показатели преломления и плотности у алканов ниже, чем у циклических углеводородов (нафтенов и аренов), они увеличиваются с увеличением молекулярной массы.
Химические свойства алканов
Парафиновые углеводороды –насыщенные соединения, способные только к реакциям замещения, идущим по радикальному механизму. Это реакции хлорирования, нитрования, сульфирования, сульфоокисления.
Некоторые алканы нефти вступают в реакции комплексообразования.
Газообразные парафины дают комплексы с водой, они называются гидратами природных газов, или соединениями включения, клатратными соединениями. Молекулы газов включаются в полости, образующиеся в кристаллической решетке воды. Гидраты могут образовать газы, диаметр которых не превышает 0,69 нм (метан, этан, пропан, изобутан). Размер полостей может быть большим (0,59-0,69 нм) и малым (0,48-0,52 нм), в зависимости от этого состав гидратов переменный: М·nH2O, где М –молекула газа, n –от 5,67 до 17.Гидраты образуются под давлением при низких температурах (~00С), при повышении температуры и понижении давления – разлагаются. Так, температура разложения гидрата при атмосферном давлении составляет: для газового гидрата метана (-290С ), этана (-15,80С ), пропана 00С.
Гидраты природных газов представляют собой снегоподобные вещества и иногда вымерзают на внутренних стенках газопроводов, что может приводить к их забивке. Во избежание этого газ перед транспортом подвергают осушке.
Явление клатратообразования лежит в основе метода опреснения морской воды; используется для хранения газов в виде гидратов. Гидраты природных газов широко распространены в природе, очевидно, запасы природных газов в виде гидратов превышают запасы их в свободном состоянии.
МПа

Н-алканы, начиная с октана, дают соединения включения с мочевиной
 .
В этих соединениях молекулы мочевина
соединяются за счет водородных связей
и образуют спираль гексагонального
сечения с внутренним диаметром 0,49нм.
Диаметр поперечного сечения молекулы
н-алкана 0,38-0,42нм, такая молекула
помещается в этом канале в отличие от
молекул изоалканов .
.
В этих соединениях молекулы мочевина
соединяются за счет водородных связей
и образуют спираль гексагонального
сечения с внутренним диаметром 0,49нм.
Диаметр поперечного сечения молекулы
н-алкана 0,38-0,42нм, такая молекула
помещается в этом канале в отличие от
молекул изоалканов .
Однако если молекула изоалкана слаборазветвленная и имеет длинную нормальную цепь (>С10), она тоже дает комплекс с мочевиной. Комплексы с мочевиной образуются при комнатной температуре, разлагаются горячей водой.
Реакция комплексообразования с мочевиной (карбамидом) используется для депарафинизации нефтяных фракций.
Тиомочевина
![]() также
дает соединения включения с парафиновыми
углеводородами, но , поскольку размер
атома серы больше, чем кислорода, диаметр
гексагонального канала больше и
составляет 0,7нм. Тиомочевина дает
соединения включения с изопарафинами.
также
дает соединения включения с парафиновыми
углеводородами, но , поскольку размер
атома серы больше, чем кислорода, диаметр
гексагонального канала больше и
составляет 0,7нм. Тиомочевина дает
соединения включения с изопарафинами.
Молекулы углеводородов в соединениях включения мочевины и тиомочевины удерживаются с помощью сил Ван-дер-Ваальса. Возможно также наличие слабых водородных связей.
Окисление алканов.
Жидкие парафиновые углеводороды нефтепродуктов при хранении окисляются кислородом воздуха. Процесс идет по радикально цепному механизму с вырожденным разветвлением.
Зарождение цепи:
![]()
![]()
Продолжение цепи:
![]()
![]()
Разветвление цепи:
![]()
Обрыв цепи:

Первым молекулярным продуктом являются гидропероксиды ROOH. При их разложении получаются спирты, альдегиды кетоны.
При дальнейшем окислении гидропероксидов и альдегидов получаются кислоты:
R–CH–CH2–R1 + O2 → R–CH – CH–R1 → R–C=O + R1–C=O + H2O
| | | | |
OOH OOH OOH OH H
↓
R1COOH
Дальнейшие превращения кислот приводят к образованию оксикислот, лактонов, лактидов, сложных эфиров (в т.ч. высокомолекулярных эстолидов).Эти соединения дают осадки в топливах и маслах.
Процесс окисления нефтепродуктов ускоряется повышенной температурой, солнечным светом (ультрафиолетовыми лучами), ионами металлов переменной валентности, особенно медью.
При температуре 2000С парафиновые углеводороды реагируют с серой с выделением сероводорода:
СН4 + S → CS2 +2H2S
При наличии длинных цепей реакция идет через образование олефина:
СН3СН2СН2СН3 + S→ СН3СН=СНСН3 +Н2S
СН3СН=СНСН3 +Н2S → СН3СНСН2СН3
|
SH
При температурах 500-6000С возможно образование тиофена и его гомологов:
СН3СН2СН2 СН2СН3
![]() СН2 =СН– СН2–
СН2–СН3
СН2 =СН– СН= СН–СН3
СН2 =СН– СН2–
СН2–СН3
СН2 =СН– СН= СН–СН3
![]()
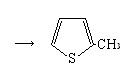
Такие реакции могут иметь место в высокотемпературных процессах переработки нефти.
ГАЗООБРАЗНЫЕ АЛКАНЫ
Газообразные парафиновые углеводороды входят в состав природных углеводородных газов, которые в зависимости от условий нахождения в природе делятся на три типа:
Природные газы - газы чисто газовых месторождений;
газы газоконденсатных месторождений;
попутные газы.
Природные газы состоят в основном из метана (Табл.3)
Таблица 3
Примерный состав природного газа (для нескольких месторождений)
-
Газы
Содержание, % об.
СH4
94,7-98,3
С2H6
0,2-1,8
С3H8
0,1-0,6
С4H10
0-0,4
С5+
0-0,5
Н2S
до 3,0 (иногда выше)
CO2
0,1-7,0(иногда выше)
N2
1,4-4,0
Редкие газы (гелий, аргон)
0,02-3,0
Природные газы относятся к тощим или
сухим газам. Тощими называются газы,
которые содержат менее 100-150
![]() углеводородов
С3 и выше. Такие углеводороды
называются газовым бензином.
углеводородов
С3 и выше. Такие углеводороды
называются газовым бензином.
Попутные газы в природе находятся в нефти в растворенном состоянии и выделяются при ее добыче вследствие снижения давления. Примерный состав попутных газов приводится в таблице .4
Таблица 4
Примерный состав попутного газа (для нескольких месторождений
-
Газы
Содержание, % об.
СH4
40,0-85,0
С2H6
4,0-21,0
С3H8
3,0-20,5
С4H10
1,0-8,8
С5+
2,0-5,0
Н2S
0-2,8
CO2
0,1-4,0(иногда выше)
N2
0,1-14,0
Попутные газы относятся к жирным или богатым газам. Из них получают газовый бензин.
Как видно из таблицы 5, состав попутного газа изменяется в широких пределах. Это связано с условиями нахождения нефти в пласте. Чем выше температура месторождения, тем больше в газе тяжелых углеводородов; в начале добычи, когда давление в пласте велико, газ содержит больше метана, с падением давления растет в газе содержание тяжелых компонентов.
Газоконденсаты образуются в природе вследствие обратной (ретроградной) растворимости углеводородов нефти в сжатом газе. При больших давлениях исчезает различие между жидкой и газовой фазой. Так при давлении 50МПа один литр пропана весит 1009г., при давлении 75МПа один литр этана весит 1017г.
Когда давление падает при выходе газоконденсата на поверхность в процессе добычи, этот раствор разделяется на жидкость (газоконденсат) и газ.
Газы газоконденсатных месторождений относятся к числу жирных, хотя содержат меньше тяжелых углеводородов, чем попутные газы (Табл.6).
Таблица 6
Примерный состав газов газоконденсатных месторождений
(для нескольких месторождений)
Газы |
Содержание, % об. |
СH4 |
88,0-98,0 |
С2H6 |
0,35-4,0 |
С3H8 |
0,6-2,9 |
С4H10 |
0,3-1,7 |
С5+ |
0,4-1,9 |
CO2 |
0-4,7 |
N2 + редкие газы |
0,5-1,4 |
Необычен состав газа Астраханского газоконденсатного месторождения (табл.7).
Таблица 7
Состав газов Астраханского газоконденсатного месторождения
-
Газы
Содержание, % об.
СH4
47,5-54,15
С2H6
1,92-5,54
С3H8
0,93-1,68
С4H10
0,44-0,93
С5+
0,35-1,57
CO2
17,9-21,55
N2
1,98
Н2S
20,7-22,5
Из газов газоконденсатных месторождений так же, как из попутных газов, выделяют газовый бензин.
Сухие газы (метан) служат топливом и сырьем для нефтехимического производства.
ЖИДКИЕ АЛКАНЫ
Жидкие алканы входят в состав бензиновых (С5-С11), керосиновых (С12-С16), дизельных фракций (С17-С22) фракций. Границы проведены по нормальным алканам ( Табл.8) и в значительной степени условны, т.к. изопарафиновые углеводороды имеют более низкие температуры кипения.
Таблица 8
Температуры кипения нормальных алканов
формула нормального алкана |
tкип,0С |
формула нормального алкана |
tкип,0С |
C10H22 |
174 |
C20H42 |
343 |
C11H24 |
196 |
C21H44 |
355 |
C12H26 |
216 |
C22H46 |
367 |
C15H32 |
268 |
C25H52 |
400 |
C16H34 |
280 |
C29H60 |
|
C17H36 |
303 |
C30H62 |
446 |
Содержание в нефтях и распределение по фракциям
Содержание алканов в нефтях может колебаться от 10-15% до 60-70%. Низким содержанием алканов отличаются тяжелые нефти нафтенового и нафтено-ароматического типа. Легкие парафиновые нефти могут содержать до 70% алканов. Среднее содержание алканов, характерное для парафино-нафтеновых и нафтено-парафиновых нефтей, составляет 20-50%.
Так как алканы в сравнении с нафтенами и аренами имеют более низкие температуры кипения, их содержание выше в низкокипящих фракциях, с повышением температуры кипения фракции они могут выклиниваться (для тяжелых нефтей), в парафинистых нефтях в высококипящих фракциях присутствуют твердые алканы (Табл. 9).
Таблица 9
Распределение парафиновых углеводородов по фракциям нефти (% на фракцию)
Фракция, 0С |
Грозненская беспарафинистая (нафтено-парафиновая нефть) |
Грозненская парафинистая нефть |
60-95 |
56 |
62 |
95-122 |
43 |
57 |
122-150 |
42 |
61 |
150-200 |
24 |
57 |
200-250 |
11 |
46 |
250-300 |
8 |
29 |
300-350 |
0 |
32 |
350-400 |
0 |
24 |
400-450 |
0 |
18 |
450-500 |
0 |
17 |
500-550 |
0 |
15 |
Парафиновые углеводороды бензиновых фракций
Для бензиновых фракций нефти в наибольшей степени, в сравнении с другими фракциями, изучен индивидуальный углеводородный состав. Это связано с тем, что в бензин входят углеводороды с небольшим числом углеродных атомов. Фракция н.к.-1800С содержит алканы С5-С10.
Парафиновые углеводороды имеют большое количество изомеров: С4H10 – 2, С5H12– 3, С6H14– 5, С7H16– 9, С8H18– 18, С9H20– 35, C12H26– 355, C18H38– 60523. Не все изомеры содержатся в одинаковых количествах, некоторые значительно преобладают. По распределению изомеров парафиновых углеводородов нефти типа А и Б (классификация Ал.А. Петрова) различаются. В бензинах нефтей типа А (парафинистых, сильнопревращенных) значительно содержание н-алканов, причем в нефтях А1 их содержание больше, чем в бензинах из нефтей А2. В нефтях типа А1 (сургутской, ромашкинской, грозненской парафиностой) содержание н-алканов составляет: н-гексана 52-71%; н-гептана 55,9-61%; н-октана 41-54,8%; н-нонанана 30,7-38,4%; н-декана 39,4-39,9% на сумму изомеров данного углеводорода. В нефти типа А2 (старогрозненской)содержание этих углеводородов составляет соответственно: : н-гексана 12%; н-гептана 9,5%; н-октана 4,3%; н-нонанана 5,2%; н-декана 2,0% на сумму изомеров данного углеводорода.
Среди разветвленных изомеров преобладают слаборазветвленные -2 и 3-метилпроизводные, изомеров с большим количеством заместителей содержатся значительно меньше.
Таблица 10.
Распределение изомеров октана в бензиновой фракции туймазинской нефти
Углеводород |
Содержание в бензине, % на фракцию |
н-октан |
7,2 |
2-метил гептан |
4,69 |
3-метил гептан |
1,71 |
4-метил гептан |
0,80 |
В бензине американской нефти Понка содержание нормальных, с одной, двумя, тремя боковыми цепями для углеводородов С6-С8 подчиняется соотношению: 100: 59 : 13 : 0,25. Среди диметилалканов преобладают углеводороды с симметричным расположением метильных групп или с метильными группам в положениях 2,6 (углеводороды изопреноидного типа). Так среди изомеров углеводородов С9 и С10 в значительном количестве содержатся2,6-диметилгептан 2,6-диметилоктан.
Заместители С2 встречаются реже. В некоторых нефтях среди изомеров октана найден этил гексан в количестве 1-5% от суммы всех октанов.
Для нефтей типа Б характерно почти полное отсутствие н-алканов, в бензинах содержатся разветвленные алканы, причем с большим количеством метильных групп.Для примера приводится ниже распределение октанов в двух нефтях нафтенового типа (Табл 11.
Таблица 11
Углеводород |
Содержание в Троицко-Анастасиевской нефти, % |
|
на бензины |
на сумму С8 |
|
Н-октан |
отс. |
отс. |
2-метил гептан |
отс. |
отс. |
3-метил гептан |
отс. |
отс. |
3-этил гексан |
2,35 |
32 |
2,2-диметил гексан |
0,88 |
12 |
2,3-диметил гексан |
1,67 |
23 |
2,5-диметил гексан |
2,08 |
28 |
2,2,3-триметил пентан |
0,35 |
5 |
Таблица 12
Углеводород |
Содержание в нефти месторождения Грязевая Сопка, % на сумму С8 |
Н-октан |
7 |
2-метил гептан |
37,7 |
диметил гексаны |
35 |
триметил пентаны |
20,3 |
Парафиновые углеводороды средних фракций нефти
Эти фракции изучены хуже, чем бензины, так углеводороды этих фракций содержат большее число углеродных атомов (С12- С25), соответственно больше изомеров, и идентификация индивидуальных углеводородов представляет трудную задачу, кроме н-алканов.
Наиболее изученной группой углеводородов, выделенной из фракции 180-3500С, является группа изопреноидных углеводородов. Для изопреноидных углеводородов характерно наличие метильных заместителей в положениях 2,6,10,14, т.е. через три углеродных атома; молекулы изопреноидов состоят из соединенных между собой углеводородных фрагментов, имеющих такое же строение углеродного скелета, как молекула изопрена:
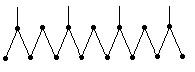
2,6,10,14-тетраметил пентадекан (пристан), температура кипения 2990С
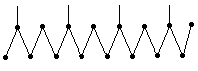
2,6,10,14-тетраметил гексадекан (фитан), температура кипения 3160С.
В нефтях было обнаружено более 20 углеводородов этого типа с числом углеродных атомов от С9 доС25 (Табл. 15).
Из данных таблицы 12 видно, что в наибольших количествах содержатся пристан и фитан.
Предполагается, что источником изопреноидных углеводородов является непредельный спирт фитол

3,7,11,15-тетраметилгексадецен-2-ол-1 (* -ассиметричные углеродные атомы).
Таблица 13
Содержание изопреноидных углеводородов в нефтях (на сумму изопреноидов)
Углеводород |
Месторождение |
||
Сургутское |
Ромашкинское |
Грозненское (парафинистая нефть) |
|
2,6-диметил гептан (С9) |
3,80 |
366 |
5,74 |
2,6-диметил октани(С10) |
3,26 |
3,14 |
6,44 |
2,6-диметил нонан (С11) |
6,78 |
5,75 |
5,74 |
3,7-диметил нонан (С11) |
3,26 |
1,30 |
1,19 |
2,6-диметил декан (С12) |
2,44 |
2,62 |
1,43 |
3,7-диметил декан (С12) |
3,80 |
1,04 |
0,71 |
2,6-диметил ундекан (С13) |
6,49 |
6,80 |
6020 |
2,6,10-триметил ундекан (С14) |
6,25 |
6,55 |
6,20 |
2,6-диметил додекан (С14) |
следы |
следы |
следы |
3,7- диметил додекан (С14) |
4,06 |
2,62 |
0,71 |
2,6,10-триметил додекан (фарнезан) (С15) |
7,58 |
10,40 |
7,40 |
2,6,10-триметил тридекан (С16) |
7,05 |
11,70 |
8,60 |
3,7,11-триметил тридекан (С16) |
1,90 |
1,83 |
1,43 |
2,6,10-триметил тетрадекан (С17) |
1,63 |
2,63 |
1,43 |
2,6,10-триметил пентадекан (С18) |
6,78 |
8,10 |
8,60 |
2,6,10,14-тетраметил пентадекан (пристан) (С19) |
9,48 |
9,40 |
19,40 |
2,6,10-триметил гексадекан (С19) |
следы |
следы |
Следы |
2,6,10,14-тетраметил гексадекан (фитан) (С20) |
13,25 |
12,0 |
11,70 |
2,6,10,14-тетраметил гептадекан (С21) |
3,52 |
4,45 |
2,86 |
2,6,10,14-тетраметил октадекан (С22) |
1,63 |
1,04 |
1,19 |
2,6,10,14-тетраметил нонадекан (С23) |
2,03 |
1,30 |
1,43 |
2,6,10,14,18-пентаметил нонадекан (С24) |
2,98 |
1,57 |
0,95 |
2,6,10,14-тетраметилэйкозан (С24) |
- |
- |
- |
2,6,10,14,18-пентаметилэйкозан (С25) |
2,03 |
2,35 |
0,95 |
Фитол входит в состав хлорофилла растений.
Изопреноидные углеводороды содержатся в большем количестве в парафинистых нефтях (типа А), нефти типа Б обычно не содержат изопренанов или содержат в очень небольших количествах. В нефтях типа А их содержание может достигать 3-4% на нефть (иногда выше), из них 20-30% приходится на фитан и пристан. В отличие от нефтей типа А в нафтеновой троицко-анастасиевской нефти в большем количестве содержатся изопреноиды с числом углеродных атомов С14-С15 (2,6,10-триметил ундекан, 2,6,10-триметил додекан, 2,6,10-триметил тридекан).
Наряду с углеводородами регулярного строения (пристан, фитан) обнаружены изопреноидные углеводороды нерегулярного строения, обычно с числом углеродных атомов больше двадцати (С20). Примером являются сквалан (2,6,10,15,19,23-гексаметилтетракозан и ликопан (2,6,10,14,19,23,27,31-октаметилдотриаконтан).
В нефтях были обнаружены также так называемые Т-образные изопренаны:
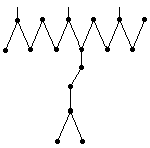
2,6,10-триметил-7-(3метилбутил)-додекан.
Для изопренанов характерна оптическая активность, т.к. в их молекулах имеются ассиметричные атомы углерода (в молекуле пристана – шестой и десятый атомы углерода основной цепи).
Что касается других парафиновых углеводородов средних фракций, то подтверждаются закономерности распределения изомеров, характерные для бензинов.
Ал.А.Петров исследовал сочетанием методов ГЖХ и масс-спектрометрии алканы средних и высококипящих фракций отечественных нефтей различных типов. Были определены моно-и диметилзамещенные алканы С11-С15. Содержание метилзамещенного изомера снижается по мере перемещения метильной группы из положения 2 к центру молекулы.
Для углеводородов С7-С22 ромашкинской нефти соотношение суммарного содержания 2-и 3-метилалканов и н-алкана варьирует от 0,6 до 0,23, имея тенденцию к постепенному уменьшению с возрастанием молекулярной массы алкана.
В сургутской нефти количественно определено диметилдеканов (%)
2,4-диметилдекан |
12 |
2,5-диметилдекан |
17 |
2,6-диметилдекан |
20,6 |
3,6-диметилдекан |
8,5 |
3,7-диметилдекан |
24,2 |
2,9-диметилдекан |
9,2 |
2,8-диметилдекан |
8,7 |
Обращает на себя внимание более высокое, в сравнении с другими изомерами, содержание изомеров изопреноидного строения (2,6-, 3,7-диметилдеканов). Общее содержание диметилдеканов составляет примерно половину суммарного количества изомерных метилундеканов и равно 0,25% на нефть.
В нафтеновых нефтях содержатся алканы с большим количеством заместителей. В нефти месторождения Нефтяные Камни были обнаружены 2,2,3,5-тетраметилгептан и 2,2-диметил-4-этилгептан (С11).
В таких нефтях могут совсем отсутствовать нормальные и слаборазветвленные алканы.
Влияние алканов на свойства нефтепродуктов
Жидкие парафиновые углеводороды входят в состав бензинов, реактивных и дизельных топлив. Будет рассматриваться влияние этих углеводородов на эксплуатационные свойства нефтепродуктов.
Бензины.
Основной показатель характеризующий процесс сгорания топлива в двигателе - октановое число. Высокими октановыми числами обладают разветвленные парафиновые углеводороды, низкими - нормального строения.
Это подтверждается данными таблицы 14
Таблица 14
Октановые числа алканов
Углеводороды |
ОЧИМ |
ОЧММ |
метан |
107,5 |
110,0 |
этан |
107,1 |
104,0 |
пропан |
105,7 |
100,0 |
н-бутан |
93,6 |
92,0 |
изобутан |
101,1 |
99,0 |
н-пентан |
61,7 |
61,0 |
2-метилбутан |
92,3 |
89,0 |
н- гексан |
24,8 |
25,0 |
н-гептан |
0 |
0 |
2-метил гексан |
42,4 |
45,0 |
3-метил гексан |
52,0 |
55,0 |
2,2-диметил пентан |
92,8 |
93,0 |
3,3-диметил пентан |
80,8 |
84,0 |
2,2,3-триметилбутан |
105,7 |
101,0 |
2,2-диметил гексан |
72,5 |
77,4 |
2,2,3-триметил пентан |
104,5 |
102,0 |
2,2,4-триметил пентан |
100,0 |
100,0 |
2,2,3,3-тетра метилбутан |
106,9 |
103,0 |
Следует отметить, что большими октановыми числами обладают газообразные парафиновые углеводороды (С1-С4) и разветвленные алканы с положением метильных групп 2,2.
Реактивные топлива
Одна из важнейших характеристик моторных топлив – теплота сгорания. Парафиновые углеводороды обладают высокой массовой теплотой сгорания, т.к. в них велико содержание водорода (в сравнении с другими классами углеводородов), формула ряда СnH2n+2. Один килограмм углерода при сгорании до СО2 выделяет 34,1МДж тепла, один килограмм водорода при сгорании до водяного пара -117,3 МДж. Теплота сгорания углерода и водорода в соединениях может отличаться от теплот сгорания этих элементов в свободном состоянии, но тем не менее топлива с высоким содержанием алканов имеют более высокую теплоту сгорания, чем топлива с большим содержанием ароматических углеводородов. С увеличением молекулярной массы алканов их теплота сгорания уменьшается.
Н-алканы с числом углеродных атомов больше 16 имеют высокие температуры плавления. Такие углеводороды при низких температурах образуют кристаллы, что ухудшает их прокачиваемость. Температура, при которой из топлива выпадают твердые углеводороды, называют температурой начала кристаллизации, или температурой помутнения. Температура помутнения характеризует фильтруемость топлива при низких температурах.
Дизельные топлива
Процесс сгорания дизельных топлив характеризуется цетановым числом.
Алканы нормального строения имеют самые высокие цетановые числа, т.к. они легко окисляются до легко распадающихся пероксидов. Разветвление цепи снижает цетановое число. Увеличение числа углеродных атомов в нормальной цепи приводит к увеличению цетанового числа.
Таблица 16.
Цетановые числа алканов
Углеводород |
Цетановое число |
|
С12 |
Додекан |
72,0 |
|
3-этилдекан |
46,5 |
|
4,5-диэтилоктан |
20,2 |
|
2,2,4,6,6-пентаметилгептан |
8,8 |
С13 |
2,5-диметилундекан |
58,0 |
|
5-бутилнонан |
53,5 |
|
4-пропилдекан |
39,5 |
С14 |
2,7-диметил-4,5-диэтилоктан |
39,5 |
С16 |
Гексадекан (цетан) |
100,0 |
|
7,8-диметилтетрадекан |
40,5 |
С17 |
7-бутилтридекан |
70,0 |
С18 |
Октадекан |
102,6 |
|
7,8-диэтилтетрадекан |
67,5 |
|
9-метилгептадекан |
66,0 |
|
8-пропилпентадекан |
48,2 |
|
5,6-дибутилдекан |
29,8 |
С20 |
9,10-диметилоктадекан |
59,5 |
С21 |
8-гексилпентадекан |
83,0 |
С22 |
2,9-диметил-5,6-диизоамилдекан |
48,2 |
С24 |
9-гептилгептадекан |
87,5 |
|
9,10-дипропилоктадекан |
47,3 |
Так как н-алканы имеют высокую температуру плавления и повышают температуру помутнения, а также ухудшают фильтруемость топлив, желательно иметь в составе дизельных топлив слаборазветвленные алканы.
ТВЕРДЫЕ АЛКАНЫ
Твердые алканы содержатся в нефтяных фракциях, кипящих выше 3000С. Температура кипения н-гептадекана 3030С, температура плавления 210С. Содержание твердых алканов в нефтях различно и достаточно хорошо коррелирует с их плотностью (Табл. 16).
По технологической классификации, нефти с содержанием парафина до 1,5% относят к малопарафинистым, 1,51-6,00% -к парафинистым, более 6% - к высокопарафинистым.
Таблица 17
Содержание парафина в нефтях
Месторождение, нефть |
Плотность
|
Содержание парафина,% |
Охотинская (Сахалин) |
0,929 |
0,03 |
Доссорская |
0,860 |
0,31 |
Грозненская беспарафинистая |
0,862 |
0,5 |
Сураханская масляная |
0,879 |
0,9 |
Оха (Сахалин) |
0,867 |
1,1 |
Ишимбай |
0,867 |
1,4 |
Раманы, парафинистая |
0,860 |
1,5 |
Ухта |
0,866 |
2,1 |
Грозненская слабопарафинистая |
0,835 |
2,3 |
Туймазинская |
0,852 |
3,3 |
Сураханская отборная |
0,853 |
4,0 |
Грозненская парафинистая |
0,843 |
9,0 |
Озек-суатская |
0,822 |
20,0 |
Твердые алканы нефти делятся на две группы: парафины и церезины. Эти две группы отличаются физическими и химическими свойствами, строением молекулы, нахождением в нефти.
Парафины выделяются из дистиллятных фракций нефти – керосино-газойлевых и масляных. При кристаллизации они образуют большие пластинки, легко отмывающиеся от масла и имеющие белый цвет. Плотность парафина в твердом состоянии лежит в пределах 0,865-0,940, в расплавленном и растворенном -0,777-0,790, поэтому парафинистые нефти имеют низкие плотности.
Парафины состоят из молекул с числом углеродных атомов С18-С35, молекулярной массой 300-500. Температура плавления очищенного парафина 50-550С . В химическом отношении они инертны, не взаимодействуют с серной и хлорсульфоновой кислотами, при нитровании дают преимущественно вторичные нитросоединения. Масс-спектральное исследование твердых парафинов, выделенных из масла с молекулярной массой 310-380, состояли на 90,6% из н-парафинов и на 9,4% - изостроения.
Таким образом парафин представляет собой смесь н-алканов с малоразветвленными алканами с длинными алкильными цепями.
Церезины выделяются из остаточных рафинатов (после деасфальтизации гудрона), а также из горючего минерального озокерита. Озокерит - пористая порода, пропитанная смемью твердых углеводородов и смол. Органическая часть озокерита отделяется от минеральной плавлением; церезин выделяется их органической части после удаления легкокипящих фракций и смол.
В состав церезинов входят углеводороды с числом углеродных атомов С36 – С55 и выше, молекулярной массой 500-700; температура плавления церезина 65-900С. Церезины в отличие от парафина, имеют мелкокристаллическую структуру. Они отличаются большой реакционной способностью: реагируют с серной, хлорсульфоновой, азотной кислотами. При реакции с азотной кислотой дают больше, чем парафины, третичных нитросоединений. Таким образом церезины представляют собой смесь нормальных алканов с алканами изостроения, причем заместители могут иметь алкановую, циклоалкановую (до трех колец в молекуле) или ареновую природу. Это подтверждается данными спектрального исследования церезинов туймазинской нефти (Табл.18)
Таблица 18.
Гупповой состав церезинов туймазинской нефти
Группа углеводородов |
Содержание, % на фракцию |
|
400-5000С |
300-4000С |
|
н-парафины |
10,3 |
50,0 |
изопарафины |
10,3 |
0 |
н-парафины с нафтеновыми кольцами |
22,0 |
47,1 |
изопарафины с нафтеновыми кольцами |
38,3 |
0 |
н-парафины с ароматическим кольцом |
14,7 |
2,9 |
изопарафины с ароматическим кольцом |
4,4 |
0 |
Соотношение между парафинами и церезинами зависит от типа нефти: церезинов больше в нафтеновых нефтях, парафинов – в парафинистых (общая закономерность).
Влияние на свойства нефтепродуктов
Н-алканы (или слаборазветвленные) с высокими температурами плавления повышают температуру застывания масел и топлив, температуру помутнения топлив, поэтому эти нефтепродукты подвергают депарафинизации или добавляют к ним депрессорные присадки.
Электродегидраторы
применяются для глубокого обезвоживания и обессоливания нефти.
Под воздействием электрического поля происходит упорядочение движения, а затем столкновение капель воды. Если расстояние между каплями незначительное, а размеры этих капель
относительно велики, то сила притяжения становится настолько
большой, что бронированные эмульгаторами оболочки этих
капель сдавливаются и разрушаются. В результате происходит
укрупнение и слияние капель воды и их осаждение.
Свойство капель воды в эмульсиях располагаться вдоль
силовых линий электрического поля и было использовано
для разрушения эмульсий типа В/Н в аппаратах, называемых
электродегидраторами.
Эффективность разрушения эмульсий в поле переменного
тока значительно выше, чем в поле постоянного тока. В поле переменного тока происходит циклическое изменение направления движения тока и напряженности поля, в результате чего капли воды изменяют направление своего движения синхронно основному полю и поэтому все время находятся в состоянии колебания.

Под воздействием сил переменного электрического поля форма капель постоянно меняется, в связи с чем капли воды испытывают непрерывную
деформацию, что способствует разрушению адсорбированных
на каплях воды оболочек и их слиянию.
В электродегидраторах используется переменный ток промышленной частоты (50 герц)
В электрическом поле электродегидраторов происходит не только разделение эмульсии на нефть и воду, но и отделение солей, содержащихся в этих водах. Последнее связано с проявлением гальванического процесса в электрическом поле напряженности электродегидраторов.
В целом электродегидраторы из-за наличия двойного
эффекта получили распространение как электрообезвоживаю-
щие и электрообессоливающие установки и имеют другое распространенное название ЭЛОУ.
Опыт работы показал, что наиболее эффективными и экономичными являются горизонтальные электродегидраторы.
Нагретая нефтяная эмульсия, содержащая деэмульгатор и
до 5—10% пресной воды, поступает через два распределителя
эмульсии 6, изготовленных из перфорированных труб, под слой отделившейся воды и поднимается вверх.
В корпус вмонтированы два электрода 1 в форме решетчатых прямоугольных рам, подвешенных через подвесные проходные
изоляторы параллельно друг другу и занимающих почти все горизонтальное сечение аппарата. Расстояние между электродами может изменяться от 20 до 40 см.
После перехода через границу раздела вода-нефть нефтяная эмульсия
попадает сначала в зону электрического поля низкой напряженности,
образующуюся между нижним электродом и поверхностью
отделившейся воды, а затем в зону высокой напряженности
между верхним и нижним электродами (Напряжение между электродами может составлять 11,33 и 44 кВ.). Под действием
электрического поля капли воды, содержащиеся в нефти, поляризуются,
взаимно притягиваются друг к другу, коалесцируют и
осаждаются. Обезвоженная и обессоленная нефть выводится
сверху аппарата через сборник нефти 2, а отделившаяся вода
— снизу.
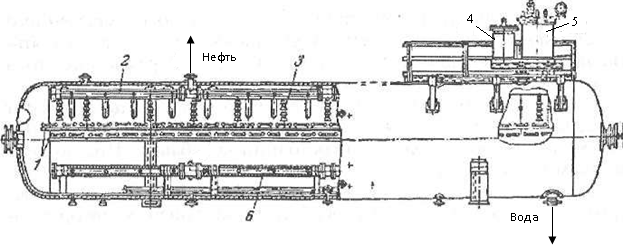
1 - электроды; 2 - сборник нефти; 3 - подвесные изоляторы; 4 – реактивная катушка; 5 - трансформатор; 6 - распределитель эмульсии;
Циклоалканы
Простейшими представителями являются моноциклические углеводороды, общая формула которых СnН2n. Циклоалканы в зависимости от числа атомов углерода в цикле подразделяют на малые циклы (С3 и С4), средние (С5 –С7) и большие циклы (С8 и больше). Структуру циклоалканов представляют в виде многоугольников, в которых атомы углерода и водорода обычно не изображают.
Изомерия и номенклатура. Структурная изомерия циклоалканов возможна по нескольким признакам: размеру цикла, размеру и числу заместителей в цикле, взаимному положению заместителей. Пропан не имеет изомеров, циклобутан имеет два изомера, циклопентан – пять, ниже представлены структурные изомеры состава С6Н12, в соответствии с признаками изомерии:
а) по размеру цикла:


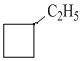
![]()
циклогексан метилцикло- этилциклобутан пропилцикло
пентан пропан
б) по размеру и числу заместителей:




1,2,3-триметил- 1-метил-2-этил- 1-метил-2-этил- изопропил-
циклопропан циклопропан циклопропан циклопропан
в) по взаимному расположению заместителей:


1,1-диметилбутан 1,2-диметилбутан 1,3-диметилбутан
Физические свойства. При обычных условиях только циклопропан и циклобутан являются газообразными веществами. Циклоалканы обычно имеют более высокую температуру кипения и плавления по сравнению с аналогичными соединениями алканов, например: циклопропан (tкип.=-126,9оС; tпл.=-33оС) и пропан (tкип.=-187,1оС; tпл.=-42,2оС).
Химические свойства
Реакционная способность циклоалканов в значительной степени зависит от устойчивости цикла. Реакции могут протекать по трем направлениям: замещения (SR); присоединения (AE или AR), которые сопровождаются раскрытием цикла; реакции изомеризации (сужение или расширение) циклов. Склонность к типу реакции определяется прочностью цикла: С3 – С4 склонны к реакциям присоединения, С5 – С6 склонны к реакциям замещения. Циклопентан и циклогексан по своим химическим свойствам наиболее близки с алканами. Они подвергаются радикальному галогенированию, нитрованию, сульфохлорированию, устойчивы к действию окислителей.
Гидрогалогенирование характерно только для циклопропана при действии галогеноводородов в водном растворе, реакция протекает с разрывом цикла и образованием 1-иодпропана:
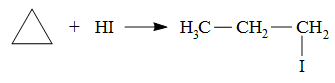
Галогенирование циклопропа и его гомологов может протекать как с разрывом цикла, так и с сохранением его по типу замещения. Бромирование на свету приводит к образованию 1,3-дибромпропана, как хлорирование при температуре больше 100оС. В тоже время при меньшей температуре реакция хлорирования протекает по типу замещения:

Циклоалканы состава С4 – С6 галогенируются по типу радикального замещения, например хлорирование по схеме:
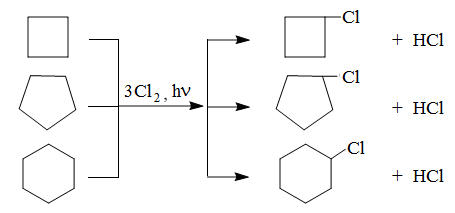
Гидрирование циклоалканов с увеличением размера цикла протекает в более жестких условиях, с использованием температуры и катализатора:
а)
|
в) |
б)
|
г) |
Изомеризация циклов характерна для гомологов и их производных, например, галогенопроизводных, спиртов, аминов. В зависимости от структуры субстрата во время реакции происходит изменение размера цикла в сторону увеличения (а, б) или уменьшения (в):
а)
![]()
метилциклопентан циклогексан
б)
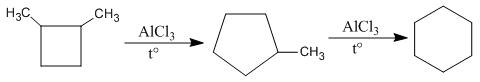
1,2-диметилцикло- метилцикло- циклогексан
бутан пентан
в)

циклогептан метилциклогексан
Окисление малых циклов С3 – С4 концентрированной азотной кислотой или кислородом (в присутствии катализатора) ведет к раскрытию цикла с образованием дикарбоновых кислот, при этом малые циклы устойчивы к действию раствора перманганата калия.

Лишь в жестких условиях циклопентан и циклогексан окисляются в соответствующие циклические спирты или кетоны (а), а если реакция идет с разрывом цикла - в дикарбоновые кислоты (б)
а)

б)

циклопентан пентандиовая кислота
Исторически неорганическая теория возникла раньше органической. До середины XIX в. нефть использовалась там, где имелись её выходы на поверхности – в Средиземноморье, в Калифорнии, Венесуэле и др. Ряд ученых того времени, например немецкий естествоиспытатель А.Гумбольдт, связал образование нефти и асфальта с вулканами. Во второй половине XIX в. химикам удалось в лабораторных условиях синтезировать ацетилен С2Н2, углеводороды метанового ряда. Знаменитый химик Д.И.Менделеев создал свою известную «карбидную» теорию происхождения нефти и выступил на заседании Русского химического общества в 1877 г., причем его гипотеза была обоснована на большом фактическом материале и сразу же завоевала популярность. Менделеев указал, что открытые к тому времени месторождения нефти сконцентрированы в окраинах горно-складчатых сооружений, линейно вытянуты, тяготеют к зонам крупных разломов. Через эти разломы вода проникает вглубь Земли, вступает в реакцию с углеродистыми металлами – с карбидами металлов, в результате чего возникает нефть, которая поднимается вверх, образует залежи: 2FeC+3H2O=Fe2O3+C2H6 Этот процесс, по Менделееву, происходил не только в прошлые геологические периоды, но и происходит сейчас. Карбидную теорию критиковал академик И.М.Губкин. Для карбидного варианта происхождения нефти необходимо существование проводящих путей воды к жидким карбидам и обратно, из очагов генерации к местам скопления нефти и газа. Губкин показал невозможность существования подобных трещин – проводящих путей от ядра Земли к верхней твердой оболочке. Препятствием является, по Губкину, пластичный базальтовый пояс, затрудняющий как проникновение воды вниз, так и обратный восходящий поток нефти и газа. Кроме того, в качестве аргумента против карбидной теории Губкин ссылался на тот факт, что образованные неорганическим путем нефти оптически неактивны, в то время как природная нефть оптически активна, способна вращать плоскость поляризации светового луча. Кроме карбидной известна космическая теория происхождения нефти. Автор этой теории русский геолог Н.А.Соколов выдвинул её в 1892 г. Он считал, что углеводороды изначально существовали в первозданном веществе Земли или образовались на ранних высокотемпературных стадиях её образования. С охлаждением Земли нефть поглощалась и растворялась в жидкой расплавленной магме. Впоследствии, когда возникла земная кора, из магмы выделились углеводороды, которые по трещинам в земной коре поднимались в верхние части, сгущались и там образовали скопления. Н.А.Соколов в качестве аргумента своей теории принял факты обнаружения углеводородов в метеоритах. Академик Губкин, критикуя эту теорию, написал, что она основана лишь на теоретических рассуждениях и не подтверждается геологическими наблюдениями. Губкин считал, что в природе в очень небольших количествах можно допускать образование нефти неорганическим путем, но это не имеет практического значения, основная масса скоплений нефти имеет все-таки органическое происхождение.
Органическая гипотеза



Ароматические углеводороды (арены)
Ароматические углеводороды - это большая группа карбоциклических соединений, объединяемых понятием «ароматичности», которое определяет общие признаки в строении и химических свойствах. Общая формула аренов CnH2n-6.
Первые открытые ароматические соединения относятся к производным бензола, которые были выделены из бальзамов и смол, имели приятный запах, отсюда название ароматические соединения.
Ароматические углеводороды классифицируют по числу бензольных колец в молекуле, различают моноциклические и полициклические углеводороды.
К моноциклическим аренам относятся бензол и его гомологи (1,2). У полициклических аренов бензольные кольца могут быть конденсированными (3, 4) или изолированными (5, 6, 7), которые в свою очередь могут быть непосредственно связанными друг с другом или разделены атомами углерода:
1) 2) 3) 4)



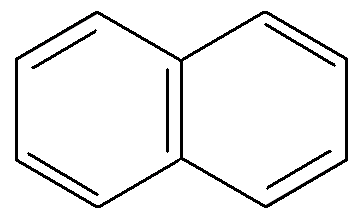
бензол толуол нафталин антрацен
5) 6) 7)
дифенил дифенилметан трифенилметан
Изомерия строения монозамещенных аренов обусловлена строением углеродного скелета заместителя, а для ди - и полизамещенных – взаимным расположением заместителей. Ниже приведены структурные изомеры ароматических углеводородов состава C8H10:
1) 2) 3) 4)




этилбензол 1,2-диметил- 1,3-диметил- 1,4-диметил-
бензол бензол бензол
Физические свойства. Бензол и его ближайшие гомологи являются жидкостями, температура кипения которых возрастает с увеличением числа атомов углерода в заместителе. Например, температура кипения бензола равна 80оС, толуола - 111оС, этилбензола - 136оС, пропилбензола - 159оС.
Полициклические арены – твердые вещества. Арены нерастворимы в воде и хорошо растворимы в неполярных органических растворителях.
Бензол и многие конденсированные арены являются токсичными соединениями, а некоторые из них проявляют концерагенное действие.
Химические свойства
Арены относятся к высоко ненасыщенным соединениям, однако для них не характерны реакции электрофильного присоединения, свойственные алкенам и алкинам: бензол не обесцвечивает бромную воду и раствор перманганата калия.
Устойчивость аренов объясняется наличием высокой энергии сопряжения ароматической системы бензольного кольца. Для молекулы бензола энергия сопряжения равна 150 кДж/моль, нафталина - 250 кДж/моль, арнтрацена - 359 кДж/моль. В указанном ряду энергия сопряжения уменьшается (в расчете на одно бензольное кольцо), следовательно, уменьшается устойчивость молекулы и повышается его химическая активность.
Арены предпочтительно вступают в реакции электрофильного замещения, в результате которого сохраняется ароматичность бензольного кольца. Реакции галогенирования, нитрования, сульфирования возможны со всеми аренами при действии различных электрофильных реагентов. Реакции алкилирования, ацилирования осуществляются только с соединениями, не содержащими электроноакцепторные заместители в кольце.
Механизм реакции электрофильного замещения
Механизм реакций электрофильного замещения в ароматическом кольце включает ряд последовательных стадий.
1) Образование электрофильной частицы. Как правило электрофильные частицы образуются в процессе реакции в присутствии катализаторов и соответствующих условиях. Например, при нагревании азотной кислоты образуется нитроний катион (а), серной кислоты - сульфоний катион (б), а при галогенировании (например, хлорирование) образуется электрофильная частица, которая может быть представлена катионом галогена или в виде комплекса галогена с катализатором (в):
а) б)
![]()
![]()
нитроний сульфоний
катион катион
в)
![]() или
или
![]()
хлор комплекс
катион с катализатором
2) Образование - комплекса происходит при атаке - электронного облака кольца электрофильной частицей, например, комплексом хлора с катализатором, при этом образуется - комплекс по донорно – акцепторному типу.
3) Образование - комплекса происходит при возникновении ковалентной связи между электрофилом и атомом углерода бензольного кольца, за счет пары электронов - системы кольца, что сопровождается переходом атома углерода из sp2 - в sp3 - гибридизованное состояние.
4) Образование конечного продукта осуществляется за счет отщепления протона водорода от - комплекса с помощью основания.
Схема механизма реакции электрофильного замещения в бензоле
На примере реакции хлорирования
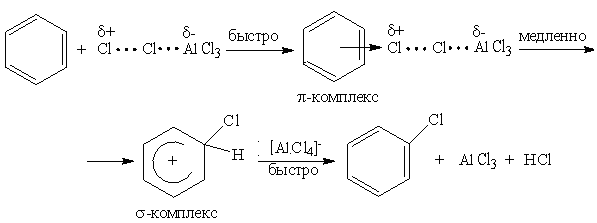
Электрофильное замещение в бензоле приводит к образованию единственного продукта монозамещения, что определяется равномерным распределением электронной плотности в сопряженной системе кольца и, соответственно, равновероятной атакой электрофилом любого из шести атомов углерода бензола.
Реакции замещения
Электрофильное замещение в бензоле представлено схемами синтеза гомологов бензола (а) и его производных (б).
а) Синтез гомологов бензола:
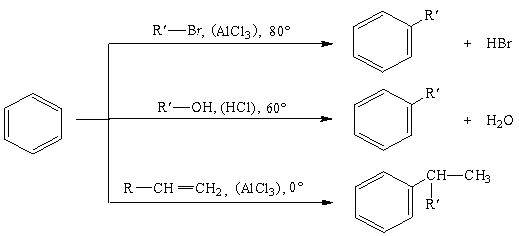
б) Синтез производных бензола:

Галогенирование. Бензол в обычных условиях не взаимодействует с хлором и бромом. Реакция протекает только в присутствии катализаторов, которыми чаще всего являются галогениды алюминия, железа (кислоты Льюиса).
Нитрование. Бензол нитруется смесью концентрированных азотной и серной кислот (нитрующая смесь) при нагревании до 60оС с образованием нитробензола.
Сульфирование. При взаимодействии бензола с концентрированной кислотой или олеумом (смесь концентрированной серной кислоты и серного ангидрида – SO3) образуется бензолсульфоновая кислота.
Ацилирование представляет собой один из методов синтеза ароматических кетонов. В качестве ацилирующих реагентов используют хлорангидриды кислот (RCOCI) или ангидриды кислот ( RCO-O-OCR). Реакцию проводят в неполярном растворителе в присутствии хлорида алюминия.
Алкилирование является одним из способов получения гомологов бензола. В качестве алкилирующих реагентов можно использовать галогеналканы, спирты и алкены в присутствии галогенидов металлов (алюминия, железа, олова и др.).
Правила ориентации в реакциях электрофильного замещения в бензоле
В производных бензола и его гомологов заместители нарушают равномерное распределение электронной плотности и тем самым, определенным образом, влияют на реакционную способность и направление атаки в бензольном кольце. Ориентирующее влияние заместителей, обусловленое суммарным действием их электронных эффектов (см. 2.5; табл.2.2), рассмотрим на примере фенола и нитробензола.
В молекуле фенола заместитель (- ОН) проявляет отрицательнй индуктивный (-I) и положительный мезомерный (+M) электронные эффекты, последний является преобладающим в суммарном электронодонорном (ЭД) действии (а). Электронный эффект ЭД заместителя приводит к перераспределению электронной плотности в кольце повышая ее в орто - и пара – положениях, в которых облегчается атака электрофильными реагентами.
В молекуле нитробензола заместитель (-NO2) проявляет отрицательнй индуктивный (-I) и отрицательный мезомерный (+M) электронные эффекты, что проявляется в суммарном электроноакцепторном (ЭА) действии (б). Электронный эффект ЭА заместителя приводит к перераспределению электронной плотности в кольце, понижая ее в орто - и пара – положениях, в которых затрудняется атака электрофильными реагентами.
а) б)


фенол нитробензол
Правила замещения:
1) Электронодонорные заместители (ЭД) повышают электронную плотность кольца и тем самым увеличивают скорость реакции электрофильного замещения. К заместителям, проявляющим ЭД характер, относятся группы: - NH2, - OH, - OR, - R, которые ориентируют электрофильное замещение в орто - и пара - положение. Исключение составляют галогены, которые направляют электрофильную частицу предпочтительно в пара - положение.
2) Электроноакцепторные заместители (ЭА) понижают электронную плотность кольца и тем самым уменьшают скорость реакции электрофильного замещения. К заместителям, проявляющим ЭА характер, относятся группы: - NO2, - COOH, - SO3H, >C=O и др., которые ориентируют электрофильное замещение в мета - положение, затрудняя его.
Правила замещения можно продемонстрировать на реакции нитрования бензола (а) и его производных, содержащих электронодонорный (б) и электроноакцепторный (в) заместители. В представленных схемах реакций отражены условия и выход продукта реакции (в %), отражающий активность ориентирующего влияния заместителя в орто-, мета- или пара – положения. Как правило, в уравнении реакции указывают то направление электрофильной атаки, которое более предпочтительно в данных условиях реакции:
а) нитрование бензола:

нитробензол
б) нитрование фенола:

орто-нитро- пара-нитро- пикриновая
фенол фенол кислота
в) нитрование нитробензола:

мета-динитробензол
Электронные эффекты заместителей позволяют расположить приведенные соединения в следующий ряд по снижению активности в реакции нитрования: фенол, бензол и нитробензол.
Если в бензольном кольце заместителей больше, чем один, то их ориентирующее влияние может быть согласованным или несогласованным, в зависимости от их типа и взаимного расположения.
Примером согласованной ориентации может служить реакция нитрования орто - нитрофенола и пара - нитрофенола до пикриновой кислоты (реакция б). В данном случае оба заместителя (электронодонорный – ОН, электроноакцепторный – NO2) согласованно ориентируют последующее электрофильное замещение в орто- и пара- положения по отношению к гидроксильной группе.
Ориентирующее влияние ЭД заместителя является определяющим в реакции электрофильного замещения, в случае его несогласованного ориентирующего действия с ЭА заместителем.
Правила ориентирующего влияния заместителей используют для целенаправленного синтеза, включающего несколько последовательных реакций. Например, чтобы получить из толуола орто-, мета - и пара - нитробензойные кислоты необходимо в определенной последовательности провести реакции нитрования и окисления.

Метильная группа (- СН3) относится к электронодонорным заместителям, соответственно по правилам ориентирующего влияния направляет электрофильное замещение в орто - и пара - положения (а).
Карбоксильная группа ( - СООН) является электроноакцепторным заместителем, соответственно по правилам ориентирующего влияния направляет электрофильное замещение в мета - положение (б).
Таким образом, чтобы получить из толуола все изомеры нитробензойной кислоты необходимо провести синтез в соответствии со схемами реакций, представленными ниже.
а) Схема синтеза орто - и пара - изомеров нитробензойной кислоты предполагает первоначально провести реакцию нитрования, а затем – окисления:
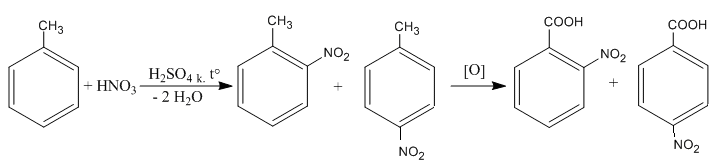
б) Схема синтеза мета – изомера нитробензойной кислоты предполагает первоначально провести реакцию окисления, а затем – нитрования:

Реакции присоединения и окисления
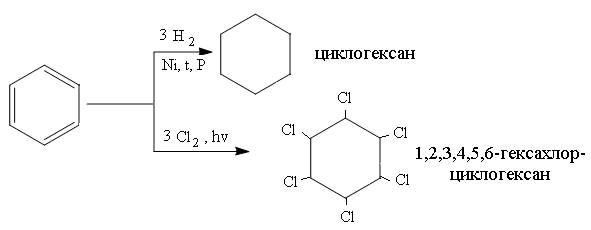
Реакции присоединения бензола протекают в жестких условиях, так как сопровождаются нарушением ароматических свойств молекулы.
Гидрирование бензола протекает в присутствии катализатора (Ni, Pd или Pt), температуре более 200оС и давлении с образованием циклогексана.
Хлорирование бензола проводят при интенсивном ультрафиолетовом облучении с образованием гексахлорциклогексана (гексахлоран).
Гомологи бензола вступают в реакцию галогенирования по типу радикального замещения в боковой цепи, которое характеризуется предпочтительным замещением водорода у менее гидрогенизированного атома углерода:

Окисления бензола и его гомологов. Бензол устойчив в обычных условиях к действию таких окислителе как азотная кислота, раствора перманганата калия, хромовой смеси, пероксида водорода. В жестких условиях окисления кислородом в присутствии катализатора оксида ванадия (V2O5, 450оС) бензол окисляется до малеинового ангидрида:

малеиновый ангидрид
Гомологи бензола, независимо от длины и разветвленности радикала боковой цепи, всегда окисляются по - углеродному атому боковой цепи с разрывом С - С связи. Окисление возможно при действии раствора перманганата калия в кислой или щелочной среде при нагревании, что всегда приводит к образованию бензолкарбоновой кислоты и алкилкарбоновых кислот, в зависимости от числа и размера радикала.
Ниже приведены примеры окисления гомологов бензола:
а)
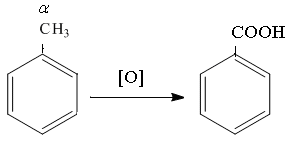
толуол бензойная кислота
б)

пропилбензол бензойная этановая
кислота кислота
в)
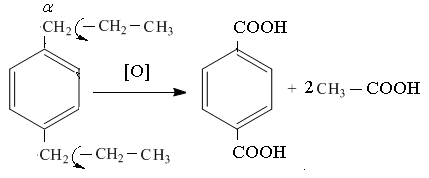
1,4-дипропил- бензол-1,4-
бензол дикарбоновая кислота
Реакции окисления боковых цепей гомологов бензола используют с целью их идентификации. Число и относительное положение боковых цепей можно определить, окисляя соединения в соответствующие кислоты, которые затем можно идентифицировать различными физико-химическими методами.
Реакции электрофильного замещения конденсированных аренов
Реакции электрофильного замещения в нафталине протекают в более мягких условиях, предпочтительно по 1 – положению (или α-), повышение температуры реакции приводит к образованию продукта замещения водорода во 2 – положение (или - ).
Галогенирование нафталина осуществляется в присутствии галогенидов металлов при температуре 20-40оС.
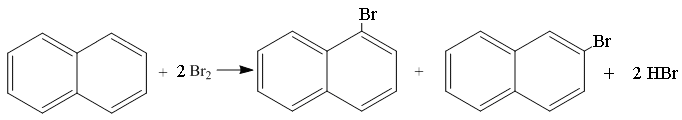
1-бромнафталин 2-бромнафталин
(99%) (1%)
б) Нафталин нитруется азотной кислотой в уксусном ангидриде при слабом нагревании или нитрующей смесью при комнатной температуре, повышение температуре способствует образованию более устойчивого - продукта.
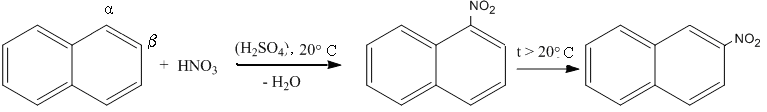
1-нитронафталин 2-нитронафталин
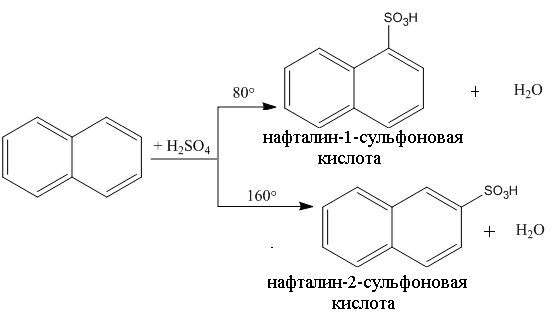
в) Сульфирование нафталина является примером термодинамически контролируемой реакции. Действие безводной концентрированной серной кислоты при 80оС приводит к образованию нафталин-1-сульфоновой кислоты, а повышение температуры до 160оС – нафталин-2-сульфоновая кислота:
г) Ацилирование нафталина хлористым ацетилом при 0оС приводит к образованию предпочтительно 1- ацетилнафталина, выше 30оС – 2- ацетилнафталина:

Реакции присоединения для нафталина протекают в более мягких условиях в сравнении с бензолом. Например, гидрирование по одному бензольному кольцу возможно при действии водорода в момент выделения, в условиях каталитического гидрирования нафталин превращается в насыщенный декагидронафталин (тетралин).
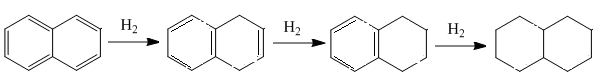
тетралин декалин
Окисление нафталина протекает легче, чем бензола. В более мягких условиях окисления образуется нафтахинон-1,4, при действии сильного окислителя – происходит разрушение одного из колец с образованием дикарбоновой кислоты по схеме:

Отдельные представители
Бензол (С6Н6) - жидкость с характерным запахом, почти нерастворимая в воде. Получают бензол при сухой перегонке каменного угля и переработки нефти. Широко используется в промышленности в качестве растворителя и сырья для синтеза красителей, полимеров, взрывчатых веществ, поверхностно - активных веществ.
Бензол токсичен, вдыхание паров вызывает острое отравление, приступы головокружения, судороги. В организме углеводороды подвергаются С - гидроксилированию (окисление с ообразованием гидроксисоединений) и выводятся из клетки. Однако бензол окисляется очень медленно, поэтому накапливается в организме и относится к кумулятивным ядам.
Толуол (метилбензол) - бесцветная жидкость, нерастворимая в воде. Применяют для получения бензола, бензойной кислоты, сахарина, взрывчатых веществ, лаков. Толуол добавляют к моторному топливу как высокооктановый компонент бензинов. Толуол примерно на два порядка мене токсичен, чем бензол, так как окисляется в организме до бензойной кислоты и быстрее выводится из клетки.
Кумол (изопропилбензол) - жидкость, является важным продуктом для синтеза фенола и ацетона кумольным способом.
Цимол (пара-метилизопропилбензол) - является основой многих эфирных масел.
Стирол (винилбензол) - приятно пахнущая жидкость, исходный мономер для получения полимеров, например, полистирола, который применяют в качестве электроизоляционного материала. При сополимеризации с бутадиеном получают некоторые виды синтетических каучуков. Полистирольные полимеры, содержащие функциональные группы кислого или основного характера, используют в качестве ионообменных смол.
Ксилолы (диметилбензолы) используют в качестве компонента высокооктановых бензинов и растворителей в лакокрасочной промышленности, а так же применяют для получения полиэфиров.
Нафталин - бесцветные пластинки, обладающие высокой летучестью (возгонка) и характерным запахом. Используется для получения фталевого ангидрида, фталевой кислоты, растворителей (тетралин и декалин) и разнообразных других производных.
Антрацен - твердое вещество, в виде антрахинона используется в синтезе антрахиноновых красителей.
Фенантрен в частично или полностью гидрированном состоянии входит в состав стероидных гормонов, алкалоидов как основной структурный компонент.
Сернистые соединения нефти
Сера является наиболее распространенным гетероэлементом в нефти и нефтепродуктах. Содержание ее в нефтях месторождений России изменяется от 0,05% до 3%.
Таблица 26
Содержание серы в нефтях некоторых месторождений
Месторождение |
S,% |
Месторождение |
S,% |
Доссоское |
0,11-0,15 |
УСТЬ-Балыкское |
1,77 |
Майкопское |
0,18-0,28 |
Покровское |
2,2 |
Сахалинское |
0,33-0,5 |
Ишимбаевское |
2,5-2,95 |
Шаимское |
0,46 |
Арланское |
2,9 |
Мухановское |
0,67 |
Бугурусланское |
2,92 |
Самотлорское |
0,96 |
Могутовское (Оренбургская обл.) |
3,0 |
Ухтинское |
1,12-1,24 |
Ромашкинское |
1,61 |
В соответствии с технологической классификацией в зависимости от содержания серы нефти подразделяются на три класса:
I- малосернистые, содержание до 0,5% серы;
II- сернистые, содержание до 0,51 -2,0% серы;
III- высокосернистые, содержащие более 2,0% серы.
С повышением температуры кипения нефтяных фракций содержание в них серы увеличивается. До 60% всей серы нефти содержится во фракциях топлив и масел (выкипающих до 4500С), 40% и более в мазуте. Распределение серы по фракциям иллюстрируется данными таблицы 27.
Таблица 27
Распределение серы (в масс. %) по фракциям различных сернистых и высокосернистых нефтей
Район добычи нефти |
Фракции, 0С |
|||
НК-120 |
120-200 |
200-250 |
250-300 |
|
Башкортостан |
0,02-0,57 |
0,08-1,74 |
0,35-2,5 |
0,67-3,95 |
Татарстан |
0,02-0,25 |
0,05-1,04 |
0,17-2,29 |
0,72-3,13 |
Самарская область |
0,01-0,27 |
0,02-0,75 |
0,02-1,61 |
0,07-3,18 |
Оренбургская область |
0,01-0,18 |
0,11-0,67 |
0,38-1,17 |
1,18-2,40 |
Пермская область |
0,02-0,1 |
0,06-0,59 |
0,12-4,56 |
0,25-2,59 |
Сибирь |
0,01-0,05 |
0,02-0,36 |
0,16-0,72 |
0,43-1,58 |
Распределение серы по фракциям зависти от природы сернистых соединений.
Характеристика сернистых соединений нефти
Сера в нефти и нефтепродуктах может содержаться в виде неорганических соединений серы: элементная сера и сероводород и органических: меркаптаны, сульфиды, дисульфиды, тиофены, тиофаны. Значительная часть серы нефти входит в состав смолисто-асфальтеновых веществ, это не идентифицированная сера.
Элементная сера и сероводород в сырых нефтях содержатся в незначительных количествах или не содержатся совсем. Они появляются в нефтях или в нефтяных фракциях в результате вторичных реакций. Сера может получаться при окислении сероводорода кислородом воздуха.
![]()
Или при термическом разложении дисульфидов
![]()
В свою очередь, дисульфиды образуются при окислении меркаптанов
![]()
Сероводород обычно образуется в процессах переработки нефти в результате термического разложения меркаптанов и сульфидов или при реакции углеводородов с серой.
![]()
Б.Н.Айвазовым как критерий термической стабильности сернистых соединений было предложении сероводородное число – количество Н2S(в мг), выделяющегося при нагревании 100 г нефти при 3000С в течение часа. Сероводородное число не связано с общим содержанием серы, так как, оно изменялось от 4,2 до 300,6 при изменении содержания серы от 0,7 до 30,3%. Оно связано с термической стабильностью сернистых соединений, что важно в процессах переработки нефти. Качественно сера и сероводород обнаруживаются по реакции
![]()
![]()
Меркаптаны RSH, или тиоспирты,или тиолы. Называюся про радикалу с добавлением слова меркаптан или тиол. Радикалы могут быть любые: алифатические, нафтеновые, ароматические:
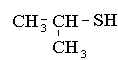
изопропилмеркаптан
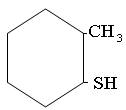
2-метил-циклогексилмеркаптан
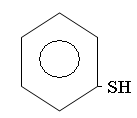
фенилмеркаптан или тиофен
В виде меркаптанов сравнительно немного серы нефти – от 1 до 15% от всей серы нефти.Однако известны исключения из этой закономерности. Так нефть Марковского месторождения (Иркутская область) при общем содержании серы 0,96% содержит 0,77% меркаптановой серы; фракция 40-2000С газоконденсата Оренбургского месторождения содержит 1,24% общей серы, в том числе 0,297% меркаптановой. В наибольшем количестве меркаптаны содержатся в бензиновой фракции, с повышением температуры кипения их содержание быстро уменьшается; это связано с их низкой термической стабильностью. До 3000С меркаптаны разлагаются с образованием сульфидов.
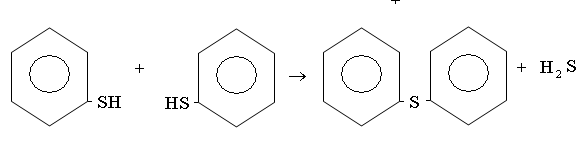
При более высоких температурах - до олефинов
![]()
![]()
![]()
Сероводород может вновь присоединиться к олефину
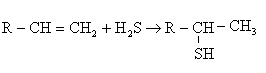
Интересной особенностью алкилтиолов бензиновых фракций является то, что SH- группа чаще находится при вторичном или третичном атоме углерода, чем при первичном, что свидетельствует об их вторичном происхождении. По увеличении термической стабильности меркаптаны располагаются в ряд: первичные, вторичные, третичные, ароматические.
Слабыми окислителями (кислород воздуха, иод)меркаптаны окисляются до дисульфидов.
![]()
![]()
Сильными окислителями (азотная кислота, гидроперекиси(образующиеся при окислении углеводородов)) - до сульфокислот и даже до серной кислоты.

Образованием кислот, более агрессивных, чем меркаптаны, объясняется высокая коррозионная активность меркаптанов. С другой стороны, разрушая гидроперекиси, меркаптаны тормозят окисление углеводородов.
Будучи , и обладая кислотными свойствами, меркаптаны взаимодействуют со щелочами, оксидами и солями металлов.
![]()
![]()
![]()
Промывка бензинов водно-щелочным раствором едкого натра ( спирт добавляется для снижения гидролиза меркаптида натрия) используется для демеркаптанизации бензинов. Реакция с PbO является качественной реакцией на меркаптаны( докторская проба), после удаления Н2S.
![]()
![]()
Образование черного осадка PbS свидетельствует о наличии меркаптанов. Реакция с AgNO3 используется для количественного определения меркаптанов (титрованием) после удаления сероводорода. Соли образованные меркаптанами, называютмя меркаптидами с добавлением названия радикала (метилмеркаптид калия, бутилмеркаптид свинца) и т.д.
В настоящее время выделено более 50 различных меркаптанов с числом углеродных атомов от 1 до9; из них более 40 алкилтиолов, 6 циклоалкилтиолов и тиофенол.
Все меркаптаны имеют неприятный запах,низшие используются для одорации природного газа.
Сульфиды или тиоэфиры подразделяются на алифатические (диалкилсульфиды) и алициклические (тиацикланы), содержащие атом серы в цикле.
Алифатические называются по названию радикалов:
![]() диметилсульфид
диметилсульфид
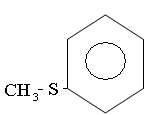
Метилфенилсульфид
Циклические сульфиды называются как углеводороды с тем же числом углеродных атомов, включая серу, с добавлением приставки тиа:

Тиациклопентан
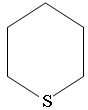
Тиациклогексан
Или по количеству метиленовых групп –СН2, связанных через атом серы: тетраметиленсульфид, пентаметиленсульфид
Сульфида содержатся в бензиновых и в основном в средних фракциях нефти, где они могут составлять более половины всех сернистых соединений. В бензиновых фракциях содержатся в основном диалкилсульфиды, в керосино-газойлевых и масляных фракциях – в основном циклические сульфиды.
Таблица 28
Групповой состав сульфидов различных нефтей
Месторождение |
Пределы выкипания фракции, 0С |
Содержание на сумму сульфидов,% |
Содержание на сумму тиацикланов, % |
||||||
Арланское |
190-360 |
14,3 |
77,5 |
8,2 |
63 |
22 |
11 |
4 |
|
Западно-Сургутское |
190-360 |
11,7 |
82,8 |
5,5 |
72 |
20 |
6 |
2 |
|
Самотлорское |
190-360 |
7,2 |
88,2 |
4,6 |
63 |
24 |
10 |
3 |
|
Хаудаг |
150-350 |
0,5 |
95,9 |
3,6 |
61 |
26 |
11 |
2 |
|
Кызыл-Тумшук |
150-350 |
7,2 |
90,0 |
2,8 |
59 |
27 |
10 |
4 |
|
Ляль-Микар |
200-400 |
16,8 |
80,5 |
2,7 |
66 |
22 |
10 |
2 |
|
Кокайты |
200-400 |
8,3 |
90,0 |
1,7 |
77 |
17 |
4 |
2 |
|
Из таблицы видно, что большая часть сульфидов в керосино-газойлевых фракциях представлена циклическими (в основном моно- и бициклическими) сульфидами,в небольших количествах тиациклановое кольцо сконденсированос ароматическим. С повышением температуры кипения фракции доля таких соединений увеличивается.
Количество диалкилсульфидов (тиацикланов) снижается с повышением температуры кипения фракции; выше 3000С они практически отсутствуют. Углеводородные радикалы, содержащие три и более атомов углерода, обычно связаны с серой по вторичному углеродному атому.

Выделено более 50 тиаалканов, в т.ч. все изомеры С2-С6.Алкилциклоакилсульфиды и алкиларилсульфиды изучены в меньшей степени.
В тиацикланах цикл, содержащий атом серы, может входить в полициклическую систему,содержащую до семи колец. Атом серы чаще входит в пятичленный цикл (тиациклопентан) –на 60-70% и в 30-40% случаев –в шестичленный(тиациклогексан).
В полициклических системах атом серы
всегда находится в
![]() -положении
к соседнему кольцу. В американских
нефтях было обнаружено следующее
соотношение бициклических систем:
-положении
к соседнему кольцу. В американских
нефтях было обнаружено следующее
соотношение бициклических систем:
 ≈
35:50:15
≈
35:50:15
В нефтях были также обнаружены сернистые соединения мостикового строения:
-Бициклические
Трициклические
 тиаадамантан
тиаадамантан
Среднюю молекулу тиацикланов средних фракций можно изобразить следующим образом:
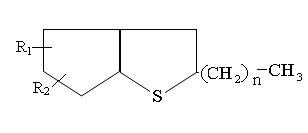
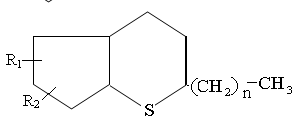
Где R1 и R2 – СН3 или С2Н5; n = 2÷6.
С повышением температуры кипения фракции увеличивается количество циклов в молекуле, реже- растет длина алкильных цепей.
Ароматические серусодержащие соединения представлены производными
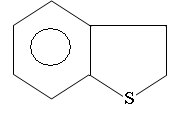
тиаиндана

Тиатетралина с алкильными цепями.
Основные реакции сульфидов
Обусловлены в основном наличием двух неподеленных пар электронов у атома серы.
С протоном кислоты
сульфиды дают сульфониевые соединения:

Эта реакция используется в промышленности для извлечения сульфидов из нефтяных фракций. Процесс идет в две ступени: на первой ступени используется 86%-ная серная кислота, при этом извлекаются сульфиды алифатического и нафтенового строения; на второй ступени используется 91%-ная серная кислота, при этом извлекаются сульфиды ароматического строения. После отделения сульфониевые соединения разлагаются при разбавлении водой.
Сульфиды дают комплексные соединенияс солями тяжелых металловза счет передачи неподеленной пары электронов атома серы на свободную электронную орбиталь акцептора. Важнейшие комплексообразователи: хлорид алюминия, тетрахлорид титана, ацетат серебра, хлорид ртути (I I), карбонилы железа.
![]()
Комплексы разлагаются водным раствором аммиака или горячей водой. Реакция эта используется для извлечения сульфидов из нефтяных фракций(часто ацетатом ртути) или для извлечения редких и драгоценных металлов (Pt,Pd,Ag,Au, Ir и др.) из растворов.
Сульфиды окисляются различными окислителями(Н2О2, НNO3, кислород воздуха, гидроперекиси) с образованием сульфоксидов и сульфонов
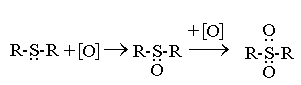
Сульфоксид Сульфон
При окислении нефтепродуктов сульфиды взаимодействуют с образующимися гидроперекисями, разрушая их
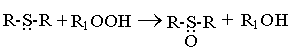

И тем самым тормозя процесс окисления. Этим объясняется антиокислительное действие сульфидов и сульфоксидов. Оно в большей степени проявляется при действии сульфоксидов, чем сульфидов. Некоторые сульфоксиды (диметилсульфоксид) и сульфоны (тетраметиленсульфон, сульфолан) используют как экстрагенты для извлечения ароматических углеводородов из нефтяных фракций.
Среди продуктов глубокого окисления сульфидов присутствуют, наряду с сульфоксидами и сульфонами, сульфокислоты, непредельные соединения, альдегиды и кетоны.

В термическом отношении сульфиды устойчивее меркаптанов, чем объясняется присутствие их в средних и высших фракциях нефти. Циклические сульфиды устойчивее алифатических.
Разлагаются сульфиды вначале до меркаптанов и олефинов, затем до сероводорода и олефинов:
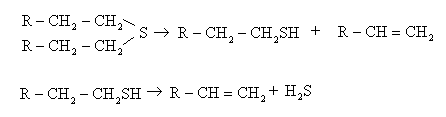
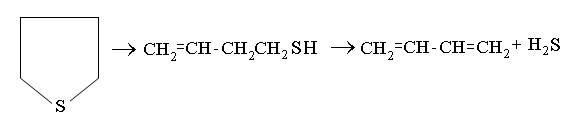
Количественно сульфиды определяются по реакции:
2RSR+2HCl+KIO3 2RSOR+ICl+RCl+H2O
Дисульфиды содержатся в небольших количествах, составляя 7-15% всей серы нефти. Присутствуют во фракциях до 3000 по свойствам подобны сульфидам. Восстановление ( водородом в момент выделения) приводит к меркаптанам:
R-S-S-R+2H 2RSH
Реакция используется в аналитической практике, они определяются в виде меркаптанов.
Тиофены отличаются высокой термической стабильностью и присутствуют в средних и высших фракциях нефти. В средних фракциях содержатся алкилпроизводные тиофена:2;3-метил,2;3-этил, реже пропилпроизводные; 2,3; 2,4; 2,5; 3,4-диметилтиофены.
Реже встречаются циклоалкилтиофены, они содержат одно или два конденсированных с тиофеном нафтеновых кольца.
Гораздо более распространены арилтиофены:

Дибензтиофен
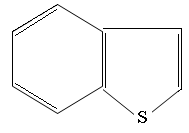
Бензтиофен
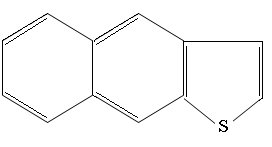
Нафтотиофен
и их алкилированные гомологи.
В виде тиофенового кольца сера входит в состав САВ нефти.
В химическом и термическом отношении тиофены устойчивы к окислению; проявляют ароматический характер.
В присутствии катализатора все сернистые соединения гидрируются с потерей серы в виде сероводорода, на этом основано обессеривание нефтепродуктов.
Влияние сернистых соединений на свойства нефтепродуктов
Во всех нефтепродуктах содержание серы лимитируется, что является следствием вредного ее влияния на их свойства.
В топливах высокое содержание серы вызывает коррозию. Коррозионной активностью обладают некоторые сернистые соединения (активная сера, меркаптаны) и продукты ее сгорания.(SO2,SO3 и образующиеся кислоты).
|
содержания серы в бензине |
износ цилиндров и поршневых колец возрастает |
|
|
с 0,05% до 0,1% |
в 1,5-2 раза |
|
|
С 0,1% до 0,2% |
1,5-2 |
|
|
С 0,2 % до 0,3% |
1,3-1,7 |
Высокое содержание серы снижает теплоту сгорания топлив. Низкосернистые, малосернистые и сернистые мазуты марок 40 и 100( содержание серы до 2%) имеют низшую теплоту сгорания 40530-40740 кДж/кг, а высокосернистые (содержание серы до 3,5%)- 39000-39900 кДж/кг.
Сернистые соединения отравляют катализаторы, которые используются в процессах переработки нефти.
Сера из нефтепродуктов удаляется гидрированием, но поскольку сернистые соединения обладают антиокислительными свойствами, к гидроочищенным нефтепродуктам (топливам, маслам) добавляют антиокислительные присадки.
Основные этапы образования нефти
Академик Трофимук Андрей Алексеевич
1-й Осадконакопление
-

Губкин Иван Михайлович (1871-1939)(« Учение о нефти» 1932) считал сапропель (смесь органических остатков растительного и животного происхождения водоемов) исходным веществом при образовании нефти. Большие количества органических вещества могли образоваться в результате массового отмирания планктона* (* совокупность организмов, населяющих водное пространство континентальных и морских водоемов; фитопланктон – водоросли в том числе и микроскопические; зоопланктон- моллюски, ракообразные, яйца и личинки рыб)
Диатомовые водоросли (одноклеточные, имеют кремневый панцирь, за 8 дней массу Земли)
2-й биохимический
-

Под действием ферментов бактерий, которые являются биокатализаторами происходит уплотнение, частичное обезвоживание осадка, сопровождающееся выделением газов углекислый газ, аммиак, сероводород, пары воды, метан.
Органический осадок, смешавшись с глинистыми породами, превращается в твердое углеподобное вещество – кероген
3-й протокатагенез
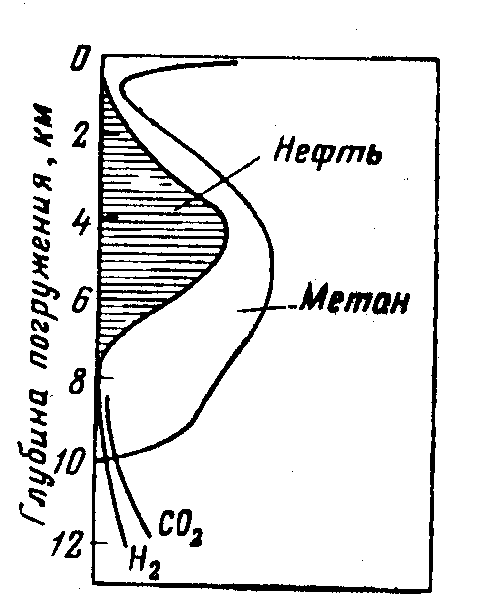
идет медленное погружение керогена 50-300м/млн лет, затухают биохимические процессы, вследствие гибели микроорганизмов, глубина погружения в конце этапа 1,5-2 км, повышается температура до 50-70 0С
4-й мезокатагенез.
Вследствие увеличения глубины залегания слоя (в конце этапа 3-4 км) увеличивается температура и давление, что ведет к разрыву наиболее слабых связей м/д атомами С-С, С-О, С-N, С- S, упрощается строение органических молекул, происходит отделение орг составляющей керогена от глинистых пород. Образовавшиеся углеводороды под действием капиллярных сил проникают из глинистых нефтематеринских пород в пористые песчаники (первичная миграция), на этом пути теряется основная часть (до 90 %) САВ. По существу то, что попадает в песчаные коллекторы это и есть нефть, Поэтому данный этап Вассоевич Николай Брониславович (1902-1981) назвал ГФН
Первичная миграция
|
Вторичная миграция (скопление нефти в пористых пластах в моменты тектонических перестроек за счет гравитационных и других сил. Начало формирования нефтяного месторождения.
|
5-й апокатагенез
Глубина погружения слоя >4,5 км, температура более 180, генерация нефти завершена, начинается генерация метана ГФГ
С ростом глубины залегания нефть становится более легкой, далее идут газоконденсаты, далее природный газ
Кислородные соединения нефти
Содержание кислорода в нефти обычно ниже, чем содержание серы, оно составляет несколько десятых процента, в смолистых нефтях – до 1%, в высокосмолистых – до 2%.
Большая часть кислорода нефти (до 90%) входит в состав смол и асфальтенов, и только около 10% в состав дистиллятных фракций, эти соединения изучены лучше.
Идентифицированные кислородные соединения подразделяются на кислые и нейтральные.
Кислые извлекаются раствором щелочи: в их состав входят органические кислоты и фенолы. Кислоты в свою очередь подразделяются на алифатические и нафтеновые, общее их название нефтяные кислоты. Среди кислых соединений нефти преобладают нафтеновые кислоты, алифатических значительно меньше, не более нескольких сотых процента, фенолов –до 0,1%. В последние годы было найдено, что содержание фенолов выше в молодых мало превращенных нефтях.
Таблица 29
Содержание фенолов в нефтях западносибирских месторождений
месторождение |
|
содержание фенолов, мг/л |
Федоровское |
0,9189 0,8978 0,9030 0,8917 |
41,4 143,0 40,2 128,0 |
Холмогорское |
0,8504 |
95,0 |
Уренгойское |
0,7588 |
216,0 |
Калиновское |
0,7970 |
92,0 |
Урманское |
0,8645 |
276,0 |
Количество нефтяных кислот оценивается с помощью кислотного числа. Кислотное число – это количество мг КОН, необходимых для нейтрализации кислот в 1г нефти или нефтепродукта (тяжелого).
Для топлив определяется кислотность –количество мг КОН, необходимых для нейтрализации 100 мл топлива.
Содержание нафтеновых кислот в нефтях невелико: от 0,01% до 2%, оно выше для тяжелых нафтеновых нефтей, в парафиностых нефтях содержание нафтеновых кислот меньше (табл.30).
Таблица 30
Содержание нафтеновых кислот в некоторых нефтях
месторождение |
|
Содержание нафтеновых кислот, % |
Балаханы, тяжелая |
0,9190 |
1,76 |
Бинагады |
0,9115 |
1,61 |
Грозненская, беспарафиновая |
0,8625 |
1,0 |
Калужская |
0,9580 |
0,80 |
Доссорская |
0,8620 |
0,80 |
Майкопская |
0,8931 |
0,40 |
Грозненская, парафиновая |
0,8432 |
0,20 |
Грозненская, слабопарафинистая |
0,8354 |
0,18 |
Шаимская |
0,8270 |
0,04 |
|
|
|
С повышением температуры кипения нефтяных фракций, содержание в ней нафтеновых кислот увеличивается, достигая максимума в средних масляных фракциях, затем в тяжелых может снижаться (табл. 31).
Таблица 31
Распределение нафтеновых кислот по фракциям нефти
Дистиллят |
Содержание нафтеновых кислот, % на фракцию |
|
Доссорская нефть |
Калужская нефть |
|
Керосиновый |
0,18 |
0,60 |
Газойлевый |
0,36 |
2,60 |
Вазелиновый |
0,93 |
|
Трансформаторный |
1,13 |
|
Веретенный |
1,32 |
5,30 |
Машинный |
0,40 |
4,30 |
Цилиндровый |
|
3,20 |
Строение нафтеновых кислот
Нафтеновые кислоты подходят под гомологический ряд СnH2n-2O2, СnH2n-4O2, если выделить карбоксильну группу, то получатся формулы Сn-1H2n-1 СОOН, Сn-1H2n-3 СОOН и т.д., т.е. нафтеновые кислоты содержат одно, два или более (до пяти) нафтеновых колец.
Первые кислоты выделенные их бакинских нефтей, были моноциклическими в числом углеродных атомов С7-С11.
Природа циклической части исследовалась по реакции Н.Д.Зелинского: кислоты восстанавливались до углеводорода, последний подвергался дегидрогенизации:
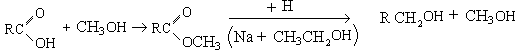
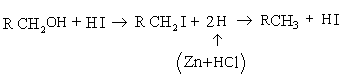
При дегидрировании полученных углеводородов выявлялись лишь следы ароматических; это говорило о том, что циклы в молекулах исследованных кислот в основном пятичленные.
Можно подвергать дегидрированию метиловые эфиры нафтеновых кислот, так позднее было доказано наличие в бакинской нефти циклогексанкарбоновой кислоты:
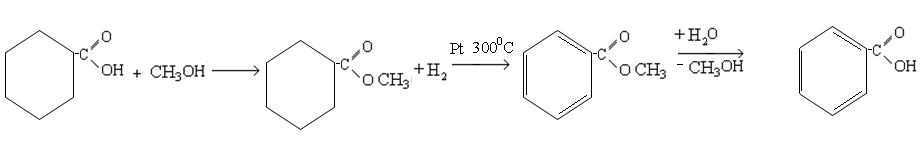
Нафтеновый цикл и карбоксильная группа обычно бывают разделены одной или несколькими метиленовыми группами; один из методов доказательства этого – метод постепенного расщепления. По этому методу от кислоты отщепляется по одному атому углерода, при этом образуется кислота, содержащая на один атом углерода меньше, и так до тех пор, пока не образуется циклический кетон, и дальнейшее образование кислоты становится невозможным.
Вначале исследуемая кислота подвергается этерификации, затем превращается последовательно в спирт, четвертичную аммониевую соль и олефин, который в результате озонолиза дает альдегид и кислоту.

Циклопентанкарбоновая кислота после такого же цикла превращений дает кетон
Характеристика кислородных соединений нефти
Нафтеновые кислоты
Первые выделенные нафтеновые кислоты были моноциклические с пятичленным циклом; их общую формулу можно описать следующим образом
 n=0-5
n=0-5
Формулы индивидуальных кислот:
1,2,3-триметил-циклопентан-уксусная
2,3-диметил-циклопентанпропионовая
Нафтеновые кислоты не содержатся в бензиновой фракции , т.к. самые глекие из них имеют Ткип выше 2000С (циклопентанкарбоновая 2150С)
В нефтях обнаружены кислоты содержащие от 1-до3 полиметиленовых колец в молекуле. Циклы обычно имеют от 1 до 3 метильных заместителей, при большом числе углеродных атомов в молекуле С19-С23 заместители могут быть более длинными. Трициклических кислот содержится меньше, чем моно и бициклических, тетрациклических еще меньше (аналогия с нафтеновыми углеводородами).
Из тетациклических кислот были идентифицированы кислоты с радикалом стероидной структуры:

Пентациклические кислоты не были выделены индивидуально, но они могут иметь строение, аналогично строению кислот, выделенных из битуминозных пород (типа гопилуксусной):

Углеводородный радикал кислоты может содержать ароматические циклы, обычно они сконденсированы с нафтеновыми циклами:


В состав САВ нефти входят асфальтогеновые кислоты,содержащие в своем составе гетероциклы.
Содержание кислот жирного ряда значительно меньше, чем нафтеновых, число углеродных атомов в них увеличивается с температурой кипения фракции. В сравнении с углеводородами кислоты имеют более высокие температуры кипения, чем углеводороды с тем же числом углеродных атомов из-за образования водородных связей.
|
Муравьиная |
100,70С |
|
уксусная |
118,1 |
|
Пропионовая |
141,1 |
|
Масляная |
163,5 |
|
изомасляная |
154,4 |
|
Валериановая |
187,0 |
|
Изовалериановая |
176,7 |
|
капроновая |
205,0 |
Кислоты с числом углеродных атомов С6-С16 содержатся в керосино-газойлевых фракциях (до 3500С).
Были выделены алифатические кислоты с числом углеродных атомов до 25.
Интересной группой алифатических кислот являются кислоты изопреноидного строения. Были выделены с доказательством их строения кислорты:
2,6,10-триметилундекановая

3,7,11-триметилдодекановая
2,6,10,14-тетра метилпентадекановая

3,7,11,15-тетраметилгексадекановая
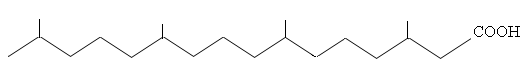
Алифатических кислот содержится больше в нефтях типа А(парафинового и нафтено-парофинового типа), нафтеновых –в нефтях типа Б (нафтеновых и парафино-нафтеновых).
Фенолы присутствуют в нефтях в незначительных количествах. Они выделяются действием щелочей вместе с нефтяными кислотами. Разделить их можно действием СО2; феноляты разлагаютсяэтим соединением, а соли жирных кислот с ним не взаимодействют:
Фенолы в отличие от солей жирных кислот не растворяются в растворе соды.
С помощью газожидкостной хроматоргафии установлено присутствие в нефтях фенола и следующих его производных:
|
|
о-,м-,п-крезолы |
|
|
2-этил фенол |
|
|
4-этил фенол |
|
|
2-изопропил фенол |
|
|
2,6-диметил фенол |
|
|
6-метил-2-этил фенол |
|
|
2,3-диметил фенол |
|
|
3,4-диметил фенол |
|
|
3,5-диметил фенол |
|
|
2,5-диметил фенол- преобладают 2,4-диметил фенол |
|
|
|
|
|
2,3,6-триметил фенол |
|
|
1,4,6-триметил фенол |
Соотношение между фенолом и алкилфенолами колебалось в пределах от 1: (0,3-0,4) до 1:(350-564) и зависело от глубины залегания нефти, т.е. от температуры вмещающих пород и возраста нефти, т.е. от температуры вмещающих пород и возраста нефти.
В высококипящих фракциях нефти присутствуют фенолы, содержащие до шести конденсированных колец, но их строение не расшифровано. Предполагают, что полициклические фенолы содержат насыщенные циклы с алкильными заместителями. С увеличением числа ароматических колец в молекуле фенолов уменьшается количество алкильных заместителей.
Нейтральные кислородные соединения изучены очень мало. По природе это могут быть кетоны, простые и сложные эфиры.
Из бензиновой фракции калифорнийской нефти выделено шесть индивидуальных кетонов:
Ацетон
Метилэтилкетон
Метилпропилкетон
Метилизопропилкетон
Метилбутилкетон
Этилизопропилкетон
В средних и высококипящих фракциях обнаружены циклические кетоны типа ацетил-изопропил-метил циклопентан
и флуоренан
Простые эфиры – циклические , типа фурана

В западно-сибирских нефтях найдены ди- и трибензфураны, а также динафтенопроизводные.
Сложные эфиры обычно содержатся в высших фракциях или в остатках.
В калифорнийской нефти найдены эфиры насыщенной структуры типа:
![]()

Многие сложные эфиры являются ароматическими соединениями, иногда представленными внутренними эфирами –лактонами:
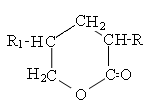

Большая часть кислорода кислорода нефти входит в состав смолисто-асфальтеновых веществ.
Влияние на свойства нефтепродуктов
Нафтеновые кислоты оказывают корродирующее действие на металлы, взаимодействуя с металлами и их оксидами. Они легко образуют соли со свинцом, цинком, медью, на черные металлы действуют слабо, еще слабее на алюминий.
Содержание кислот в нефтепродуктах нормируется с помощью кислотности доля топлив и кислотного числа для масел.
Кислоты обладают противоизносным и защитным действием, т.к. адсорбируясь на поверхности металла, они дают защитную пленку. Гидроочищенные топлива (реактивные) обладают плохими противоизносными и антиокислительными свойствами, поэтому к ним добавляются противоизносная и окислительная присадки. В качестве противоизносной присадки используется присадка «К», которая представляет собою нафтеновых кислот. Она добавляется к гидроочищенным топливам РТ и Т-6 в количестве 0,001-0,004%; при этом не превышается допустимая кислотность 0,2-0,7мг КОН/100мл топлива.
Применение нафтеновых кислот.
Нафтеновые кислоты один из немногих классов гетеросоединений нефти, которые извлекаются из нефти и находят промышленное применение. Нефтяные кислоты выделяются из нефтяных фракций раствором щелочи с последующим разложением солей серной кислотой. Получаются следующие продукты:
Дистиллирование нефтяные кислоты-продукты вакуумной перегонки нефтяных кислот, выделенных из cветлых фракций нефти. Применяют в лакокрасочной промышленности в качестве сиккативов- ускорителей высыхания лака.
Технические нефтяные кислоты (асидолы А-1 и А-2) – продукты разложения натриевых солей нефтяных кислот, полученных на базе масляных дистиллятов или остатков от дистилляции нефтяных кислот, полученных их светлых нефтепродуктов. Содержание нафтеновых кислот в них не менее 42% (А-1) и 50% (А-2);остальное –масла. Применяют в качестве эмульгаторов для пропитки шпал для предохранения их от гниения, в качестве растворителей различных смол и анилиновых красителей, как сиккативы.
Асидол-мылонафт-смесь нефтяных кислот и их натриевых солей, получаемая при неполном разложении натриевых солей нефтяных кислот серной кислотой. Применяется в мыловаренном производстве, в текстильной, кожевенной и других отраслях промышленности наряду с мылонафтом.
Мылонафт- натриевые соли нефтяных кислот. Применяют в качестве заменителя жиров при изготовлении мыла, при крашении в текстильной промышленности, в качестве исектицида и фунгицида, в качестве эмульгатора водных эмульсий.
Соли меди защищают древесину и текстиль от бактериального разложения; нафтенаты кальция и алюминия являются загустителями при получении консистентных смазок; соли кальция и цинка являются диспергирующими присадками к моторным маслам; соли свинца, кобальта служат сиккативами; соли алюминия в скипидаре используют как лаки.
Гидраты:
Гидраты газов представляют собой кристаллические соединения –включения (клатраты), характеризующиеся строго определенной структурой, которые могут существовать в стабильном состоянии, не являясь химическими соединениями. Физические свойства и состав гидратных образований будут определяться давлением газожидкостного потока и температурой, скоростью потока, соотношением содержания нефти, воды и газа, состоянием внутренней поверхности насосно-компрессорных труб и др.
По существу гидраты - это твердые растворы, где растворителем является вода, молекулы которой за счет водородной связи образуют объемный каркас, в полости которого внедряются легкоподвижные молекулы газов. В зависимости от формы и размера молекулы газа, находящегося в контакте с водой, молекулы воды образуют каркас определенной структуры, степень заполненного определяется внешним давлением и температурой.
Типы кристаллических решёток газовый гидрата и размещение в них полиэдрических полостей: структуры 1(а) и структуры 2 (б).
Гидраты являются соединениями, в состав которых входит молекулы газов, способных проникать через решетку гидратного каркаса (метан, этан..), но углеводороды, молекулы которых больше молекулы изобутана, не могут проникать внутрь каркаса, а поэтому не образуют гидратов. Состав гидрата определяется из выражения 8G.46Н2O или G1.5,75H2O,где G1может быть молекулой Ar,CH4 ,H2S и другие, При образовании гидрата такими газами, размер молекул которых не превышает 5,2 0А, могут быть заполнены полностью малые и большие полости. Если диаметр молекулы газа (С2Н6,Cl2,SO2 и т.д.)
превышает 5,2 0А, то заполняются только большие полости гидрата. Также процесс образования гидратов определяется состоянием воды, внешним давлением и температурой. С увеличением минеральных солей в воде температура начала гидратообразования уменьшается.