
- •Часть 2
- •1. Цель работы:
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №2 Химические свойства элементов VI а-группы (на примере серы)
- •1. Цель работы:
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №3 Химические свойства элементов V а-группы
- •1. Цель работы:
- •2. Теоретическая часть Соединения азота
- •Соединения фосфора
- •Соединения мышьяка, сурьмы, висмута
- •3. Экспериментальная часть
- •Часть 2
- •Лабораторная работа №4
- •1. Цель работы:
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №5 Химические свойства элементов III а-группы (на примере бора и алюминия)
- •1. Цель работы:
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №6 Химические свойства s-элементов
- •1. Цель работы:
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №7 Жесткость воды
- •1. Цель работы:
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №8 Химические свойства элементов II в-группы
- •1. Цель работы:
- •2. Теоретическая часть
- •3. Экспериментальная часть
- •Лабораторная работа №9 Сравнение химических свойств металлов
- •1. Цель работы:
- •2. Теоретическая часть
- •Некоторых полуреакций
- •3. Экспериментальная часть
- •Лабораторная работа №10 Коррозия металлов
- •1. Цель работы:
- •2. Теоретическая часть
- •2.1. Коррозионные гальванические микроэлементы
- •2.2. Контактная коррозия
- •2.3. Защита от коррозии
- •3. Экспериментальная часть
- •Лабораторная работа №11 Качественные реакции
- •1. Цель работы:
- •2. Теоретическая часть
- •3. Экспериментальная часть
Лабораторная работа №10 Коррозия металлов
1. Цель работы:
исследование влияния природы металла, среды и внешних условий на процессы коррозии металлов и ознакомление со способами их защиты от коррозии.
2. Теоретическая часть
Коррозией называется разрушение металлов вследствие химического воздействия окружающей среды. При коррозии металлы окисляются. Коррозия приводит к большим материальным потерям, происходящим в результате нарушения целостности трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т.д. Безвозвратные потери металлов от коррозии составляют 8–10 % от ежегодного их выпуска.
По механизму протекания коррозия подразделяется на два типа:
1) химическую, которая наблюдается при взаимодействии металлов с сухими газами и жидкостями, не проводящими ток (неэлектролитами);
2) электрохимическую, которая наблюдается при взаимодействии металлов с растворами электролитов.
К электролитам относится вода обычная и морская, растворы солей, кислот и щелочей, влажные газы.
2.1. Коррозионные гальванические микроэлементы
Электрохимическая коррозия является следствием возникновения коррозионных гальванических микроэлементов (коррозионных гальванических пар), состоящих из катодных и анодных участков. Появление катодных и анодных участков на поверхности металлов происходит по следующим причинам:
– неоднородность поверхности металла вследствие включений иной природы, ударов и изгибов, накопления примесей на границах зерен, участков с разной степенью обработки и т.д.;
– неоднородность жидкой фазы, в которой происходит коррозия из-за различия концентрации ионов, рН среды, неравномерного доступа кислорода или других окислителей;
– различие внешних условий: температуры, давления, действия электрического поля и т.д.
При возникновении коррозионного гальванического микроэлемента процесс электрохимической коррозии можно представить состоящим из четырёх стадий.
1. Окисление той части металла, которая имеет меньшее значение электродного потенциала; эта часть в коррозионном гальваническом микроэлементе является анодом.
2. Перенос заряда электронами (или переход электронов) по металлу от анодного к катодному участку.
3. Перенос заряда ионами в электролите.
4. Восстановление окислителя на катодном участке поверхности металла.
При электрохимической коррозии наиболее распространенными окислителями являются растворённый в щелочных растворах кислород и катионы водорода в кислой среде.
Растворенный в воде и щелочных растворах кислород восстанавливается на катодных участках металла по уравнению:
О2 + 4е + 2Н2О = 4ОН-
Катионы водорода в кислых растворах (кислород в кислой среде не растворяется) восстанавливаются по уравнению:
2Н+ + 2е = Н2
Катодные и анодные участки в металлах чередуются и имеют очень малые размеры, что соответствует коррозионным гальваническим микроэлементам. Таким образом, электрохимическая коррозия заключается в работе огромного числа гальванических микроэлементов, при которой происходит анодное окисление металла.
Коррозионный гальванический микроэлемент, в отличие от обычного гальванического элемента, является короткозамкнутым микроэлементом. Форма его записи не отличается от записи электрохимической схемы обычного гальванического элемента, но для сокращения в ней не указывают окисленную форму. Например, коррозия железа в контакте с углеродом (обычная углеродистая сталь) во влажной атмосфере происходит в результате возникновения гальванических микроэлементов, анодными участками которых является металл, а катодными – включения углерода (рис. 1).
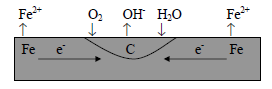
Рис. 1. Схема образования коррозионных гальванических микроэлементов в углеродистой
стали, находящейся во влажном воздухе
Полная и сокращенная форма записи такого элемента имеют вид:
(–)Fe | Fe2+ || 2H2O, O2, 4OH- | C(+); (–)Fe | H2O, O2, | C(+)
Коррозия железа является результатом работы этого элемента. При коррозии железа идут следующие процессы:
анодное окисление: Fe – 2e = Fe2+
катодное восстановление: O2 + 2H2O + 4e = 4OH-
общее уравнение коррозии: 2Fe + O2 + 2H2O = 2Fe(OH)2
